先天性心脏病和心脏瓣膜病术后肺部感染的相关因素分析
刘建民,刘建斌,叶蕾,梁贵友
先天性心脏病和心脏瓣膜疾病是较为常见的心脏病变,外科手术治疗为其主要治疗手段之一。手术治疗可矫治畸形,改善心脏血流动力学,降低心脏前后负荷,减轻心室重构,提高了病人的生活质量。而术后肺部并发症是影响心脏疾病病人康复的主要因素之一。近来文献报道体外循环(CPB)心脏直视手术后肺部感染发生率为5%~7%[1-3]。针对先天性心脏病和心瓣膜术后发生肺部并发症的影响因素,两者是否存在差异,未见相关的研究报道。本研究对第一作者曾经工作单位的心脏手术病例进行回顾性总结,分析心脏手术后肺部并发症发生的危险因素,总结如下。
1 资料与方法
1.1一般资料本研究回顾性分析2013年6月至2016年6月开封市中心医院心外科心脏疾病490例,其中先天性心脏病322例,心脏瓣膜病168例。男191例,女299例,年龄范围为7月至81岁,年龄(22.49±24.76)岁,先天性心脏病年龄(15.27±20.34)岁,心脏瓣膜病病人年龄(38.59±27.63)岁。术后并发肺部感染共42例,先天性心脏病组20例,心脏瓣膜病组22例。其中具体情况见表2。病人或其近亲属对该手术签署知情同意书,本研究符合2013年修订的《赫尔辛基宣言》的要求。
1.2手术方式本研究病人常规采用仰卧位,前正中开胸,CPB心脏直视中低温停跳下行先天性心脏病畸形矫治术和瓣膜置换手术。其中单纯二尖瓣置换术84例,主动脉瓣置换术57例(包括Bentall 6例,升主动脉成形2例),双瓣膜置换27例,同期行三尖瓣成形术73例,左房折叠成型8例,左房血栓清除42例,心房纤颤者行改良迷宫射频消融术14例,合并冠状动脉粥样病变(狭窄>50%)者6例,同期行冠状动脉旁路移植术6例。
1.3统计学方法应用Microsoft Office Excel 2003及SPSS 19.0进行数据处理。本研究数据均为定性资料,以例数或百分率表示,采用χ2检验;对单因素分析中差异有统计学意义的相关因素进行logistic回归分析。以α=0.05为检验水准。
2 结果
本研究490例病人,发生术后死亡18 例,术后肺部并发症主要有肺部感染、肺不张、肺水肿、呼吸衰竭、气胸等。术后发生肺部感染42例,总发生率为8. 6%,其中先天性心脏病术后并发肺部感染20例,感染率6.2%;瓣膜置换术后并发肺部感染22例,感染率13.1%;术后合并肺不张23 例,发生率为4.7%;肺间质水肿或浸润21 例,发生率为4.3%;呼吸衰竭 17例,发生率为3.5%;气胸 6例,包含血气胸4例;术后咳嗽,气道分泌物增多,但肺部感染证据不足者25例。
单因素分析肺部感染发生与手术类型、高龄、抽烟、术前2周上呼吸道感染、手术时间≥180 min、 主动脉阻断时间≥60 min、肺动脉高压、呼吸机使用时间大于48 h有关,logistic回归分析提示手术类型、手术时间及肺动脉高压是肺部感染的独立危险因素。参见表1~3。
3 讨论
肺部并发症仍然是体外循环术后的常见并发症,最为常见的是肺部感染。其发生原因是多方面的,结合本研究病例及文献报道,大致因素有①术前:病史长、高龄[4]、术前2周内有感冒病史、抽烟、肥胖[5]、肺部基础疾病、营养不良(包括心源性营养不良)、急诊手术等。②术中:气管插管[5]和CPB,气管插管导致气道黏膜受损,屏障破坏,细菌繁殖与定居;心包内加入冰屑局部低温致膈神经麻痹、胸膜腔完整性破坏等手术副损伤;主动脉根部、上下腔静脉阻断及冷晶体停跳液灌注,造成急性肺热缺血和再灌注损伤,肺泡Ⅱ型上皮细胞分泌减少,肠道内环境的改变,造成细菌迁徙移位及菌群失调,以及术中或术后大量输血等。③术后:呼吸机辅助通气的使用(呼吸模式及潮气量的选择)不当致低氧血症,无菌操作不严格,未及时吸痰和/或排痰不力,心功能差、晶胶体比例失衡以及水中毒、二次开胸、术后疼痛处理不彻底,感染性心内膜炎、肾功能衰竭持续肾脏替代治疗(CRRT)、合并脑卒中造成病人无法自行咳嗽、咯痰以及低心排综合征病人安放心室辅助装置(VAD)或者体外膜肺氧合(ECMO)装置等均易导致术后肺部并发症的发生。
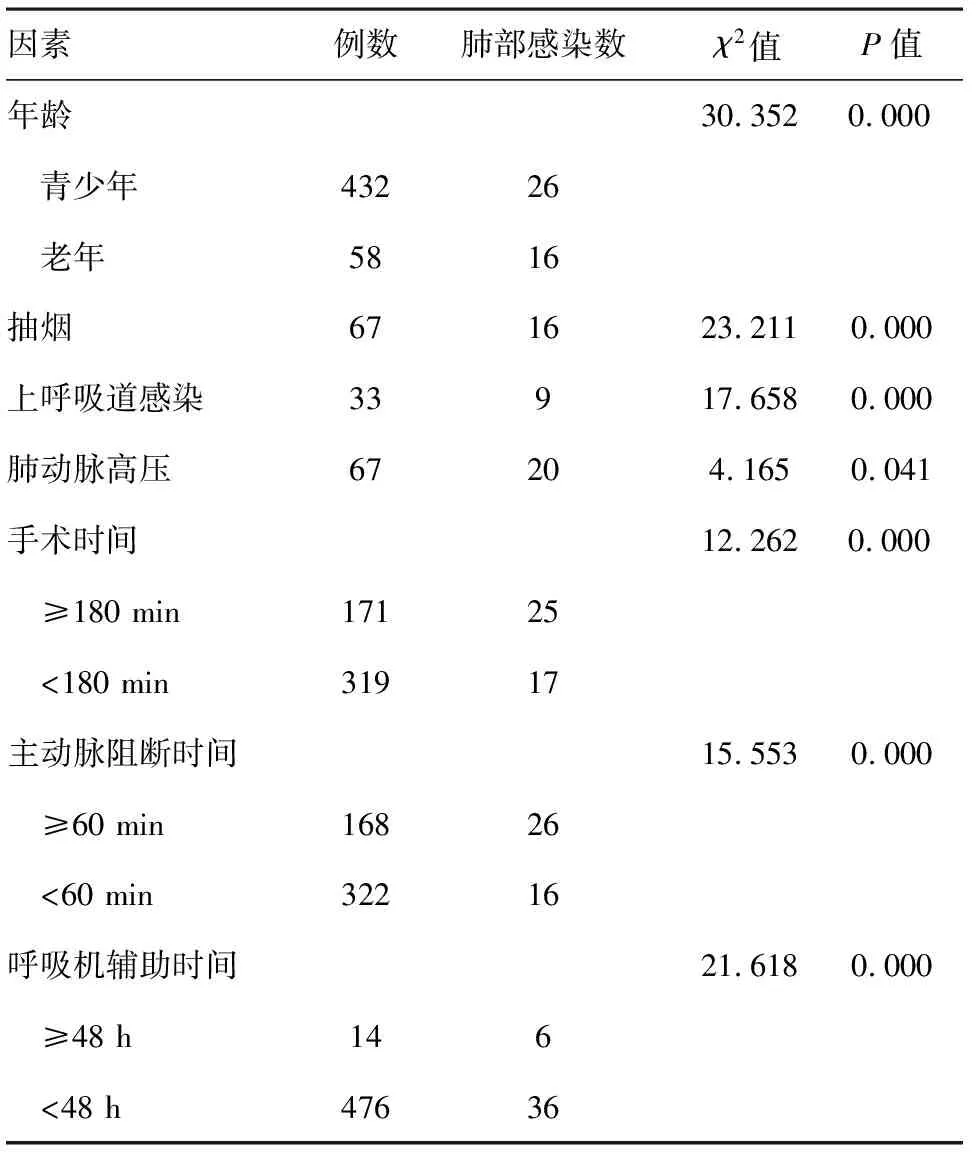
表1 心脏手术490例术后肺部感染相关因子单因素分析/例
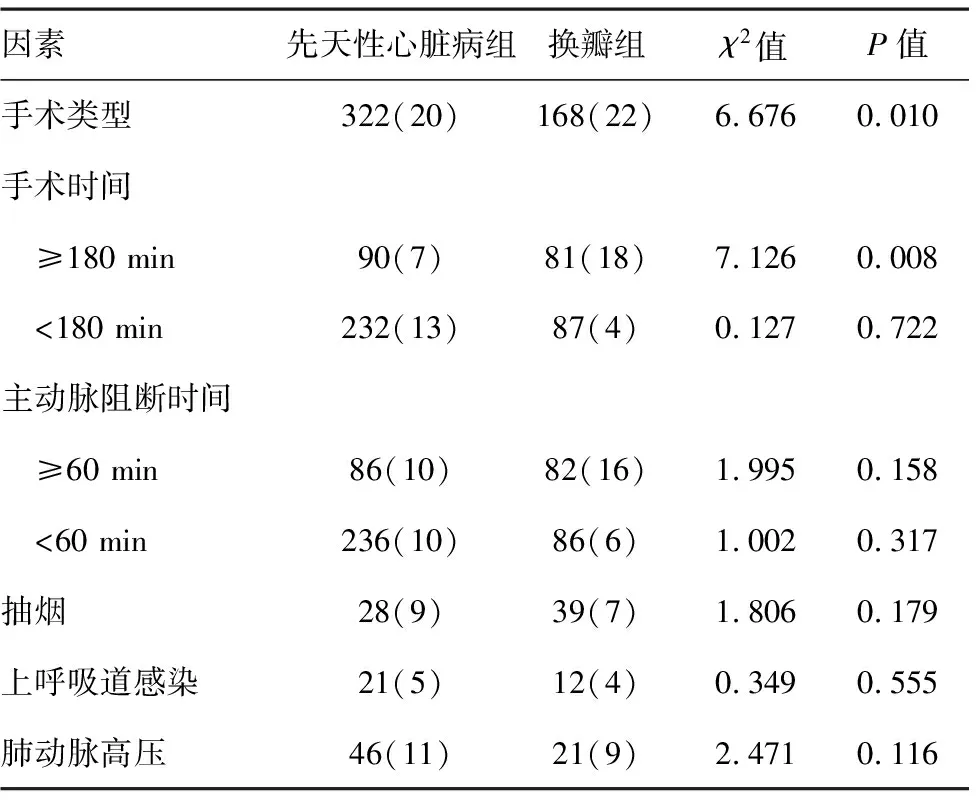
表2 心脏手术490例术后肺部感染情况的两组比较/总例数(肺部感染例数)
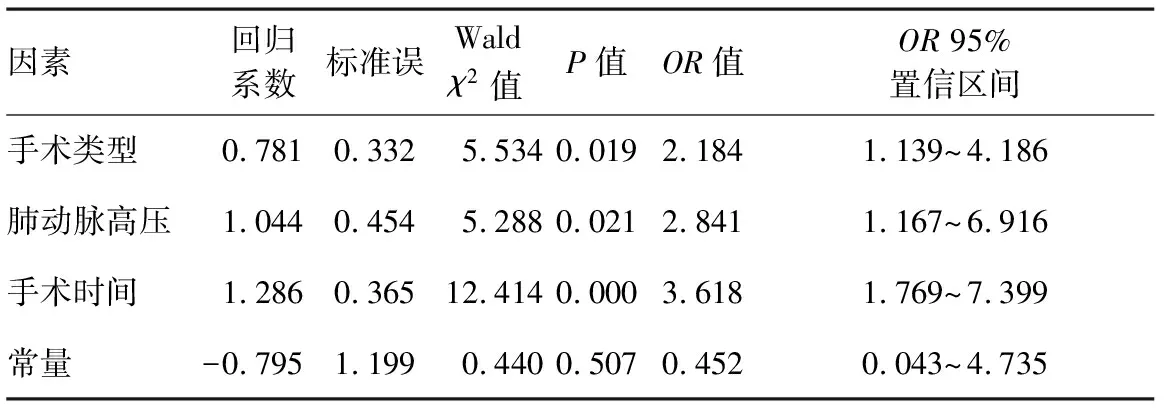
表3 心脏手术490例术后肺部感染logistic多因素回归分析
CPB术后肺部感染的发生率与术前是否存在基础病变、术中气管插管麻醉及手术精细操作、术后病情管理关系密切,各心脏治疗中心术后肺部感染率不尽相同,本研究病人术后并发肺部感染率8.6%,与近3年心脏手术后文献肺部感染5%~7%的报道接近。发生原因可能有①气管插管造成的气道损伤,特别型号偏大对气道黏膜的损伤更重,气管屏障受损,条件致病菌易于受损部位繁殖和定植;②呼吸机辅助通气,分泌物易于气管导管气囊远端及周围淤积和滞留,以及术前上呼吸道感染治疗不充分、控制不彻底,致使病原微生物随分泌物直接进入下呼吸道和肺部;③心脏瓣膜置换[6],大多手术时间较长,部分病人术前存在不同程度的肺动脉高压、肺部超微结构的改变以及肺淤血;④CPB中血液与非内皮体外循环管道接触导致补体激活、中性粒细胞的活化,肠道正常菌群失调及迁徙移位,造成全身炎症反应综合征;⑤术后病人身体相对虚弱,疼痛刺激呼吸表浅、咳嗽无力,肺内分泌物不能有效排出等。此外文献报道[7-8]肺部感染与气管插管及呼吸机辅助通气时间、手术麻醉管理、呛咳误吸、长期卧床等有直接关系。
本研究资料先天性心脏病322例,心脏瓣膜病168例,术后并发肺部感染42例,单因素分析提示危险因子包括老年、抽烟、术前2周上呼吸道感染、手术时间(≥180 min)、主动脉阻断时间(≥60 min)、肺动脉高压形成[9],呼吸机辅助时间(≥48 h)。logistic多因素分析提示:手术类型、手术时间(≥180 min)、肺动脉高压为心脏手术肺部感染的独立危险因素,术后发生肺部感染差异有统计学意义。肺动脉高压心脏手术病人术后肺部感染发生率高于无肺动脉高压病人,体外循环手术时间超过180 min也是心脏手术后肺部感染的独立危险因素。本研究发现心脏瓣膜置换术后肺部感染率高于先天性心脏病组,可能瓣膜病组病史长伴部分病人合并有不同程度的肺淤血或者肺部超微结构的改变,是造成术后肺部感染[10-11]的病理基础,心脏瓣膜置换手术时间及主动脉阻断时间较长,肺部仅由支气管动脉少量供血,致肺脏缺血再灌注损伤更为显著,有文献报道CPB手术时间与肺部感染成正相关[12]。心脏瓣膜病组平均年龄亦高于先天性心脏病组,麻药的用量,术后液体输注过快过多,呼吸道的管理不到位,不及时致分泌物的滞留,导致不同程度肺水肿和/或灶性肺不张,而致术后肺部感染发生。
本研究病人年龄构成存在差异,心脏瓣膜病病史相对较长,可能存在不同程度肺部潜在病变,如何减少心脏手术后肺部并发症仍有待进一步研究。

