干扰素调节因子4在风湿性心脏病中去泛素化作用的研究
胡程舟,张卓,陈文龙,周胤泽,段伟豪,李开朗,郭志祥
风湿性心脏病是甲组乙型溶血性链球菌感染人体后引起的变态反应性疾病,属于自身免疫性疾病,病人血常规检查白细胞介素(IL)-4的水平会有一定程度上升。 IL-4细胞因子主要由Th2细胞分泌,Th2辅助细胞的主要转录因子有GATA3、干扰素调节因子4(IRF4)等。有研究表明IRF4能促进IL-4的表达。
细胞内的各种转录因子调控不同的基因的表达,这些转录因子同时也受到机体各种调节机制的调节,其中翻译后修饰是一类十分重要的机制,泛素化与去泛素化修饰是翻译后修饰里比较重要的一种。Chen等[1]发现泛素化酶Stub通过促进泛素蛋白赖氨酸残基K48的多泛素化诱导转录因子FoxP3的阵解,从而负性调控调节性T细胞的抑制活性。USP4,是一种去泛素化酶,在肿瘤细胞的分裂增殖的过程起着重要的作用。Zhao等[2]研究表明USP4所参与的调节机制是一种经典的Wnt信号传导通路,USP4是一种新的负性调节因子。其抑癌机制为阻止Wnt信号通路的信号转导从而起到抑癌的效果。Xiao等[3]发现USP4可以使肿瘤坏死因子受体相关因子TRAF2和TRAF6去泛素化,进而阻碍肿瘤坏死因子-α(TNF-α)和IL-1β诱导核因子-κB(NF-κB)的表达。Wang等[4]研究发现USP4能够通过对天然免疫相关蛋白RIG-1的去泛素化调节病毒诱导的I型干扰素信号。 综上,USP4对细胞的凋亡、增殖、周期进程和维持细胞的稳态发挥重要作用,因而我们认为免疫细胞中转录因子IRF4泛素化和去泛素化调节同样重要,本研究通过探究IRF4的去泛素化修饰在Th2细胞功能表达中的作用来进一步阐释风湿性心脏病的发生机制,从而为风湿性心脏病的治疗方案选择提供新的思路。
1 资料与方法
1.1标本选取20例风湿性心脏病病人来源于2015年7月至2016年1月的安徽医科大学第一附属医院住院病人,均行体外循环下瓣膜置换手术,均顺利出院。10例健康对照来自于健康志愿者。分别抽取以上参与实验人员5 mL的外周血,用EDTA(乙二胺四乙酸二钾)抗凝管进行抗凝。病人平均年龄为50岁,病人或其近亲属知情同意。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2质粒、抗体本课题所用质粒均由中国科学院上海巴斯的研究所惠赠。抗Flag抗体,抗USP4抗体(Sigma,美国);抗Ha抗体,抗Ubiquitin抗体(Santa Cruz,美国);抗β-actin抗体(三箭生物,天津);PerCP/Cy5.5anti-humanCD45RA,FITC anti-humanCD4,PEanti-human CD25,PerCP/Cy5.5 anti-human IL-4购自美国BioleGend公司。Pb anti-human/mouse IRF4购自美国eBioscience公司。
1.3细胞培养与转染人胚肾细胞系(HEK-293T)(含10%胎牛血清的DMEM培养基);人源性原代幼稚CD4+T细胞和Th2细胞从健康人外周血获得,培养环境为含10%人AB血清,1%非必需氨基酸,1%谷氨酰胺和1%丙酮酸钠,1%青霉素和链霉素的X-VIVO15免疫细胞培养基中,以上细胞均在37 ℃,5% CO2培养箱中培养。课题所需聚乙烯亚胺(PEI)用在HEK-293T细胞系中转染。
1.4实时荧光定量PCR体外诱导分化Th2细胞,基因沉默后筛选1周,抽提出RNA并检测浓度。用1 μg RNA反转出cDNA用于实时荧光定量PCR。所用引物如下:USP4,上游引物:5′-TCAGCCGCTATGTGAAACAG-3′,下游引物:5′-GTGGTCTCACTGGGGTCATT -3′。肌动蛋白(ACTIN),上游引物:5′-CTCTTCCAGCCTTCCTTCCT -3′,下游引物:5′-CAGGGCAGTGATCTCCTTCT -3′。IL-4:上游引物:5′-GCCACCATGAGAAGGACACT-3′,下游引物:5′-ACTCTGGTTGGCTTCCTTCA-3′。IL-5:上游引物:5′-GGCACTGCTTTCTACTCATCGA -3′,下游引物:5′-AGTTGGTGATTTTTATGTACAGGAACA-3′。IL-10:上游引物:5′-TGCAAAACCAAACCACAAGA-3′,下游引物:5′-TCTCGGAGATCTCGAAGCAT-3′。IL-13:上游引物:5′-CTATGCATCCGCTCCTCAAT-3′,下游引物:5′-GGTGATGTTGACCAGCTCCT-3′。IRF4:上游引物:5′-AGAACGAGGAGAAGAGCATC-3′,下游引物:5′-CCTTTAAACAGTGCCCAAG-3′。
1.5免疫印迹和免疫共沉淀实验在转染之后得到的细胞用含有20 mmol/L Tris-HCl(pH7.5)、150 mmol/L NaCl、1 mmol/L 乙二胺四乙酸二钾,1% (v/v) NP-40、10% Glycerol、0.25% Na-deoxycholate的细胞裂解液进行处理,裂解液同时加入1 mmol/L PMSF(苯甲基磺酰氟),1 mmol/L NaF,1% protease inhibitor cocktail (西格玛)。在4 ℃细胞裂解15 min后,离心(12 000 r/min,4 ℃),取上清液。在获得的上清液中加入相对应的抗体在4 ℃孵育2 h,之后再加入Protein A或G beads孵育2 h。之后用之前的细胞裂解液清洗样品,离心(1 000 r/min,4 ℃),一共清洗4遍,后进行免疫印迹实验。
1.6His蛋白质体外结合实验将Flag-IRF4、Ha-USP4、His-ubiquitin质粒转染进HEK-293T细胞系中,在收细胞前3 h每个样品加入终浓度为20 nmol/L的MG132。收样时,首先用1×PBS洗一遍,再用buffer 1室温下裂解30 min。之后样品再与预洗涤NI-NTA(氨基三乙酸镍)Beads室温下孵育3 h。3 h后样品用buffer 1洗2遍,buffer 2洗两遍,Buffer3洗1遍。之后样品加2×loading处理,煮沸10 min,进行免疫印迹检测。
1.7shRNA慢病毒的包装和转导载体质粒pLKO.1-shCK,shUSP4-1和del8.9,VSV-G质粒共转入HEK-293T细胞中,其中pLKO.1载体购自美国addgene公司。shRNA引物来自以前的研究[5]。
48 h后收集病毒。将正在激活状态下的Th2细胞用病毒进行感染并在同一时间加入聚凝胺(8 μg/mL),第2天换新鲜培液。并在第3~4天加入嘌呤霉素筛选细胞。在第7~9天收细胞进行相关实验检测。
1.8流式细胞分析人外周血经过密度梯度离心法获得外周血单核细胞,使用丙二醇甲醚醋酸酯(25 ng/mL)和离子霉素 (1 μg/mL)对外周血单核细胞进行4 h处理,之后染色,再使用流式细胞仪进行分析处理。用于分选的外周血单核细胞则经染色后,分选初始T细胞,再分化成Th2细胞,再进行相关检测。
1.9统计学方法用Graphpad Prism软件行统计学分析,两组计量资料比较采用两独立样本t检验,检验水准为0.05。用Image J软件进行免疫印迹实验图像分析条带。
2 结果
2.1Th2细胞中的IRF4与USP4相互作用我们利用USP4筛选在T细胞中能与其相互作用的转录因子。我们在HEK-293T细胞中过表达带Ha标签的USP4和带Myc标签的转录因子,如GATA3,STAT6(信号传导及转录激活因子6),IRF4,PU.1,用anti-Ha做免疫共沉淀实验,再用免疫印迹实验方法检测。对比只转染了空对照质粒的细胞,在共转染的转录因子和USP4的Th2细胞中检测到被USP4拉下来的IRF4的强信号。提示USP4可能与IRF4相互作用。接着用带有Ha标签的USP4和带有Flag标签的IRF4及分别使用抗Ha和抗Flag进行免疫共沉淀实验。最后,进行免疫印迹实验。与用空对照质粒转染的细胞比较可见用IRF4和USP4共转染的细胞中检测到USP4或IRF4下拉的强IRF4或USP4的强信号(见图1A)。证明了IRF4和USP4之间的相互作用。体外诱导Th2细胞,利用Normal IgG和anti-USP4分别对Th2细胞的裂解液进行免疫共沉淀实验,我们检测到了anti-USP4沉淀下来了IRF4,证明了Th2细胞中USP4和IRF4相互作用(见图1B)。
2.2USP4稳定IRF4蛋白的稳定性受到去泛素化酶影响。为验证USP4对IRF4的作用,在HEK-293T细胞中表达Flag-IRF4和Ha-USP4,同时USP4逐步增加转染剂量。实验结果可见USP4对IRF4呈剂量依赖性(见图2)。
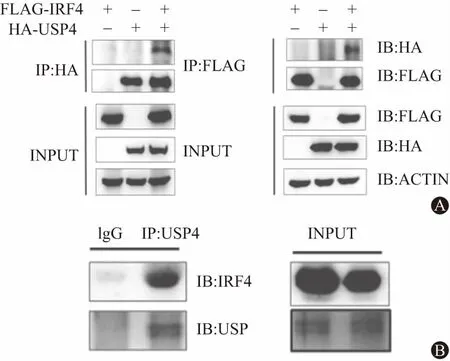
图1 Th2细胞中的IRF4与USP4相互作用:A为Flag-IRF4和Ha-USP4共转入六孔板的HEK-293T细胞中,在48 h后收集细胞,细胞裂解后分别加入抗Ha或抗Flag单克隆抗体沉淀各1 μg,再经抗Ha或Flag的单克隆抗体行免疫印迹分析;B为体外诱导Th2细胞,扩增至1千万,分成两份,裂解,加入1 μg标准IgG和anti-USP4沉淀,再经免疫印迹分析anti-IRF4抗体

图2 USP4稳定IRF4:相同剂量的Flag-IRF4依次与增加剂量的Ha-USP4共转入HEK-293T细胞;48 h后收集细胞,待细胞裂解测定USP4和IRF4表达水平
2.3USP4去泛素化IRF4为验证USP4对IRF4的去泛素化功能,用HEK-293T细胞以cDNA为模板获得泛素的编码序列,并将其克隆到pIPHis载体上。在HEK-293T细胞中瞬时表达Flag-IRF4,Ha-USP4,Ha-USP4C311A以及His-Ubiquitin再用Ni-NTA(氨基三乙酸镍)纯化沉淀和免疫印迹的方法检测(见图3A)。结果发现USP4可以去泛素化IRF4,而它的酶活突变体作用却不明显。为了探究RORγt主要受泛素上哪个位点的多泛素调节,我们构建了泛素突变体pIPHis-K48only和K63only(只有48位点或63位点为赖氨酸残基),我们在HEK-293T细胞中瞬时表达Flag-IRF4,Ha-USP4和His-Ubiquitin或其突变体(K48,K63only),通过Ni-NTA纯化沉淀,结果显示USP4同时介导IRF4 K48和K63位点的去泛素化。以上实验结果表明去泛素化酶USP4可以介导IRF4蛋白泛素K48、K63位的去泛素化(见图3B)。
2.4USP4,IRF4,NFATC2(活化T细胞核因子)共同作用IL-4的转录活性在Th2细胞中IRF4是一种关键的转录因子。IRF4的表达能被USP4稳定,IRF4与USP4共同作用可促进IL-4的活化,但效用不显著(见图4A)。但在转IRF4,NFATC2,USP4后,可发现IL-4的转录活性增加明显(见图4B,4C)。利用USP4的抑制剂vialinin A处理分化的Th2细胞,测得IL-4,IRF4的表达下降(见图4D)。
2.5Th2细胞中,下调USP4影响Th2相关细胞因子的表达Th2细胞中IRF4作为主要的转录因子,由此可推断出Th2细胞的功能可能受去泛素化酶USP4的影响。为了验证我们的推论,我们首先把USP4特异性短发夹RNA(shUSP4-1,2)克隆到慢病毒载体pLKO.1上,随后我们在HEK 293T细胞中包装出包含该段序列的病毒颗粒,再用病毒颗粒感染体外诱导分化形成的Th2细胞。感染成功后的Th2细胞有嘌呤霉素抗性,再用嘌呤霉素对细胞进行选择从而获得较纯的被病毒感染的Th2细胞。结果显示在Th2细胞中下调USP4(见图5A)后,Th2细胞内IRF4蛋白水平降低,与Th2相关的细胞因子IL-4,IL-10,IL-13的转录水平也显著降低(见图5B)。
2.6IL-4、IRF4的表达水平在风湿性心脏病病人中升高风湿性心脏病是一种十分复杂的自身免疫性疾病。急性期是Th1细胞起主要作用。在后期,IL-2、IL-17的作用更强。为探讨风湿性心脏病进行的病理机制,在获得健康人和符合风湿性心脏病诊断要求的病人的外周血单核细胞后用密度梯度离心法离心分离外周血单核细胞和用流式细胞技术检测可见IRF4,IL-4的水平均升高(见图6A,6B)。
3 讨论
风湿性心脏病是一种自身免疫性炎症反应性疾病。急性风湿热期(ARF)Th1分泌的γ-干扰素(IFN-γ)升高明显,而在风湿性心脏病时,IL-4上升。IL-4是一种抗炎症反应细胞因子,在风湿性心脏病转入慢性期时起到一定作用。IL-4在免疫性炎症反应中的作用已有研究,如在多发性硬化病中[5]。张锐和葛建军[6]研究表明IL-6水平高低与冠心病诊断有一定相关性。另外,Kikly K等也在病变的瓣膜及心肌组织中检测到IL-17的表达[7]。沈奎亚等[8]指出IL-17与TNF-α共同作用可促进p38蛋白激酶(p38 MAPK)的磷酸化过程而具有明显致炎作用。

图3 USP4去泛素化IRF4:A为在HEK-293T细胞内转染Flag-IRF4,Ha-USP4,Ha-USP4C311A,His-Ubiquitin,48 h后收获细胞,在此前MG132(20 μmol/L)处理3 h,Ni-NTA镍螯合树脂纯化沉淀物,再免疫印迹分析经处理抗Flag和抗Ha的单克隆抗体。细胞裂解液IRF4,USP4,ACTIN表达水平也经免疫印迹分析。B为HEK-293T细胞内共转Flag-IRF4,Ha-USP4,His-Ubiquitin突变体K63only,K48only,48 h后收集细胞,收细胞前MG132(20 μmol/L)处理3h,用Ni-NTA 镍螯合树脂纯化沉淀,再经抗Ha,抗Flag的单克隆抗体进行免疫印迹分析

图5 Th2细胞中,下调USP4影响Th2相关细胞因子的表达:A为DR8.9,shRNA,VSVG三质粒系统包装慢病毒,36~48 h后收集病毒,感染体外诱导分化好的Th2细胞,因构建shRNA携带嘌呤霉素抗性,所以在应用嘌呤霉素筛选一周后,直接裂解,用抗IRF4抗体进行免疫印迹,检测相关指标;B为用嘌呤霉素筛选1周后的Th2细胞抽提RNA并反转cDNA,使用实时定量PCR的方法检测相关基因(USP4,IRF4,IL-4,IL-5,IL-10,IL-13)的表达水平。aP<0.05,bP<0.01
T细胞受到外来抗原物质刺激后活化进而释放IL-4、IL-5、IL-13等细胞因子,其中IL-4较为重要。而后GATA3在IL-4的启动子附近聚集,进而促进IL-4表达[9]。通过利用USP4的小分子抑制剂Vialinin A处理体外诱导分化的Th2细胞时随着抑制剂剂量增加,IRF4,IL-4都会降低。这说明USP4能影响IL-4表达。Rengarajan等[10]发现IRF4与DNA结合不牢固,NFATC2和IRF4在结合后使NFATC2介导的IL-4的表达增加。活化后钙离子调控蛋白NFATC2可作为转录因子进入细胞核,参与调节细胞的多种功能[11]。我们研究发现USP4可以稳定IRF4的同时促进IL-4的表达。USP4、NFATC2、IRF4共同作用可以显著增加IL-4的表达。这可能是因为IRF4本身结合基因的能力较小,NFATC2和USP4共同作用于IRF4,使其形成一个稳定的复合体,从而促进IL-4的转录。IRF4存在于多种免疫细胞中,如Th2、Treg、Th17细胞[12]。
泛素化分为单泛素化、多重单泛素和多泛素化。多泛素化是将多个泛素单体通过异肽键进行连接,在靶蛋白赖氨酸上形成多泛素链,经研究证实不同位点的多泛素化发挥着不同的生理功能[13]。K48位点的多泛素化参与蛋白降解而K63位点的多泛素化参与DNA损伤修复、酶激活等。去泛素化在炎症反应中的研究目前越来越多。USP22去泛素化NFATC2,增加其稳定性并促进IL-2的表达[10]而USP17去泛素化RORγt增强IL-17的表达[14]。去泛素化酶USP21也通过泛素化调控Th2细胞转录因子GATA3的稳定性[15]。我们的研究发现去泛素化酶USP4可以介导IRF4蛋白泛素K48、K63位的去泛素化。这也是USP4影响IRF4稳定性的重要因素。此外,我们发现利用基因沉默下调USP4的表达,IRF4蛋白水平会下调,但转录水平会有所上升。这可能与USP4表达后,其对IRF4存在的泛素化和去泛素化修饰有关。
另外,我们的研究发现去泛素化酶USP4在风湿性心脏病病人外周血CD4+T细胞中表达升高,且风湿性心脏病病人的外周血的CD4+T细胞中IRF4、IL-4的表达也增多,我们考虑筛选USP4的小分子抑制剂作进一步研究,从而为治疗风湿性心脏病提供了新的治疗方向。
(本文图4,6见插图4-1)

