多功能载鲣鱼肽海藻酸钙微球的制备与表征
盛剑勇,肖俊勇,何家轩,孙宁泽,刘翠婷,彭天昊,马方励,刘卫
活性肽是保健食品中的一类功能因子,因其来源广泛、活性多样而成为目前的研究热点。鲣鱼肽是提取自深海鱼类鲣鱼的多肽,具有降尿酸的作用。与提取自海产品的鱼油、明胶等一样,鲣鱼肽具有强烈的腥味,消费者直接服用的体验较差。多肽的主要吸收部位是小肠,在胃中吸收往往较差[1]。但是,胃内酸环境和消化酶易使活性多肽发生降解,从而减弱其功效。此外,鲣鱼肽原料粉末通过喷雾干燥工艺制备所得,与喷雾干燥制得的中药浸膏粉一样具有吸湿性较强的特点,不利于后续制剂工艺的进行[2]。因此,鲣鱼肽的制剂需要弥补原料的缺点,提高顾客体验感,在保持鲣鱼肽活性的同时促进吸收,降低湿性。
大多数蛋白、多肽类保健食品功能因子的单次服用量大,因此通常被开发成液体饮料或固体饮料[3]。液体饮料的制备工艺一般包含热压灭菌,经历高温环境可能会降低功能因子的活性[4]。因此,冲剂等固体饮料是鲣鱼肽的理想剂型。海藻酸钙微球因其肠溶的特性和高生物安全性,已被广泛用于药品和保健食品的制剂[5-6]。课题组前期研究表明,海藻酸钙微球能够控制所载蛋白在胃中的释放,保护蛋白不被胃酶降解,从而促进其口服吸收[7]。我们假设产生异味的物质可能与活性肽一样也分散于海藻酸钙的凝胶网络中,从而减缓释放,达到掩味的效果。此外,将鲣鱼肽粉末制备成微球后,能够有效降低粉体的比表面积,从而降低吸湿性。综上,海藻酸钙微球有望同时弥补鲣鱼肽原料的缺点,有望成为理想的鲣鱼肽制剂中间体。
本研究拟通过微胶囊造粒仪制备载鲣鱼肽海藻酸钙微球。通过吸湿增重对微球的防潮性能进行评价;通过在模拟胃肠液中多肽的释放对鲣鱼肽的吸收进行预测;通过顶空进样气质联用技术确定鲣鱼肽原料中异味物质的指标性成分,依此检测载鲣鱼肽海藻酸钙微球在冲泡后异味物质的释放程度,对其掩味效果进行评价。
本研究起止时间为2016年3月至2017年8月。
1 实验材料与方法
1.1原料和仪器设备海藻酸钠(青岛双成有限公司,食品级,粘度300 cp.s),鲣鱼肽(无限极(中国)有限公司,食品级),BCA试剂盒(碧云天生物技术有限公司),微胶囊造粒仪(瑞士Buchi公司,B-390),显微镜(德国徕卡微系统有限公司,LEICA DM 3000 LED),凯氏定氮仪(上海洪记仪器设备有限公司,ATN-300),冷冻干燥机(北京博医康实验仪器有限公司,FD-1A-50),溶出试验仪(天大天发科技有限公司,RC12AD),气质联用仪(美国Agilent公司,5975)。
1.2载鲣鱼肽海藻酸钙微球的制备参照文献报道,对海藻酸钙微球的制备工艺进行适当优化,以适用于微胶囊造粒仪[8]。配制1.5% (W/V)浓度的海藻酸钠溶液,加入适量鲣鱼肽粉末,溶解,使鲣鱼肽与海藻酸钠的质量比为2∶1。通过氮气加压将鲣鱼肽和海藻酸钠的混合溶液泵入微胶囊造粒仪,载气压力为450 mbar,此时流速约为10 mL/min。当混合溶液流经300 μm孔径的喷嘴时,在喷嘴上施加振动,使混合溶液分散成小液滴,设置振动的频率为836 Hz。小液滴通过电压为1 000 V的电场,液滴之间因带同种电荷而相互分散,滴入1.5% (W/V)的氯化钙溶液中。边滴加边搅拌接收液。待滴加完成后,继续搅拌10 min。过滤收集微球。将所得微球在-20 ℃预冻12 h后,放入冷冻干燥仪冻干。
1.3微球的表征
1.3.1形态观察 称取载鲣鱼肽海藻酸钙微球适量,置于光学显微镜下(20×)观察微球形态,采集图片。
1.3.2鲣鱼肽含量的测定 使用凯氏定氮法测定海藻酸钙微球中鲣鱼肽的含量。精密称取载鲣鱼肽海藻酸钙微球质量m1(g),参照国家标准GB50095-2010的方法进行检测,记录耗费的盐酸滴定液体积V1(mL)。精密称取鲣鱼肽原料粉末质量m2(g),按上法操作,记录耗费的盐酸滴定液体积V2(mL)。按以下公式计算微球样品中鲣鱼肽含量:
1.4吸湿增重精密称取适量载鲣鱼肽微球或鲣鱼肽原料粉末置于称量瓶中,放入恒温恒湿稳定箱,置于25 ℃、相对湿度为65%的环境下,按时质量。将各个时间点的质量除以质量的初始值,计算得到增重百分率。平行制备三份样品,计算平均吸湿增重百分率,绘制平均吸湿增重百分率随时间变化的曲线。
1.5鲣鱼肽在模拟胃肠液中的释放参照文献分别配制pH=1.0的盐酸溶液和pH=6.8的磷酸盐缓冲液,分别作为模拟胃液和模拟肠液[9]。参照中国药典2015版附录“溶出度与释放度测定法”考察微球中鲣鱼肽在模拟胃肠液介质中的释放。在溶出杯中加入模拟胃液或模拟肠液900 mL,置于溶出度测定仪上,设置搅拌桨的转速为50 r/min,预热至37 ℃。精密称取载鲣鱼肽微球10 g,投入到溶出杯中,开始计时。分别在给定时间点取样5 mL,经0.45 μm滤膜过滤,取续滤液,并立即补充空白介质5 mL。使用鲣鱼肽原料粉末作为对照,按BCA法(蛋白测定方法)检测试剂盒说明书进行操作,对续滤液中鲣鱼肽的浓度进行测定。经过取样校正,计算得到各个时间点鲣鱼肽的累计释放百分率,绘制累计释放百分率-时间曲线。
1.6挥发性异味物质的检测参考文献,使用顶空进样气相-质谱联用的方法对鲣鱼肽原料粉末中的挥发性物质进行检测[10]。将DB-WAX色谱柱(30 m × 0.25 μm × 0.25 mm)装于气相色谱-质谱联用仪上,设置色谱柱的升温程序如下:起始温度70 ℃,保温3 min,7 ℃/min升到240 ℃,保持20 min。载气为氦气,设置体积流量0.8 L/min,分流比10∶1。精密称取鲣鱼肽原料粉末适量,置于顶空进样瓶中,加入水适量,立即置于顶空进样模块上,于85 ℃下保温30 min后顶空进样,温度95 ℃。MS检测器的条件为:电离方式为EI+,电子能量70 eV,灯丝发射电流为200 μA,接口温度250 ℃,质量扫描范围为35 ~350 m/z。检索NIST 08和WILEY数据库,对比质谱图,确定挥发性物质的组分。
1.7挥发性异味物质的体外释放精密称取载鲣鱼肽微球1 g(含鲣鱼肽0.19 g)置于顶空进样样品瓶内,加入水适量,立即按1.6所述GC-MS方法进样检测,记录色谱图。称取鲣鱼肽原料粉末0.04 g,加入水适量,溶解,同法检测,作为对照。对比载鲣鱼肽微球和对照样品中异味物质的释放量。
2 结果与讨论
2.1载鲣鱼肽海藻酸钙微球的表征海藻酸钠是提取自海藻的一类天然高分子。海藻酸钠在氯化钙水溶液中可发生交联,形成海藻酸钙凝胶。据此,向氯化钙溶液中滴注海藻酸钠溶液可制得海藻酸钙微球[11]。该制备在常温的水相中进行,有利于活性肽的稳定和保持活性。
然而,用传统的滴注法制备海藻酸钙微球效率低,批次之间差异性大,粒径较难控制。本研究对海藻酸钙微球的制备工艺进行改进,使用微胶囊造粒仪进行载鲣鱼肽海藻酸钙微球的制备。海藻酸钠和鲣鱼肽的混合溶液通过气压瓶输注入微胶囊造粒仪,液流在通过喷嘴时由于高频振动生成微球状液滴,液滴数目与同振动频率成正比。生成的液滴在电场的作用下带电,可通过静电分散技术防止液滴互相粘连[12]。最后,海藻酸钠和鲣鱼肽的混合液滴滴入氯化钙溶液中,交联固化,得到载鲣鱼肽海藻酸钙微球。使用微胶囊造粒仪进行制备可控性高,且易于实现工艺的放大。
通过微胶囊造粒仪制备的微球烘干后外形美观、大小均一,粒径在100 μm左右(如图1)。

图1 载鲣鱼肽海藻酸钙微球的显微镜图(放大20倍)
保健食品的单次服用量较大,所以制剂需要有较高的功能因子含量。用凯氏定氮法测得所制备的微球中鲣鱼肽的含量为18.9%。与同类研究相比,本研究所得微球的活性成分载量较高[13],有利于满足保健食品对功能因子含量的要求。
2.2吸湿性考察如图2所示,鲣鱼肽原料粉末在25 ℃、65%相对湿度(RH)环境下2 h的吸湿增重即达到60%左右,10 h的吸湿增重更是达到120%以上,并出现结块现象。鲣鱼肽原料粉末的吸湿严重,这是因为喷雾干燥所得的鲣鱼肽原料粉末较为疏松,具有较大的表面积,易于吸附空气中的水分子。鲣鱼肽原料吸湿后发生结块,且呈半固体状,流动性变差,难以与固体辅料混合均匀,使制粒工艺面临极大挑战。本研究所述鲣鱼肽微球的制备方法中,首先将鲣鱼肽原料粉末溶解在水中,再进行后续制备过程,避免了直接使用鲣鱼肽原料粉末进行制粒。

图2 载鲣鱼肽海藻酸钙微球和鲣鱼肽粉末吸湿增重随时间变化曲线
制备所得鲣鱼肽微球在25 ℃、65%RH环境下10 h的吸湿增重仅有9.78%,显著低于鲣鱼肽原料粉末。可见将鲣鱼肽制备成微球后,吸湿性显著降低。这一方面是由于微球的表面积较粉末减小,另一方面是由于吸湿性较强的鲣鱼肽粉末被海藻酸钙所包裹,从而与空气中的水分隔绝。本研究所制备载鲣鱼肽海藻酸钙微球的吸湿性得到了有效控制,有利于混合、填装等制剂工艺的开展。
2.3鲣鱼肽的体外释放评价使用BCA试剂盒对0.05~0.50 mg/mL浓度范围内的鲣鱼肽溶液进行测定,将吸光度值与鲣鱼肽浓度进行线性拟合,得到标准曲线方程为A=0.675 9C(mg/mL)+0.032 5,相关系数R2=0.994 3,线性良好。
在模拟胃肠液中,鲣鱼肽从微球中的释放曲线如图3所示。在模拟胃液中孵育2 h后,鲣鱼肽从海藻酸钙微球中的累计释放百分率低于3%,说明海藻酸钙微球能够有效控制鲣鱼肽在胃中的释放。在模拟胃液中孵育1 h后,鲣鱼肽从海藻酸钙微球中的累计释放百分率即大于90%,说明海藻酸钙微球能够在肠液中近乎完全释放鲣鱼肽。鲣鱼肽从所制备的微球中的释放行为达到了肠溶制剂的标准。该释放特性与其他关于海藻酸钙微球的报道相符[5,7]。
通过体外释放实验的结果可以对载鲣鱼肽海藻酸钙肠溶微球的体内行为进行预测。在口服后,该海藻酸钙肠溶微球在胃中可能仅释放少量的鲣鱼肽,有望在生理条件严苛且吸收较差的胃部对鲣鱼肽起到保护作用。当该海藻酸钙肠溶微球运行到小肠部位时,几乎所有的鲣鱼肽快速地从微球中释放,能够使鲣鱼肽在多肽的主要吸收部位小肠中达到较高浓度,有利于鲣鱼肽的吸收。
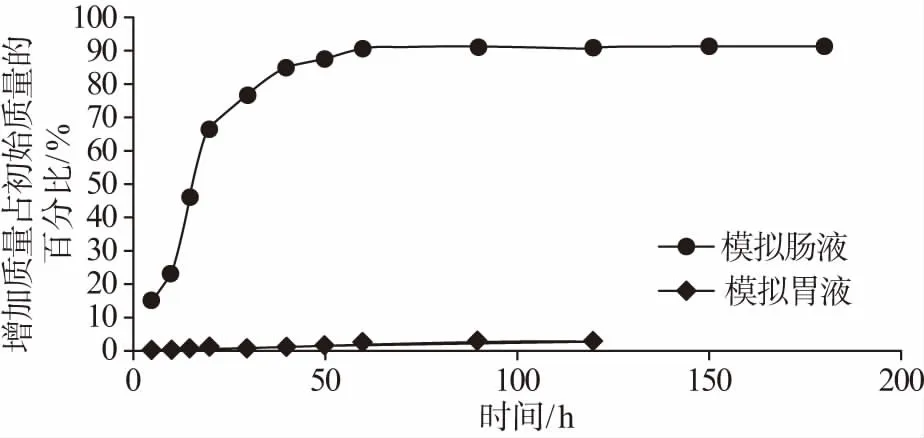
图3 鲣鱼肽微球在模拟胃液及模拟肠液中释放曲线
2.4挥发性异味物质的体外释放评价人类对于味道的实际感受受到嗅觉的影响。我们所感受到的味道是嗅觉和味觉的整合。与味觉相比,嗅觉是一种远感,是通过长距离感受化学刺激的感觉[14]。因此,嗅觉是消费者对保健食品的第一重感受之一。掩蔽鲣鱼肽原料的不良嗅味,对提高顾客体验非常重要。
有研究表明三甲胺、小分子醛类和酮类等是海产品中腥味产生的物质基础[15]。在对海藻酸钙微球的掩味效果进行研究之前,需要对鲣鱼肽原料异味的物质基础进行研究。气质联用(GC-MS)技术融合了气相色谱的分离与质谱的定性检测功能,具有灵敏度、特异性高的特点,是挥发性异味物质的检测和鉴定的常用方法[16]。在获得气质分析数据后,可通过谱库检索对挥发性组分进行鉴定,通过峰面积来对挥发性组分进行定量。顶空进样器可通过加热使固体、液体、半固体等无法直接进入气相色谱分析的样品挥发,然后吸取其气体进入色谱分析。
冲剂是鲣鱼肽的备选剂型之一。冲剂在服用前的热水冲泡过程会有利于鲣鱼肽中挥发性异味物质的扩散。因此,为了检测热水冲泡的过程中异味物质的释放,在装有载鲣鱼肽海藻酸钙微球的顶空进样瓶中加入水后,设置顶空进样器加热温度为85 ℃。使用GC-MS的方法对此时的挥发性物质成分进行检测,即可对冲泡过程中载鲣鱼肽海藻酸钙微球异味的物质基础进行研究。
使用顶空进样GC-MS对鲣鱼肽原料中的挥发性物质进行了检测,发现原料中的挥发性物质有三甲基丁醛、二甲基丁醇、二甲基二硫醚等,这些物质均有特别的嗅味。由于检测到的挥发性成分数量较多(6种),而所产生的嗅味是这些物质共同作用的结果,所以使用面积归一化法将各个组分的总离子强度进行加和,用于表征异味的强弱[17]。
使用上述方法对载鲣鱼肽海藻酸钙微球中的挥发性异味成分进行定量,并将鲣鱼肽原料作为对照,按同法进行检测。其中,微球中鲣鱼肽的量是对照组的5倍。结果如表1所示,鲣鱼肽微球样品中异味物质的峰面积总和小于鲣鱼肽原料对照组的峰面积总和。该结果表明所制备的鲣鱼肽微球在高温下释放出挥发性异味物质的量低于总量的20%,预示该海藻酸钙微球在冲泡过程中可掩盖80%的异味。
通过将鲣鱼肽原料制备成海藻酸钙微球已经可以对不良气味起到有效的掩盖。在后续制剂的制备过程中,还可以通过加入矫味剂和一些其他掩味策略的联合应用,进一步提高鲣鱼肽产品的顾客体验感。

表1 GC-MS检测鲣鱼肽原料和微球中挥发性成分所得峰面积
3 结论
本研究通过微胶囊造粒仪制备得到了载鲣鱼肽海藻酸钙微球,外观圆整,粒径分布均一。其吸湿性较鲣鱼肽原料显著降低,有利于后续制剂工艺的进行和长期储存。所制备的载鲣鱼肽海藻酸钙微球具有肠溶特性,预测在口服后能够在胃中保护所包载鲣鱼肽的活性,在小肠中能够形成较高的鲣鱼肽浓度,从而有利于吸收。通过顶空进样GC-MS对挥发性异味物质分析,所制备的海藻酸钙微球可在冲泡过程中掩盖80%的异味。本研究通过将鲣鱼肽原料粉末制备成海藻酸钙微球,解决了原料吸湿性强、在胃中易失活和感官刺激大的缺点,为后续制剂工艺提供了较好的制剂中间体,也为海洋来源活性肽保健食品制剂的开发提供了新的思路。

