白细胞介素-1基因多态性与种植体周围炎的相关性
赵祥宇,吴刘中,史春,卢永平,郭传波
(1. 沈阳市口腔医院修复科,沈阳 110002; 2. 沈阳市口腔医院牙周科,沈阳 110002;3. 大连医科大学附属口腔医学院口腔内科,辽宁 大连116044;4. 辽宁省计划生育科学研究院优生遗传科,沈阳 110031)
自从口腔种植体骨整合理论提出后,种植体材料不断创新,种植技术日趋成熟,种植体的成功率也越来越高[1]。但是种植修复后的并发症 (种植体周围炎、种植体周围黏膜炎、种植失败) 仍然是种植医师面临的棘手问题。种植体周围炎使种植体周围软组织和支撑骨组织功能丧失,是导致种植体松动失败的主要原因[2]。近年来研究[3-4]结果表明,种植体周围炎的发生不是均匀分布的,而是呈现聚集性,这种聚集现象的发生与遗传异质性相关[5]。
种植体周围炎与牙周炎的发病机制、临床表现相似,有牙周炎病史会增加种植体周围炎的患病风险[6]。研究[7]表明炎症细胞因子的基因多态性影响患者牙周细菌感染的炎症反应程度,也决定个体对牙周炎的易感性。牙周炎的发生与患者基因型相关,约50%以上牙周炎患者的病因是基因问题[8]。同样地,炎症细胞因子的基因多态性在种植体周围炎的发生中也起重要作用[9]。
白细胞介素-1 (interleukin-1,IL-1) 是结缔组织分解代谢的刺激剂,具有增强白细胞向组织迁移,激活成纤维细胞和免疫有核细胞的作用。 IL-1定位于2q13,包括IL-1 α、IL-1 β 和IL-1γn3种。这些基因的遗传多态性影响基因产物的表达,进而影响炎症的发生。有研究[10-11]报道IL-1多态性对种植体周围炎的发生有重要作用。本研究通过对IL-1基因进行分型,分析基因多态性与种植体周围炎发生的关系。
1 材料与方法
1.1 研究对象及分组
选取2008年9月至2015年9月沈阳市口腔医院种植科行种植体义齿修复的患者 (203例)。纳入标准:至少植入1颗及以上种植牙,并且完成修复时间1年及以上。根据患者有无种植体周围炎分为PI组 (有种植体周围炎,116例) 和NPI组 (无种植体周围炎,87例)。分组标准[12]:种植体周围探诊出血,化脓以及骨损失≥2 mm为种植体周围炎;无探诊出血,化脓和骨损失<2 mm为无种植体周围炎。PI组男47例,女69例,年龄32~64岁,平均年龄 (45.3±2.6)岁;牙周炎94例,无牙周炎22例;吸烟23例,不吸烟93例。NPI组男36例,女51例;年龄29~61岁,平均年龄 (43.2±3.4) 岁,牙周炎56例,无牙周炎31例;吸烟7例,不吸烟80例。2组患者性别、年龄比较差异无统计学意义 (χ2=0.015,P = 0.900;t = 0.68,P = 0.625),牙周炎、吸烟患者人数比较差异有统计学意义 (χ2分别为7.16、5.48,P分别为0.007、0.019)。所有患者均知情同意并签署了知情同意书。
1.2 样本采集和DNA提取
患者清水漱口后用无菌棉签在双侧脸颊内部上下轻刷数次,使棉签充分接触口腔黏膜。取样后放入装有生理盐水的离心管中保存。用口腔拭子基因组DNA提取试剂盒 (中国天根公司) 提取DNA,用 NanoDrop 1000 (美国 Thermo Fisher Scientific公司) 测定DNA浓度,用TE (10 mmol/L Tris,0.1 mmol/L EDTA,0.5mol/L NaCl) 统一标准化为50 ng/μ L。
1.3 IL-1基因多态性位点选择及PCR扩增
在千人基因组官网 (http://www.internationalgenome.org) 下载中国人群IL-1 α、IL-1 β 和IL-1γn的单核苷酸多态性 (single nucleotide polymorphism,SNP)位点信息,用Haploview 4.2 (https://www.broadinstitute.org/haploview/haploview) 进行分析,以MAF>0.1,r2>0.8进行tagger分析, 分别选择rs2856838、 rs3136558、 rs4252001作为IL-1 α,IL-1 β和IL-1γn的标记 SNP进行基因分型,见图1。采用聚合酶链反应-限制性内切酶片段长度多态性分析方法 (polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP) 进行基因分型。PCR反应体系:DNA 1 μ L,2×Taq PCR MasterMix 10 μ L,正、反义引物 (10 nmol/L) 各0.6 μ L,无菌去离子水补足至20 μ L。PCR扩增程序:94 ℃变性5 min;94 ℃变性30 s,58 ℃复性30 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min,4 ℃保持。各基因PCR引物、内切酶及片段长度见表1。
1.4 限制性酶切及电泳
PCR完成后,取2.5 μ L扩增产物,分别加入相应的内切酶 (2 U),加入10×CutSmart Buffer 1 μ L,去离子水补足至10 μ L。37 ℃反应2 h,取5 μ L酶切产物进行电泳,根据电泳条带进行基因分型。
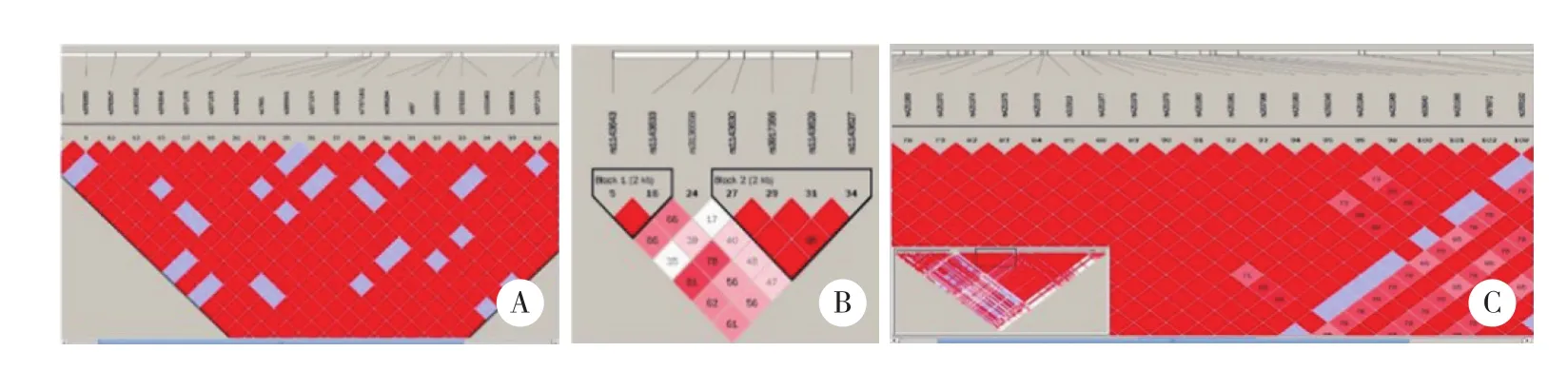
图1 Haploview软件对IL-1 α、IL-1 β、IL-1γn进行标记 SNP分析结果Fig.1 Tagged SNP results for IL-1 α,IL-1 β,and IL-1γn analyzed by Haploview

表1 各基因PCR引物、内切酶及酶切片段长度Tab.1 Primer,endonucleases,and length of products of each gene
1.5 统计学分析
采用SPSS 22.0软件对各SNP位点进行统计分析,2组间的基因型和等位基因频率比较采用χ2检验,P < 0.05为差异有统计学意义。
2 结果
2.1 IL-1 α、IL-1 β 和IL-1γn的SNP酶切结果
结果显示,IL-1 α基因rs2856838经HpyCH4Ⅳ酶切后,GG基因型为92 bp和115 bp 2条带,纯合型AA为207 bp 1条带,而杂合型GA为3条带。IL-1 β基因rs3136558经DpnⅡ酶切后,TT基因型为35 bp 、170 bp 2条带,纯合型CC为205 bp 1条带,杂合型CT基因型为3条带。IL-1γn基因rs4252001经PsiⅠ酶切后,AA基因型为27 bp和206 bp 2条带,纯合型GG为233 bp 1条带,杂合性AG为3条带。见图2。
2.2 2组基因型分布比较
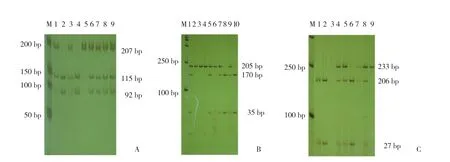
图2 多态位点酶切后电泳图Fig.2 Electrophoretogram of SNP
结果显示,IL-1 α 基因rs2856838位点中,与GG基因型比较,AA基因型PI组与NPI组中分布有统计学差异 (P < 0.05),GA基因型2组分布无统计学差异 (P > 0.05)。IL-1 β基因 rs3136558和IL-1γn基因rs4252001位点各等位基因型分布均无统计学差异(均P > 0.05)。见表2。
3 讨论
种植体周围炎能使支持骨丧失,形成种植体周围深牙周袋,从而导致种植失败。2008年第6届欧洲牙周病学术研讨会[13]明确口腔卫生差、牙周炎病史和吸烟是种植体周围炎的风险因素,这在本研究中得到了证实。近年来研究[14]表明,微生物、遗传因素等对种植体周围炎的发生也至关重要。微生物和遗传易感性是种植患者发生种植体周围炎风险更高的原因[15]。
IL-1基因多态性作为种植体周围炎的危险因素越来越受到研究者的重视。虽然LACHMANN等[16]研究未能发现IL-1基因型与种植体周围炎之间存在相关性,但是越来越多研究发现IL-1基因与种植体周围炎发生相关。有学者通过meta分析发现IL-1 α和IL-1 β 复合基因型是植入失败和种植体周围炎的危险因素[17],HAMDY 等[18]通过病例对照研究发现IL-1基因型在种植体周围炎组与非种植体周围炎组间有统计学差异。以往研究[9,18]大多集中在IL-1 α-899C>T、IL-1 β +3954C>T位点上。IL-1α-899C>T和IL-1 β +3954C>T位点在亚洲 (特别是中国) 人群中最小等位基因频率较低 (分别为0.09和0.03)。本研究通过生物信息学方法,选择了基因频率较高的3个标签SNP位点来进行组间基因型频率和等位基因频率分析,以此来研究IL-1基因在种植体周围炎的发生中的作用。
本研究发现IL-1 α 基因rs2856838位点为AA基因型比GG基因型发生种植体牙周炎的风险高3.34倍,与以往研究[9,19-20]结果相同,验证了IL-1 α 基因在种植体周围炎发生中起重要作用。然而未发现IL-1 β 和IL-1γn基因的基因型与种植体周围炎发生具有相关性 (P > 0.05)。这可能与本研究纳入样品数少有关。另外,本研究发现吸烟患者与不吸烟患者比较更容易发生种植体周围炎,进一步证实吸烟影响种植体周围炎的发生。
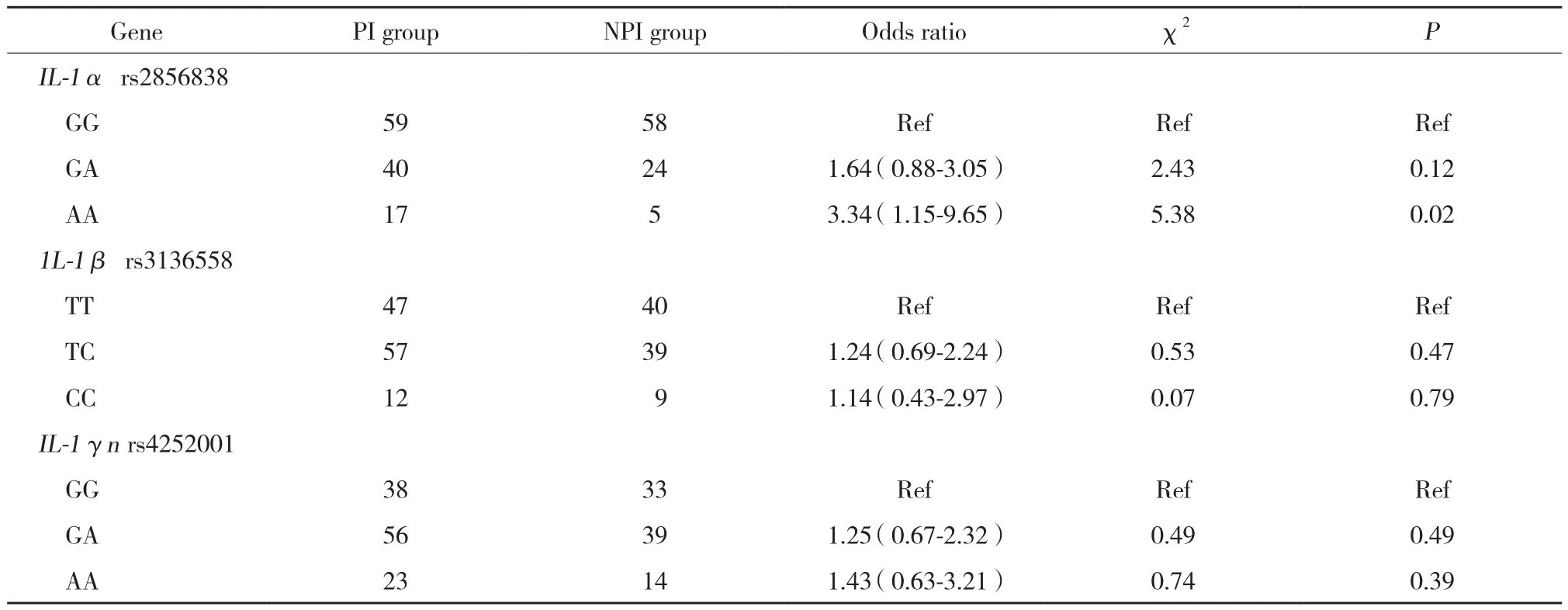
表2 PI组和NPI组基因型分布比较Tab.2 Genotype distribution of PI group and NPI group
综上所述,IL-1参与种植体周围炎的发生过程,IL-1 α 基因rs2856838的AA基因型与种植体周围炎的发生具有相关性。本研究探讨了IL-1基因多态性与种植体周围炎的相关性,由于样本数量较少,目前对于遗传异质性以及不同环境因素影响等方面的研究较少,因此,有必要开展多中心联合研究,扩大样本量,对基因多态性、环境因素与种植体周围炎的关系进行深入研究。

