IL-21/IL-21R信号在TNBS诱导小鼠炎症性肠病病变形成中的作用研究
姜雪峰, 贾 楠, 岳 丹,2, 王媛媛, 张晓清, 孙 逊*
(1.中国医科大学基础医学院 免疫学教研室,辽宁 沈阳 110122;2.中国医科大学附属盛京医院 检验科,辽宁 沈阳 110004;3.中国医科大学附属第四医院 麻醉科,辽宁 沈阳 110032)
炎症性肠病(inflammatory bowel disease, IBD)是一种特殊的慢性炎症性肠道疾病,包括克罗恩氏病(Crohn′s disease, CD)和溃疡性结肠炎(Ulcerative colitis, UC)。其病因和发病机制与遗传基因、环境、生活习惯和免疫系统功能紊乱等多种因素密切相关。目前普遍认为肠黏膜异常的免疫应答是引起黏膜组织损伤及慢性炎症的重要原因。CD主要由Th1和Th17型细胞及其分泌的细胞因子介导,UC主要由Th2细胞及相关细胞因子和自然杀伤性T细胞(natural killer T cell,NKT)介导[1]。同时,调节性T 细胞(regulatory T cells, Treg)介导的免疫应答在调节IBD 患者肠黏膜适应性免疫应答、抑制其炎症发生、发展过程中发挥重要作用[2]。Monteleone等[3]发现在CD或UC患者的炎性肠组织中IL-21的分泌明显增加,IL-21通过对多种细胞的靶向作用增加了肠炎的严重程度。例如,IL-21通过自分泌方式维持Th1细胞应答在CD中的主导地位。这也刺激细胞外基质降解蛋白酶分泌成纤维细胞趋化因子,促进结肠上皮细胞生成,相反抑制Treg的活性,并增强Th17细胞分化及相关细胞因子的分泌。利用抗IL-21抗体或IL-21r-IgG融合蛋白阻断IL-21/IL-21R信号转导可有效抑制CD患者肠固有层T细胞IL-17A和IFN-γ分泌。同时,IL-21基因缺陷小鼠抵抗Th1/Th17细胞产生的结肠炎支持了IL-21正向调控Th1/Th17细胞相关炎症通路的说法[4]。但最新研究表明,IL-21基因的纯合子突变与普通变量相关联免疫缺陷样B细胞导致人类早发性炎症性肠病[5]。此外,Yeste等[6]也通过实验得出IL-21刺激STAT3,维甲酸相关孤核受体γt(retinoid-related orphan nuclear receptor γt,RORγt)和芳香烃受体路径诱导肠黏膜T细胞产生IL-22,从而抑制DSS诱导的免疫缺陷小鼠肠道炎症的病变形成。据报道,IL-21可抑制IL-2的产生从而抑制Treg细胞的生存及下调Treg细胞的免疫抑制功能,同时刺激CD4+T细胞向Th1细胞分化及IFN-γ的产生,加重肠道炎症。相反,最近研究发现DSS诱导的mIL-21iso-Tg小鼠炎症性肠黏膜组织中Treg和Th17细胞应答上调,小鼠肠道炎症明显加重[7]。由此可见,IL-21/IL-21R信号转导在IBD肠道炎症发生、发展中的作用机制是复杂的、矛盾的,至少目前仍不十分清楚。综上所述,在CD或UC患者外周血和肠道组织中IL-21的水平显著增加[8],提示IL-21 /IL-21R信号可能在炎症性肠病的发病机制中发挥了潜在的重要作用。然而,IL-21/IL-21R信号在IBD中到底扮演怎样的角色尚不确定。因此,本研究利用TNBS诱导C57BL/6和IL-21R KO小鼠,通过观察模型、流式细胞染色、ELISA等方法来验证IL-21/IL-21R信号在炎症性肠病肠黏膜免疫应答调节中的作用。
1 材料与方法
1.1 材料
1.1.1 实验小鼠 SPF级C57BL/6小鼠(6~8周,18~22 g,雄性),购于华阜康生物科技有限公司;IL-21R KO小鼠由日本九州大学生体防御医学研究所感染制御研究室吉开泰信教授赠与。
1.1.2 主要试剂及仪器 TNBS购自Sigma公司;RPMI-1640购自Thermo公司;胎牛血清购自Invitrogen公司;流式抗体及相关试剂购自BD公司;IL-4等多种ELISA试剂盒购自R&D公司。酶标仪购自BIO-TEK公司;离心机购自Thermo公司;流式细胞仪购自BD公司。
1.2 方法
1.2.1 TNBS诱导的肠炎动物模型的建立与观察 C57BL/6、IL-21R KO小鼠各15只,禁食12 h后用7.2%水合氯醛100 μL麻醉。待麻醉成功后用连有灌肠针的微量注射器抽取TNBS溶液(2%或2.5%,用50%乙醇溶解)100 μL,小鼠头部朝下,再将针头插入小鼠肛门内约3~4 cm深,缓慢推入药液,灌肠完毕后缓慢拔出针头,以免漏液。让小鼠持续向下倾斜5~10 min,使其最大量吸收药液,并与肠道充分作用,待小鼠清醒后放回笼中。
1.2.2 肠组织HE染色 2%TNBS诱导小鼠肠炎模型第5天处死小鼠,取小鼠结肠近心端二分之一组织约0.5 cm,冲洗干净,用200 μL枪头撑起肠管,置于4%多聚甲醛溶液中4 ℃避光固定24 h。经脱水、透明、浸蜡、包埋、切片后常规HE染色。在光学显微镜下观察结肠组织的病理变化,根据Sun等[9]的炎症分级标准,进行评分。评分见表1。

表1 结肠组织病理学评分表
注:病理评分=E+I
1.2.3 肠固有层淋巴细胞(LPL)的提取 2%TNBS诱导小鼠肠炎模型第5天处死小鼠,取出结直肠,分离提取肠固有层淋巴细胞,具体提取方法按本课题组以往发表文章所述[9]。
1.2.4 流式细胞术胞内染色检测肠固有层(LP)中Th细胞分化 提取LPL,加入96孔板,同时加入 PMA(25 ng/mL),Ionomycin(1 μg/mL)和BFA(10 μg/mL),置于37 ℃、5%CO2的细胞培养箱继续孵育4 h。孵育结束后,用HBSS回收细胞至EP管中,按照BD公司流式抗体说明书进行表面及细胞内染色。最后利用BD LSRFortessa进行检测及分析。
1.2.5 ELISA检测LP中Th细胞分泌细胞因子水平 用10% RPMI1640将提取的LPL细胞浓度调整至2×105/mL, 接种到已提前一夜铺好CD3抗体的96孔细胞培养板中;加入细胞的同时加入CD28抗体,并设置分为刺激组和无刺激组。刺激组:抗CD3抗体(10 μg/mL)+抗CD28抗体(1 μg/mL);无刺激组:不加抗体;置于37 ℃、5%CO2培养箱中培养孵育48 h后,回收细胞上清。根据ELISA试剂盒说明书进行操作,检测IFN-γ、IL-4、IL-10、IL-17A的分泌水平。
2 结果与分析
2.1 IL-21R信号缺失导致小鼠对TNBS诱导的肠炎易感性增加
利用WT和IL-21R KO小鼠建立TNBS诱导的肠炎模型,观察IL-21R信号缺失对肠道炎症的影响。体重下降是TNBS诱导肠炎的一个重要症状,每天在固定时间测量小鼠的体重变化。如图1A所示,给予TNBS第1天,WT小鼠体重明显下降,但从第2天开始体重逐渐回升,并接近于最初体重,生存率高达50%。但IL-21R KO组小鼠从用药第1天起体重就开始明显下降,到第2天时与WT组小鼠相比有明显统计学差异(*P<0.05),并逐渐出现活动减少、体型消瘦、精神萎靡的现象,而且部分小鼠排泄稀便且肛周有血迹,生存率明显下降,到第5天时,体重下降≥20%,生存率为零,与WT组小鼠相比统计学差异明显(*P<0.05)。如图1B所示,解剖小鼠取出完整的大肠,两组小鼠在没有TNBS诱导的条件下,肠管长度及性状没有明显差异,肠壁厚薄均匀,表面光滑,肠腔内粪便成形。但经过TNBS诱导后,两组小鼠肠管明显缩短,狭窄变形,肠腔内有稀便,IL-21R KO组小鼠更加严重(*P<0.05)。如图1C所示,小鼠结肠组织切片经HE染色,光学显微镜下观察可见,两组小鼠均有上皮结构明显不完整,隐窝大面积消失,杯状细胞大面积消失,及大量炎性细胞浸润,但IL-21R KO组小鼠更加严重,几乎没有完整的上皮组织,且炎性细胞浸润至黏膜肌层,肠黏膜水肿增厚,组织学评分明显增高(**P<0.01)。上述结果说明IL-21R信号缺失导致小鼠对TNBS诱导的肠炎易感性增加。
2.2 IL-21R信号缺失对肠黏膜LP中Th细胞分化的影响
据报道,效应性T细胞如Th1、Th2、Th17、Treg及其相关的细胞因子在IBD的发生发展中起到重要的调节作用[10-11]。因此,在TNBS诱导肠炎的第5天,提取小鼠结肠组织中的LPL,检测肠道黏膜LP中Th细胞的分化情况。如图2A和2B所示,与WT组小鼠相比,IL-21R KO组小鼠中CD4+T细胞产生的IFN-γ细胞绝对数和百分比明显增加(*P<0.05,**P<0.01),但是Th2和Th17细胞诱导分化的IL-4、IL-5和IL-17A明显下降(*P<0.05,**P<0.01)。这说明在TNBS诱导的肠炎中IL-21/IL-21R信号有能力调节LP中Th1、Th2和Th17细胞的分化。有研究表明,Treg细胞可以通过抑制Th1细胞免疫应答,保护小鼠免受DSS诱导的肠炎[12]。我们研究了在IL-21R缺失的情况下,肠道LP中Treg细胞的免疫应答。如图2C所示,与WT组小鼠相比,IL-21R KO组小鼠中CD4+CD25+Foxp3+细胞百分比明显下降(*P<0.05),而且其细胞绝对数也明显下降(**P<0.01)。CD4+CD25+T细胞上IL-10的百分比和绝对数也明显下降(*P<0.05,**P<0.01),这也促使了肠炎的加重。说明在肠炎组织中IL-21/IL-21R信号在上调Treg细胞免疫应答中发挥了重要作用,信号缺失后抑制了Treg细胞分化,肠炎加重。上述结果证明IL-21R信号缺失会通过增强Th1细胞的应答,抑制Th2、Th17和Treg细胞的应答加重肠炎的发展。
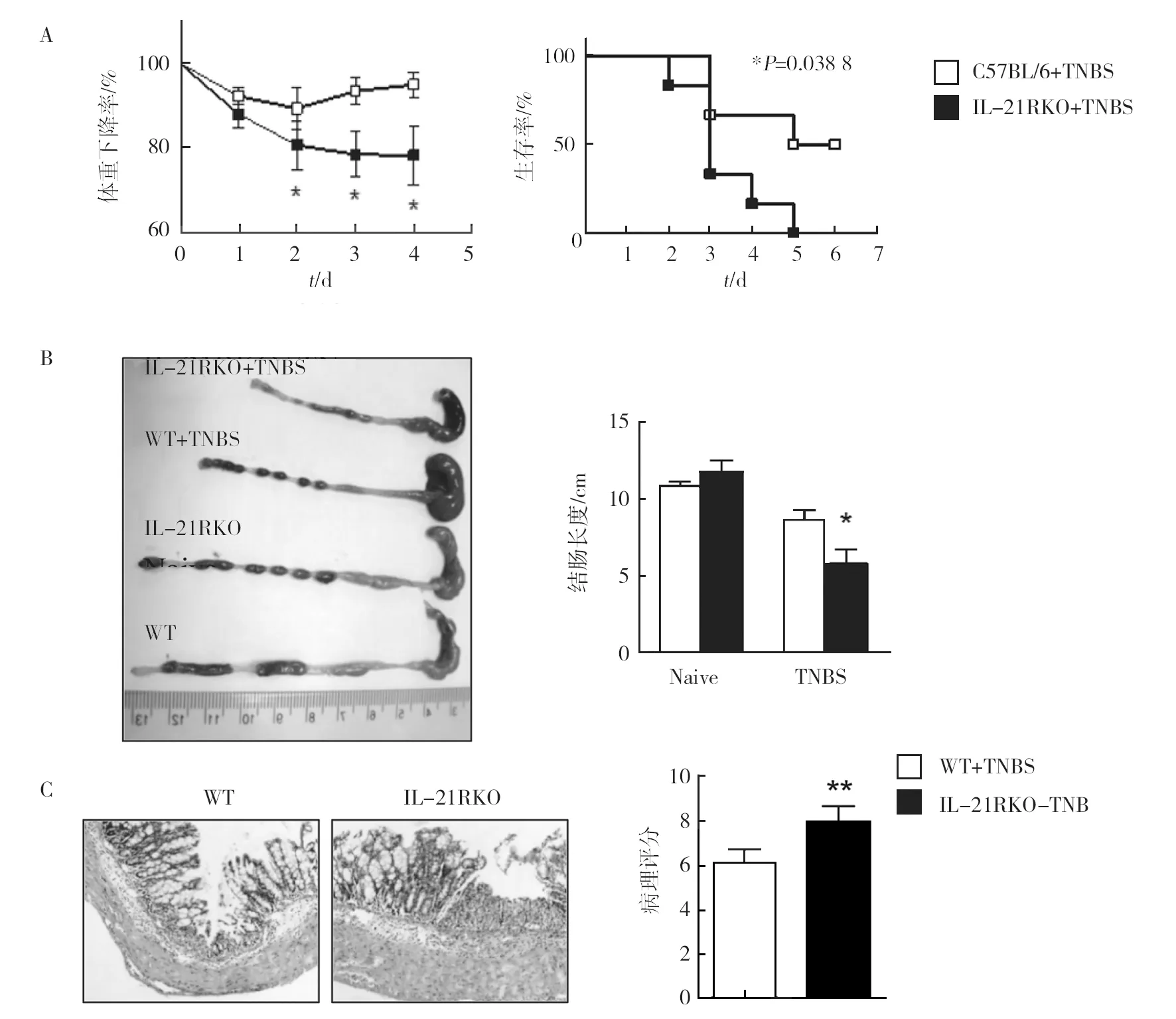
图1 TNBS诱导的肠炎小鼠疾病严重程度Fig.1 Severity of enteritis in TNBS-induced colitis miceA:体重和生存率;B:结肠长度;C:HE染色(×200)及病理评分;*P< 0.05,**P<0.01A: body weight and survival rate;B:macroscopic changes and colon length;C:histological score (original magnification, ×200) were analyzed; *P< 0.05,**P<0.01

图2 流式胞内染色检测TNBS诱导的肠炎小鼠中LPL-T细胞的分化Fig.2 Cytokine-producing T cells in the LPL of colon in IL-21R KO mice with TNBS-induced colitis A:IFN-γ+CD4+、IL-17A+CD4+、IFN-γ+IL-17A+CD4+T细胞的比例及绝对数;B:IL-4+CD4+、IL-5+CD4+、IL-4+IL-5+CD4+ T细胞的比例及绝对数;C:IL-10+Foxp3+和IL-10+Foxp3-CD4+T细胞的比例及绝对数;*P< 0.05,**P<0.01A:The proportions and absolute numbers of IFN-γ+CD4+, IL-17A+CD4+, IFN-γ+IL-17A+CD4+ T in LPL of colon;B: The percentage of IL-4+CD4+, IL-5+CD4+, IL-4+IL-5+CD4+ T in LPL of colon; C:The proportion and absolute number of IL-10+Foxp3+ and IL-10+Foxp3-CD4+ T cells in LPL of colon;*P<0.05,**P<0.01
2.3 IL-21R信号缺失对肠黏膜Th细胞相关细胞因子分泌的影响
TNBS诱导小鼠的第5天,检测肠黏膜LPL-T细胞在体外TCR刺激下分泌的细胞因子水平。提取结肠LPL后,用抗CD3抗体和抗CD28抗体体外培养48 h,收集培养上清,用ELISA试剂盒检测细胞因子分泌含量。如图3所示,与WT组小鼠相比,IL-21R KO小鼠中Th1细胞分泌的IFN-γ明显升高(**P<0.01),而Th2分泌的细胞因子IL-4、Th17细胞因子IL-17A和Treg细胞因子IL-10明显下降(*P<0.05)。上述结果说明,在TNBS诱导的肠炎中IL-21R信号的缺失增强了Th1细胞的免疫应答,抑制了Th2、Th17、Treg细胞的免疫应答。

图3 ELISA检测TNBS诱导的肠炎小鼠中LPL-T细胞分泌细胞因子的水平Fig.3 The cell-associated cytokines productions in LP cells of colon after TNBS-inducted colitisA:IFN-γ;B:IL-4;C:IL-17A;D:IL-10;*P<0.05,**P<0.01
3 讨 论
在IBD免疫学发病机制中Th1/Th2免疫应答失调理论一直占主导地位。最初CD被认为是一种以分泌促炎症性细胞因子IFN-γ、IL-12和TNF-α为特征的Th1型细胞介导的慢性肠道炎症性疾病,而UC则被认为是由Th2型细胞因子介导的炎症,但随着免疫学研究的飞速发展,Th17细胞亚群被确立,Th17细胞可分泌IL-17A、IL-17F、IL-21、IL-22、IL-6等细胞因子,参与了多种自身免疫性疾病的发生发展[13]。本研究发现,与WT小鼠相比,IL-21R KO小鼠对TNBS诱导的肠炎易感性增加,结肠LP上通过巨噬细胞释放的自发性炎性因子明显增加,Th2、Th17和Treg的细胞免疫应答调节明显下降,而Th1细胞免疫应答调节明显升高。
研究发现与IBD相关的炎症中都有IL-21的高表达,说明IL-21在这些免疫失常的疾病中扮演了重要角色[14]。但最新研究表明IL-21基因的纯合子突变与普通变量相关联免疫缺陷样B细胞导致人类早发性炎症性肠病[5]。此外,Yeste等[6]也通过实验得出IL-21通过STAT3,RORγt和芳香烃受体诱导黏膜T细胞产生IL-22,从而抑制DSS诱导的免疫缺陷小鼠肠道炎症的病变形成。根据这些结论,我们想验证IL-21/IL-21R信号在炎症性肠病模型中到底是加重还是缓解了肠炎,及其调节肠上皮LP中辅助T细胞的具体机制。
在TNBS诱导的肠炎模型中,小鼠的遗传背景决定其对肠炎的易感性,我们选择C57BL/6背景的小鼠是因为它存在明显的物种和应变差异。Th1细胞通过减少IFN-γ的产生抑制Th2细胞增殖,说明Th1、Th2细胞可以相互调节[15]。本研究发现TNBS诱导的肠炎在以C57BL/6小鼠为背景的IL-21R KO小鼠中明显加重,与WT小鼠相比,IL-21R KO组小鼠大肠的肠黏膜固有层上CD4+T细胞分泌高水平的IFN-γ,但Th2型细胞因子分泌减少。因此,在TNBS诱导的IL-21R KO小鼠肠炎模型中,Th2型细胞分泌IL-4和IL-5的能力受损,而Th1型细胞分泌IFN-γ的能力增强。这些结果证明IL-21/IL-21R 信号在通过偏离Th1/Th2向Th2的平衡来控制肠道炎症中发挥了重要作用。
Th17细胞的特点是在自身免疫病和传染病的炎症组织中起到显著的保护或致病性作用[13]。IL-21诱导相关的转录因子ROR-γt调节Th17细胞,增强Th17细胞中IL-23R的表达[16]。在小鼠中IL-21主要由Th17细胞产生,它在Th17/Th2细胞应答扩增方面起到重要作用。由此我们发现在TNBS诱导肠炎的IL-21R KO小鼠中Th17 (CD4+IL-17A+)和 Th2 (CD4+IL-4+和CD4+IL-5+)细胞分化明显下降。
研究显示IL-21可以抑制Foxp3+Tregs应答加重肠炎[17],但最新研究表明在DSS诱导肠炎的mIL-21iso-Tg小鼠中Treg细胞应答上调[7]。本研究中,IL-21R KO小鼠在TNBS诱导肠炎后Treg细胞明显下降。IL-21的调节抑制了IL-2的产生,进而间接降低了Treg细胞的生存能力[18]。由于IL-21/IL-21R信号的缺失,IL-10可能影响了Treg细胞的生存能力。IL-21具有免疫抑制力,因为它可以诱导初始CD4+T细胞、CD8+T细胞和B细胞产生IL-10[19]。Th1或Th17细胞在IL-21存在的情况下也可以产生高水平的IL-10,然后IL-21通过T-调节型1(T-regulatory type 1,Tr1)细胞的免疫抑制力诱导IL-10的产生。本研究在TNBS诱导的IL-21R KO小鼠中CD4+CD25+Foxp3-细胞数和IL-10的分泌都明显下降,促成了肠炎的持续加重,原因可能是IL-21/IL-21R信号的缺失。
综上所述,可以确定IL-21/IL-21R信号在炎症性肠病的发生发展中起到重要的调节作用。但是由于IBD复杂的发病机制及IBD患者的个体差异性,不能盲目地将IL-21/IL-21R信号作为治疗这类疾病的药物靶点。本研究为IL-21/IL-21R信号在炎症性肠病发病机制的研究提供参考。

