microRNA-145在宫颈癌中的表达及其对Wnt/β-catenin信号通路的抑制作用
宫颈癌发病率在全球女性肿瘤中位居第3位,每年约有52 900例新发病例,且每年约有27 400例患者死于宫颈癌[1]。宫颈癌发病原因复杂,目前研究认为人乳头瘤状病毒(human papilloma virus,HPV)是宫颈癌发病的重要因素,如HPV-16、HPV-18等感染常导致癌基因异常持续活化、抑癌基因失活,从而促进宫颈癌的发生[2]。microRNA-145在多种肿瘤和其周围正常组织中表达存在显著差别,micro-RNA的异常表达与肿瘤的发生发展密切相关,但其在宫颈癌中的作用机制尚不十分明确。本研究旨在检测宫颈癌中的microRNA-145表达并分析其与临床病理的意义,从体外细胞学水平研究microRNA-145过表达对宫颈癌细胞中的Cateninδ-1影响,以及对Wnt/βcatenin信号通路活化的影响,初步探讨microRNA-145在宫颈癌发生发展中的分子机制。
1 材料与方法
1.1 材料
1.1.1 病例资料 收集2002年1月至2004年12月解放军464医院收治的62例宫颈癌患者的组织标本,其中48例行根治性子宫切除加盆腔淋巴结清扫术、14例行宫颈锥切术。患者年龄为27~75岁,平均年龄47岁。根据microRNA-145表达平均水平(0.324),将62例宫颈癌患者分为microRNA-145高表达组(表达水平≥0.324)30例和低表达组(表达水平<0.324)32例。患者术前均未接受放、化疗,病理切片均由病理医师重新复习并确认为宫颈癌。本研究经过医院伦理委员会审查批准。
1.1.2 细胞 人宫颈癌细胞株HeLa细胞购自中国医学科学院基础医学院细胞资源中心。于含10%胎牛血清(FBS)的DMEM培养基,置于37℃、5%CO2培养箱中培养。
1.2 方法
1.2.1 RNA提取和实时荧光定量PCR方法检测 宫颈癌组织离体后迅速置于液氮中保存,RNA提取试剂盒购自天根生化科技(北京)有限公司,所有样本按照试剂盒说明书使用。从组织中提取并测定RNA质量和浓度,进行逆转录获得cDNA,于-20℃条件下保存。使用TaqMan microRNA检测试剂盒进行实时荧光定量PCR检测(购自美国Thermo Fisher公司)。microRNA-145引物序列正向为5'-TGGATTTCGCTC TTCCCA-3',反向为 5'-TTGACACTCATCCGTGAGG ACC-3'。反应条件为95℃5 min变性、95℃20 s退火、60℃30 s延伸,共40个循环,以U6 snRNA表达作为内参。所有样品均设3个副孔,取平均循环阈值。采用PCR-反向点杂交技术检测宫颈HPV感染状态,具体步骤按HPV基因分型检测试剂盒(购自广东凯普生物科技股份有限公司)操作说明进行。
1.2.2 细胞转染 在细胞培养6孔板中每孔接种4×105/mL细胞悬液2 mL,以不含抗生素的基础培养基培养12 h,将microRNA-145表达质粒和无义对照质粒(购自上海吉凯基因公司)利用转染试剂Lipo⁃fectamine 2000(购自美国Invitrogen公司)分别转染入HeLa细胞中,细胞转染48 h后,进行后续实验。
1.2.3 细胞免疫荧光染色 在细胞培养12孔板中提前12 h每孔接种5×104/mL细胞悬液1 mL,4%多聚甲醛固定,0.5%Triton破膜,3%BSA室温封闭1 h,加入购自美国Santa Cruz公司的小鼠抗人β-catenin单克隆抗体(1:50),4℃孵育过夜,PBS冲洗,加入购自美国Invitrogen公司的羊抗小鼠IgG Alexa Flour488(1:200),避光室温孵育1 h。PBS冲洗,加入4,6-二乙酰基-2-苯基吲哚酸盐(DAPI),避光室温10 min;PBS冲洗,将盖玻片移至载玻片上,抗荧光衰减封片剂封片。
1.2.4 双荧光素酶报告系统检测 利用Top Flash测定细胞内TCF/LEF的转录活性,将Top Flash(100 ng)及海肾荧光素酶胸苷激酶(50 ng)共转染于HeLa细胞中,利用Promega双荧光素酶检测试剂盒检测荧光素酶活性。构建microRNA-145野生型及靶序列突变型载体(野生型为AACUGGA、突变型为AAUCA⁃GA)。将HeLa细胞随机分为野生型+microRNA-145组、野生型+内参组、突变型+microRNA-145组、突变型+内参组。Lipofectamine 2000转染相应的质粒与microRNA-145。
1.2.5 Western blot法检测 各组细胞以RIPA裂解液提取总蛋白,以35 μg/孔上样,250 mA电流下转膜,置于5%脱脂牛奶中封闭1 h,加入均购自美国Ab⁃cam公司的一抗小鼠抗人C-MYC和CyclinD1抗体(1:500),4℃孵育过夜,加入购自美国Santa Cruz公司羊抗小鼠二抗(1:5 000)室温孵育1 h,ECL化学发光法显影。
1.2.6 随访 62例患者出院后均行随访,随访时间为12~48个月,中位随访时间为38个月。生存患者为44例、死亡12例、失访6例。
1.3 统计学分析
采用SPSS 16.0软件进行统计学分析。microR⁃NA-145表达水平与患者临床病理指标之间的相关性分析采用χ2检验,生存分析采用Kaplan-Meier法。P<0.05为差异具有统计学意义。
2 结果
2.1 宫颈癌患者组织中microRNA-145表达的临床病理意义及其预后价值
宫颈癌患者组织中的microRNA-145表达与FIGO分期、淋巴结转移及HPV感染显著性相关,差异均具有统计学意义(均P<0.05,表1)。生存分析表明,microRNA-145低表达患者生存时间[(41.28±2.00)个月]较高表达患者[(46.06±0.95)个月]短(P<0.05,图1)。
2.2 microRNA-145对HeLa细胞中β-catenin表达定位的作用
细胞免疫荧光染色结果发现,对照组细胞中βcatenin蛋白主要分布于细胞核及胞浆内,而过表达microRNA-145组HeLa细胞中β-catenin蛋白明显减少,且多分布于胞浆中,提示microRNA-145能够抑制Wnt/β-catenin信号通路(图2)。
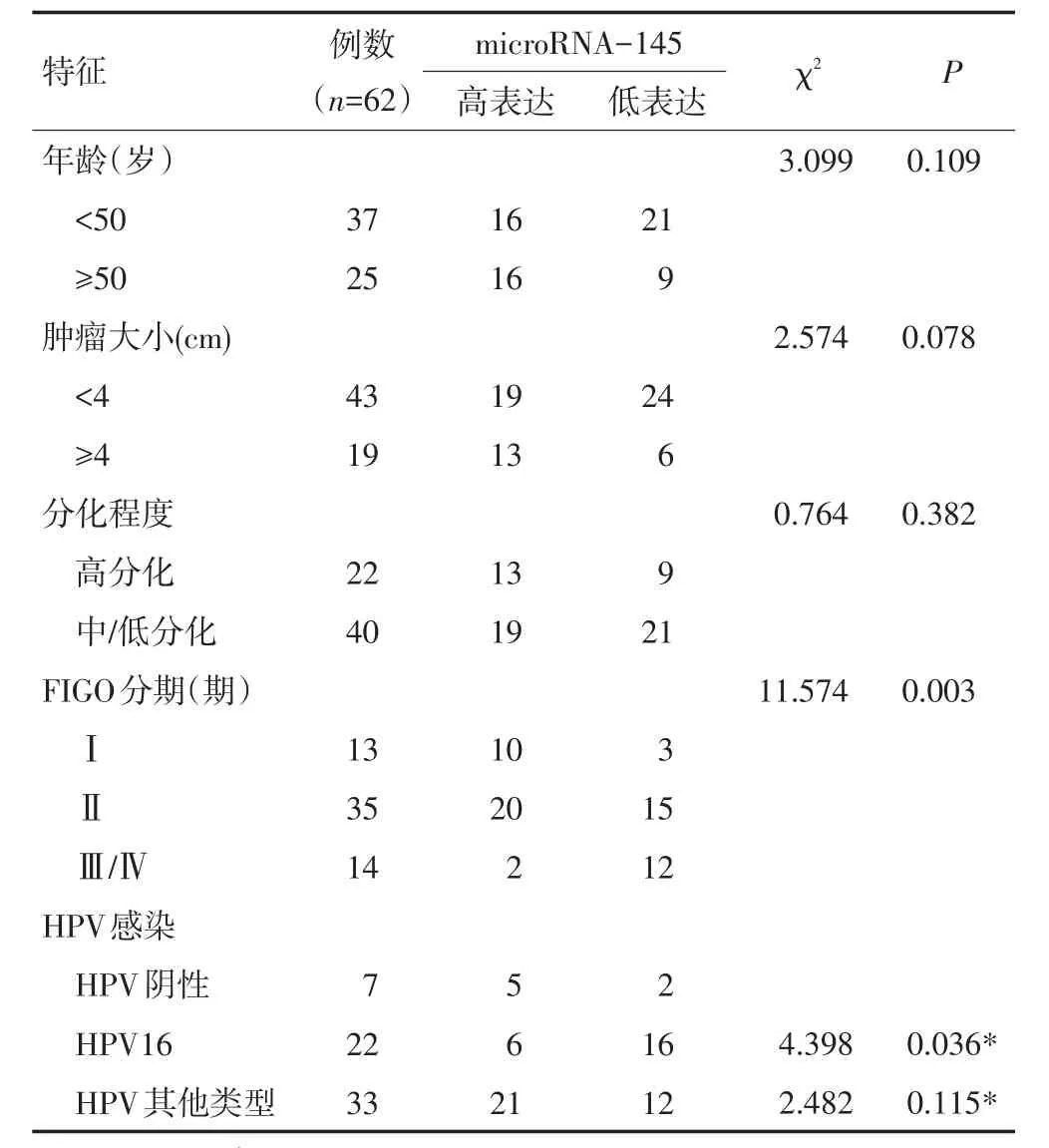
表1 宫颈癌组织中microRNA-145表达与各临床病理参数间的关系
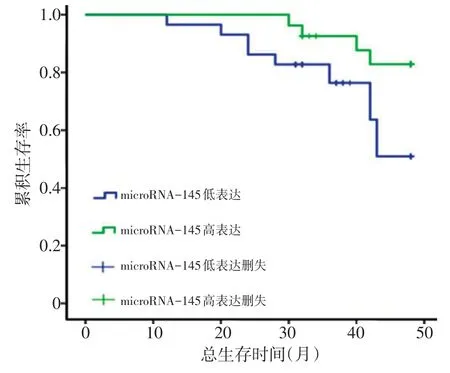
图1 microRNA-145低表达和高表达患者的生存曲线
2.3 microRNA-145对HeLa细胞中TCF/LEF转录活性的作用
双荧光素酶报告系统结果发现,HeLa细胞中过表达microRNA-145组与对照组相比被显著抑制(t=3.265,P=0.047),进一步证实了 microRNA-145对Wnt/β-catenin信号通路的抑制作用(图3)。
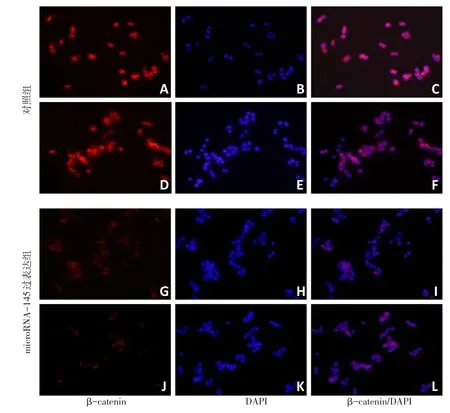
图2 对照组及过表达microRNA-145组的HeLa细胞中β-catenin表达
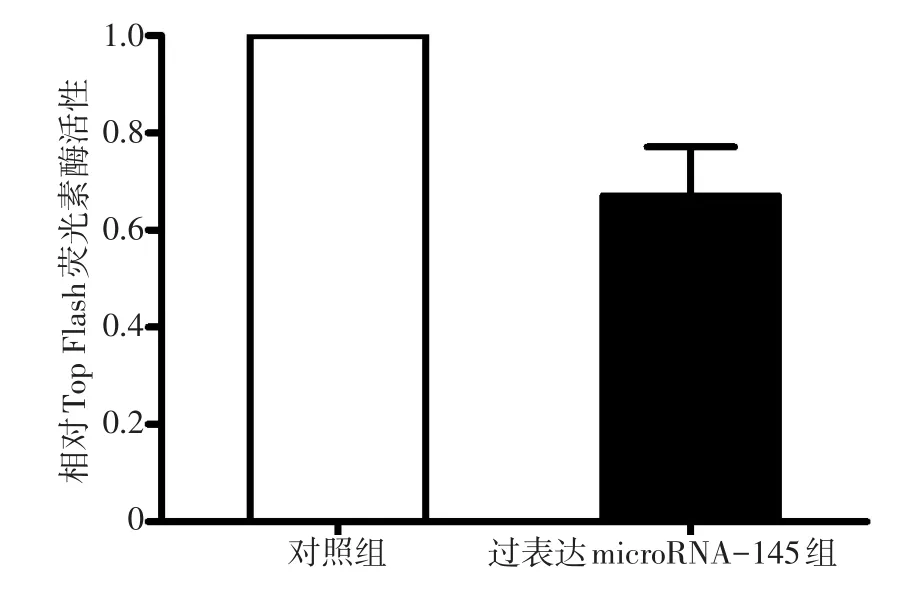
图3 双荧光素酶报告系统检测HeLa细胞中的TCF/LEF转录活性
2.4 microRNA-145对HeLa细胞中Cateninδ-1的作用
双荧光素酶报告基因检测系统显示,野生型+mi⁃croRNA-145组荧光素酶活性较野生型+内参组明显降低(P<0.05),表明microRNA-145能够靶向抑制HeLa细胞中Cateninδ-1基因的启动子活性(图4)。

图4 microRNA-145对HeLa细胞中Cateninδ-1的影响
2.5 过表达microRNA-145对HeLa细胞Cateninδ-1、C-MYC和CyclinD1表达的作用
Western blot法检测结果发现,过表达microR⁃NA-145组 HeLa细胞中 Cateninδ-1、C-MYC 和 Cy⁃clinD1蛋白表达较对照组降低,也证实了microRNA-145对Wnt/β-catenin信号通路的抑制作用(图4)。
3 讨论
研究表明,microRNA-145可通过作用于N-RAS和VEGFA抑制乳腺癌的进展,通过作用于CDK6和Sp1增加卵巢癌细胞对顺铂化疗方案的敏感性[3-4]。但也有研究发现,过表达microRNA-145可增加前列腺癌细胞对于放疗的敏感性[5]。研究报道,microR⁃NA-145在结肠癌、胃癌、宫颈癌等多种肿瘤类型中均具有抑癌作用,但其具体的分子机制仍有待深入研究[6-8]。
经典Wnt/β-catenin信号通路的活化可使β-catenin表达增加,并进入细胞核启动TCF/LEF的转录,激活下游众多靶基因,参与细胞分化、增殖、运动等几乎所有的生命事件。研究证实,Wnt信号通路在包括宫颈癌等多种肿瘤类型中均存在异常活化[8-9]。Cateninδ-1是一种细胞黏附辅助因子,可通过促进β-catenin在细胞核内集聚,参与活化Wnt/β-catenin信号通路。通过生物信息学软件Target Scan 6.0数据库预测Cateninδ-1可能为microRNA-145靶基因[10]。研究发现,microRNA-145在宫颈癌中具有抑癌作用。Azizmohammadi等[8]检测microRNA-145在35例宫颈癌患者组织中的表达,发现microRNA-145低表达与宫颈癌高FIGO分期、淋巴结转移及血管侵犯密切相关,且患者总生存时间短。Liang等[11]在中国女性宫颈鳞状细胞癌患者组织中也发现microRNA-145低表达,且其低表达提示预后不良。另有研究发现,宫颈癌患者血清中microRNA-145低水平与肿瘤分化、淋巴结转移、HPV感染及FIGO分期密切相关,且对放疗敏感性差[12]。
本研究通过检测microRNA-145在62例宫颈癌患者组织中的表达发现,其与淋巴结转移、临床分期及HPV阳性率密切相关,且microRNA-145低表达患者预后较差,与文献报道的结果基本一致[8]。进一步提示microRNA-145表达下调可能在宫颈癌的演进中具有重要作用。另外,本研究结果显示,microR⁃NA-145低表达也与患者HPV16感染相关,可能的机制是由于microRNA-145位于基因脆性位点,与HPV16整合位点相邻近,所以当HPV与宿主细胞的整合时很可能会抑制microRNA-145前体形成。研究报道,microRNA-145在宫颈癌细胞中下调,而mi⁃croRNA-145过表达可抑制宫颈癌细胞的生长、侵袭和转移[8]。目前研究认为,microRNA-145影响宫颈癌演进的可能分子机制包括microRNA-145可靶向作用于KRAS、ERK5、RREB1等发挥作用,促进癌细胞凋亡并增加抗癌药物的敏感性;microRNA-145可抑制核心干细胞转录因子Sox2、Nanog、Oct4表达抑制宫颈癌细胞干细胞样特性[13-14]。尽管有研究发现,microRNA-145下调使Wnt/β-catenin信号通路激活可能是促进结肠癌发生的关键事件,但关于microR⁃NA-145对宫颈癌细胞中Wnt/β-catenin信号通路的作用尚不明确。本研究发现,在HeLa细胞中microR⁃NA-145过表达可抑制β-catenin进入细胞核表达,抑制TCF/LEF转录活性及C-MYC和CyclinD1表达,表明在宫颈癌细胞中microRNA-145对Wnt/β-catenin信号通路也具有抑制作用,很可能也是其抑制宫颈癌发生发展的重要分子机制。
Cateninδ-1是连环蛋白Armadillo家族的成员,参与细胞骨架重塑和调节Rho GTP酶。Cateninδ-1可以与转录因子Kaiso特异性结合,抑制Kaiso活性,而Kaiso具有抑制β-catenin/TCF活化的作用,Cateninδ-1可促进Wnt/β-catenin信号通路活化[15]。该研究发现,Cateninδ-1也是PAKs特别是PAK4作用的底物和结合蛋白。Cateninδ-1也可通过与PAK4作用,促进β-catenin由胞浆入核,激活Wnt/β-catenin信号通路。本研究中,microRNA-145能够靶向抑制HeLa细胞中Cateninδ-1基因及蛋白的表达,提示microRNA-145抑制宫颈癌细胞中Wnt/β-catenin信号通路可能与其对Cateninδ-1的抑制作用有关。
综上所述,本研究对宫颈癌患者组织中microR⁃NA-145表达的临床病理意义及其预后价值进行分析,并从细胞学水平分析宫颈癌细胞中microRNA-145对Wnt/β-catenin信号通路的抑制作用,对探索microRNA-145在肿瘤演进中的作用提供了实验依据。但是microRNA-145能否应用于宫颈癌临床诊断和作为治疗干预靶点,仍需要大规模样本进行广泛验证,且其作用的分子机制也需进一步深入研究。

