TiO2纳米片的合成、生长机制及其光催化活性
孙小卫,高 娟,赵 琳,查婷玉
(安徽理工大学力学与光电物理学院,安徽 淮南 232001)
近年来,环境治理是当今社会发展的重中之重。作为一种n型半导体光催化材料,由于TiO2制备简单、环境友好、成本低廉、氧化还原等优点,目前被广泛应用于水产氢、光催化、太阳能电池、光传感等领域[1-4]。TiO2的三种晶型中具有锐钛矿结构的TiO2纳米片因其低温可控生长,催化性能好等优点而备受关注[5]。{001}和{101}是锐钛矿相TiO2片状结构的主要晶面,研究表明在{001}和{101}两个晶面上分别富集着受光激发产生的空穴和电子,光生电子-空穴分离效率以及光催化性能与晶相结构密切相关。光生电荷分离现象发生于两个晶面之间,并在两晶面上参与光催化氧化和还原反应[6]。一般研究认为TiO2纳米片{101}晶面的催化活性最低,而催化活性最高则是{001}晶面[7-8]。但也有研究证实锐钛矿相TiO2纳米片在光催化氧化目标有机物时,{101}晶面的催化活性较{001}晶面更优越[9]3 067。而无论哪种结论,都说明TiO2纳米片光催化效率主要取决于{101}与{001}两个暴露晶面,即与TiO2纳米片的晶相结构有关。在水热反应制备TiO2纳米片的过程中,水热时间、温度等因素都将对反应产物的晶相结构产生影响,从而影响其催化性能。因此,采用水热法制备锐钛矿相TiO2纳米片,要控制其晶相结构,提高其光催化性能,需要深入研究TiO2纳米片的生长机制。
本文通过水热法在FTO上合成TiO2纳米片,主要研究锐钛矿相TiO2片状结构在不同的生长时间里,是以哪个晶面为主,其光催化活性最高。(101)与(001)是TiO2纳米片光催化活性的关键因素,通过观察其微观形貌、晶型结构、光学性能及光催化性能等随时间的变化,探索TiO2纳米片的生长机制与其光催化性能之间的关系,为进一步修饰(101)晶面的TiO2纳米片优化其性能起指导作用。
1 实验部分
1.1 样品制备
样品制备流程如图1所示,将0.5mL钛酸四丁酯与15mL去离子水、15mL盐酸混合搅拌15min;最后将0.25g六氟钛酸铵引入其中,搅拌混合溶液至澄清状态。依次在丙酮、无水乙醇和去离子水中,分别将FTO导电玻璃在超声机里清洗15~20min后,呈一定角度(导电面向下)放置于内胆里,最后将澄清溶液移入其中。设置烘箱在170℃温度下分别保持时间为3h、6h、9h、12h、16h。反应结束后,取出样品,使用去离子水反复冲洗干净,烘干。5个样品分别标记为S1、S2、S3、S4、S5。
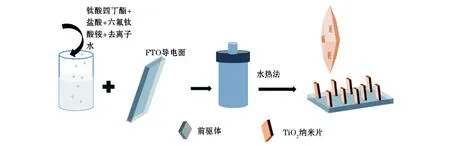
图1 TiO2纳米片制备流程图
1.2 样品表征
样品的形貌特征采用日立S-4800场发射扫描电子显微镜进行观察;晶相和晶型结构通过MAC M18XHF型X射线衍射仪(Cu Kα光,λ=0.154 18nm)进行测试和分析;利用SHIMADZU UV-2550紫外-可见分光光度计获取样品吸收光谱并计算带隙值。
1.3 光催化性能测试
在模拟太阳光照下,样品的光催化性能测试是将浓度为2mg/L罗丹明(RhB)溶液进行降解。其光源则是由200W的氙灯(200nm<λ<800nm)提供,样品尺寸为1cm×2cm。将样品静置在5mL溶液中,保持半个小时在黑暗条件中,目的是达到吸附-解附平衡。然后将玻璃瓶暴露于模拟太阳光下,样品与灯光的距离约为5cm,每隔1h,进行一次紫外-可见吸收光谱测试。
2 结果与讨论
2.1 形貌和结构分析
图2(a)~(e)为样品S1~S5的俯视图。从图2(a)中可以看出,经过3h水热时间反应产物为薄片状和颗粒状结构TiO2的混合物,呈现杂乱无序地分布。从图2(b)~(d)中可以看出,随水热生长时间从6h延长至12h,片状结构是由颗粒状产物逐渐生长成形,片状结构TiO2的长度和厚度逐渐增加;而且片状结构的密度也随水热时间增加而增加,并均匀有序地排列在FTO基底上;图2(d)中插图可以看出S4样品的微观结构尺寸类似于扁平的十面体形状。从图2(e)中可以看出生长时间16h的S5样品中TiO2纳米片密度增加,出现双层结构,底层为稠密的TiO2纳米片,上层出现由TiO2纳米片团聚形成的花状团簇。从插图中可以看出下层TiO2纳米片的厚度增加而长度减小,{101}和{001}裸露面明显减小;而上层TiO2纳米片簇拥在一起,{001}侧面裸露面积也明显减小。
如图2(f)所示为S1~S5样品的XRD。由图中显示的峰位置与标准PDF卡片(JCPDS No.73-1764)对比,可以确定S1~S5样品具有典型的锐钛矿相结构。而且随水热时间延长(200)和(101)衍射峰强度同时增强,而(004)衍射峰代表{001}晶面其强度逐渐减弱,说明TiO2纳米片因为密度增大而致使{101}晶面暴露比例增加,而{001}晶面暴露比例减小。然而,当水热反应时间从12h延长至16h,观察到强度逐渐降低的是(101)和(200)衍射峰,说明{101}晶面裸露的面积开始减少,与SEM图中观测结果一致。上述表明TiO2晶体的a轴生长方向由(200)衍射峰标志,而TiO2晶体的c轴生长方向由(004)衍射峰标志,因此由XRD图可以看出TiO2纳米片随着水热时间的增加沿着a轴方向生长的趋势。
2.2 紫外-可见吸收谱分析
样品S1~S5的紫外-可见吸收谱如图3(a)所示。从图中得知,样品S1~S5的吸收边都在400nm附近,这归因于电荷从阳离子2p轨道形成的价带转移至由Ti4+阳离子的3dt2g形成的导带[10]。另外,随着生长时间的增加,吸收边发生红移,向可见光范围拓展;而且光吸收系数也随生长时间降低,说明随生长时间增加,光吸收更好。
利用公式(1),可由紫外-可见吸收光谱中获取样品带隙值[11-12]:
(αhν)2=A(hν-Eg)
(1)
其中:α是吸光度指数,ν是频率,A是半导体的恒定特性,h是普朗克常数,hν=hc/λ,h=6.63×10-34Js,c=3×108m/s。

图2 (a)~(e)分别为3h,6h,9h,12h,16h样品的SEM图;(f)不同时间制备的TiO2纳米片XRD图

(a)紫外-可见吸收谱

(b)带隙图图3 S1~S5样品
如图3(b)所示,随水热反应时间的增加,样品S1~S5的带隙值从3.27eV减小至3.12eV,与纯锐钛矿禁带宽度(标准在3.2eV左右)相符合,而带隙的减小也有利于样品对可见光的吸收。结合SEM分析结果,随水热反应时间的增加,TiO2纳米片尺寸增加、厚度变厚,使得比表面积增加,从而导致TiO2纳米片带隙的减小。
2.3 光催化性能分析
样品S1~S5的光催化性能可以用罗丹明溶液在552nm处的特征峰来表征。实验每间隔1h后,将对被光照射降解的罗丹明溶液进行一次紫外吸收光谱测试。从图4能够观察得知,没有放入样品的罗丹明溶液经过5h光照后吸收谱强度改变较小,罗丹明在光照条件下的自降解可以忽略不计。而放入TiO2纳米片样品后,罗丹明吸收谱明显降低,说明TiO2纳米片具有光降解作用。而且,随着水热反应时间的增加,罗丹明吸收谱先增加,再降低,然后再增加。其中,S4样品降解的罗丹明溶液吸收谱强度最低,说明经过12h水热反应制备的TiO2纳米片光催化性能最好。
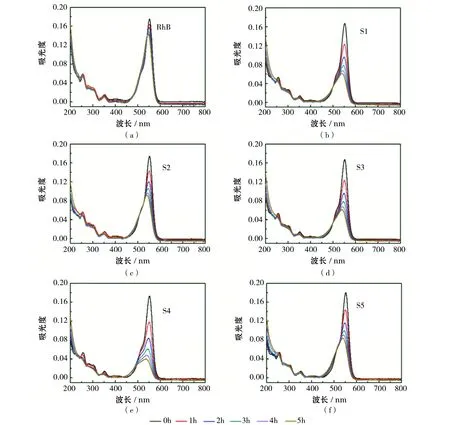
图4 S1~S5样品罗丹明溶液光降解紫外可见吸收谱
为进一步研究不同水热反应时间生长的TiO2纳米片的光降解效果,对图4中结果进行下列变换,如图5所示。图5(a)为S1~S5样品对罗丹明溶液的光降解比率,可以通过Lambert-Beer Law和Langmuir-Hinshelwood模型获得[13]:
(2)
式中:Co和Ct分别是RhB溶液的初始浓度和降解t时间后的浓度,Ao和At分别是RhB溶液特征峰的初始吸光度和降解t时间后特征峰的吸光度。
从图5(a)中清楚得出,经过12h水热反应获得的S4样品具有最高的光降解活性。在5h光照后,由S4样品降解的RhB溶液的浓度接近80%。除去S1样品,S2~S5样品对RhB溶液的光降解率随水热反应时间的增加,先增加后降低。结合SEM、XRD分析结果,{101}晶面暴露的比例随水热反应时间先增加后减少,说明{101}晶面对RhB溶液的光催化活性大,与Murakami报道的结果一致[9]3 068。
采用伪一阶模型的线性变换进一步量化S1~S5样品对RhB降解的反应动力学
(3)
式中:Kα是反应速率常数,t是降解时间。
在图5(b)中明显地看出,S4样品的斜率最高,表明S4样品的光催化活性优于其他样品。表1展示了S1~S5样品对RhB溶液的光催化反应速率常数Kα和光降解率,其中S4样品的反应速率常数和降解率最大。
另外还观察到,经过3h水热反应获得的S1样品也具有较好的光催化性能,其光降解比率和速率常数分别为68%和0.227 h-1,仅次于S4。结合SEM图像,S1样品为片状和细小颗粒状TiO2混合产物,颗粒状产物比表面积比片状产物大,因此使得其具有较高的光催化活性。而颗粒状产物和片状产物的比例在制备过程中难以控制,而且,从SEM图中能够看出,这些颗粒结构实际是片状结构TiO2的中间产物,片状结构TiO2的形成是随着水热时间的延长,慢慢地逐渐成形。因此,虽然3h生长的S1样品催化性能仅次于最优的S4样品,但由于其没有完全生长成为片状结构,因此在对RhB溶液的光降解实验中,主要对比S2~S5四个样品的性能变化趋势。
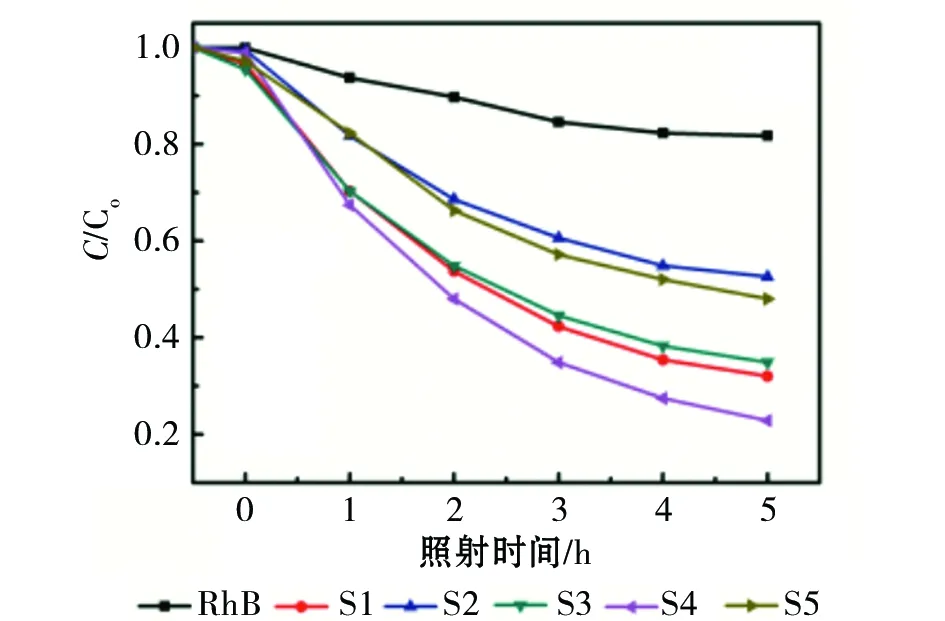
(a)光催化降解比率曲线
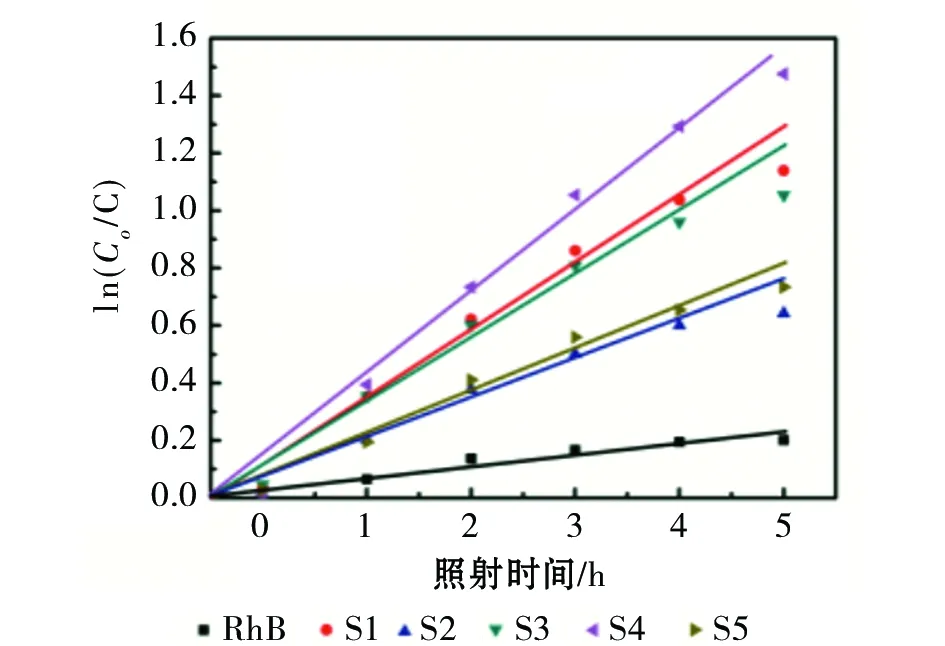
曲线图5 S1~S5样品
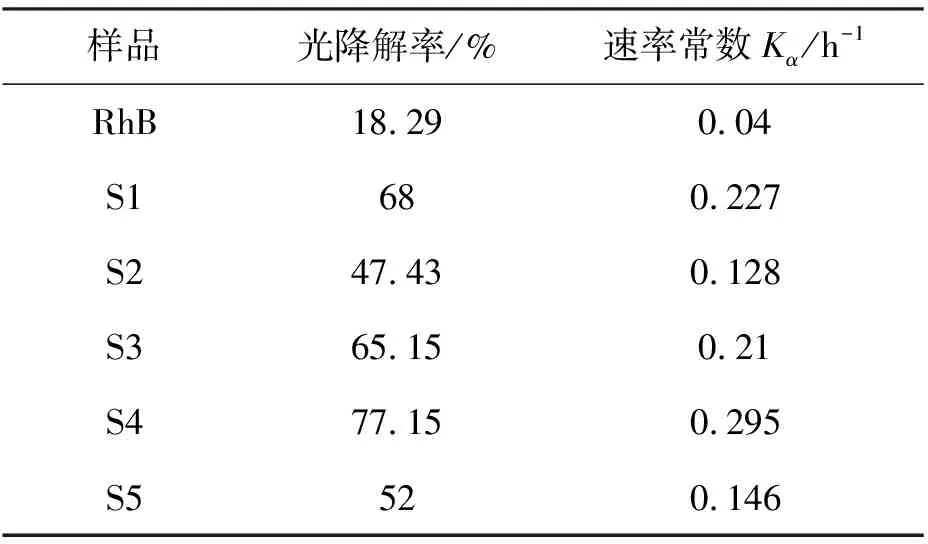
表1 样品的光降解率和速率常数
2.4 光催化机理分析
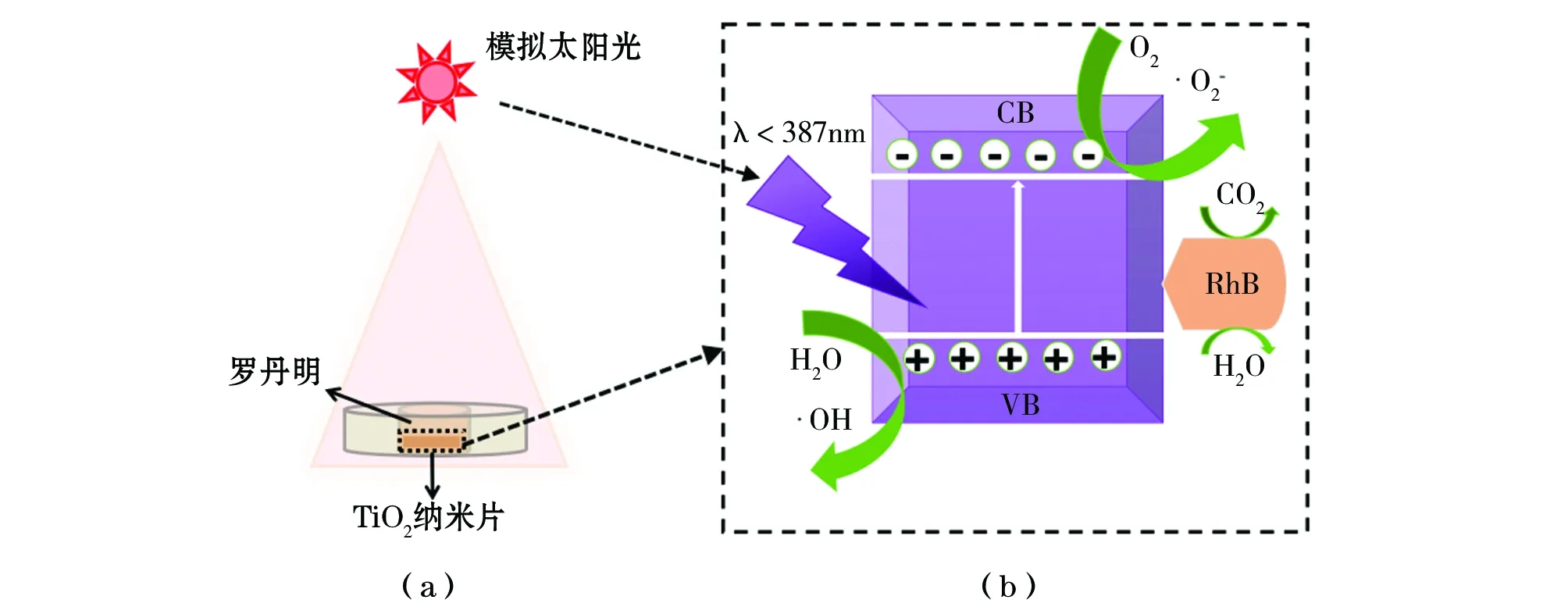
图6 TiO2纳米片光催化原理图。
3 结论
本文利用简单的一步水热法制备了不同反应时间的锐钛矿结构TiO2纳米片,并系统地研究水热反应时间对TiO2片状微观形貌、晶相结构和光催化性能的影响。研究表明:生长时间为12h制备的样品其光催化性能表现得最佳,经过5h光照的RhB溶液其降解率接近80%。主要归因于经过12h水热反应后,锐钛矿结构TiO2纳米片形貌一致且均匀分布,拥有的比表面积比较大,而且对RhB溶液光催化活性更大的{101}晶面暴露的比例增加,因而提高了光催化性能。

