抗肿瘤治疗与心房颤动
刘彤 夏云龙
随着人们对肿瘤与心血管疾病关系认识的深入,肿瘤心脏病学这一新兴学科应运而生。心房颤动(房颤)是一种临床上最常见的持续性心律失常,是脑卒中、心力衰竭(心衰)、心肌梗死和死亡的重要危险因素。除了导致房颤的传统危险因素(高血压、心衰、心肌缺血、慢性肺部疾病、糖尿病、甲状腺功能不全、慢性肾脏疾病)外,房颤的发生与肿瘤也密切相关。首先,肿瘤和房颤有很多共同的危险因素;此外,肿瘤的进展和抗肿瘤治疗都会增加房颤风险,在肿瘤治疗过程中发生房颤会影响肿瘤患者的预后、治疗效果[1-2]。肿瘤导致房颤的病理生理学机制十分复杂,本文主要阐述肿瘤导致房颤的潜在机制(图1),并为肿瘤治疗过程中的房颤预防提供新思路。
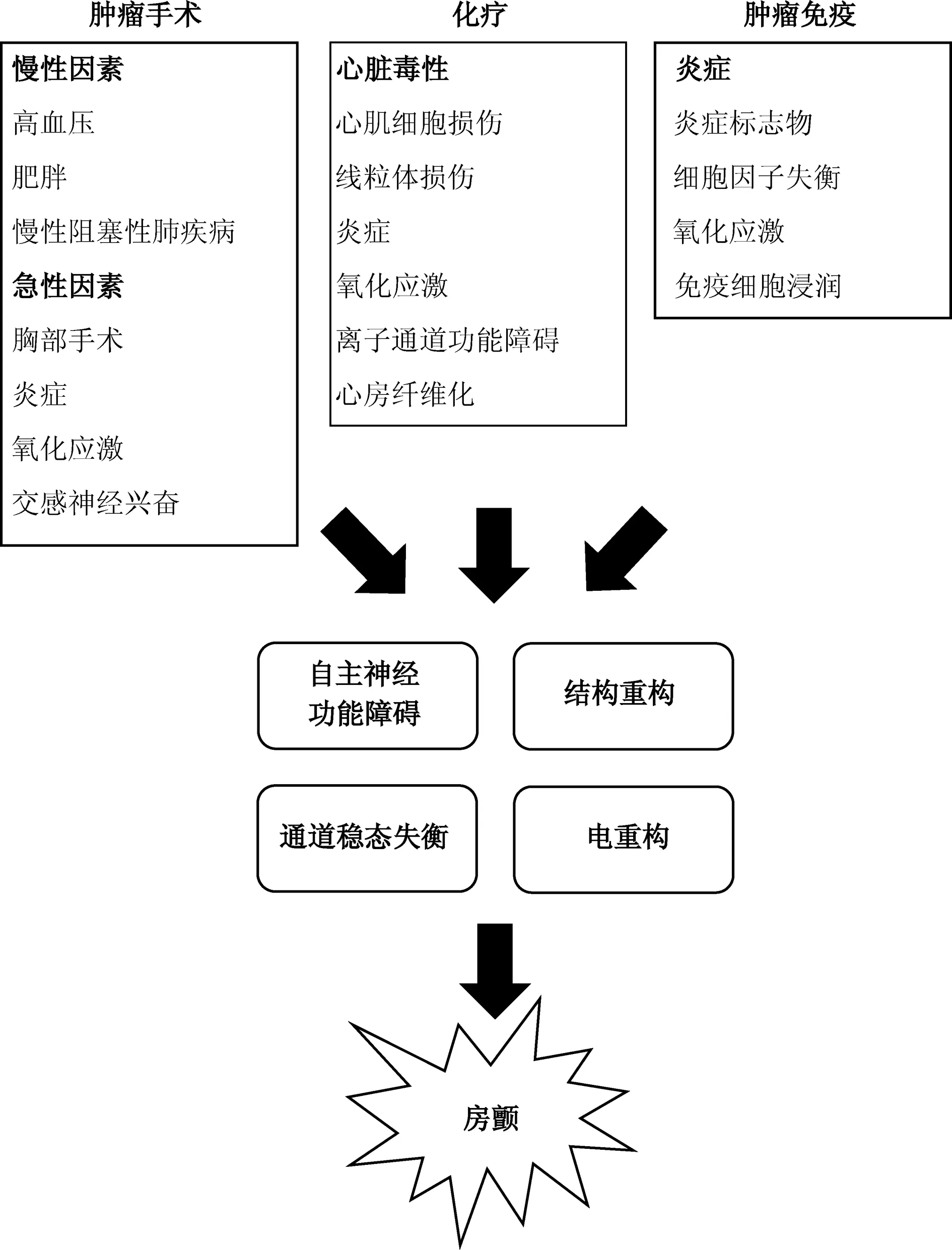
图1 肿瘤导致房颤机制示意图
1 肿瘤外科术后房颤
肿瘤外科术后发生房颤会延长术后的重症监护和住院时间,增加患者再住院率、死亡率和远期卒中风险。心胸外科手术的术后房颤发生率是16%~46%,而非心胸手术的术后房颤发生率为0.4%~12.0%。肺癌患者的肺叶切除术术后房颤发生风险显著增加,许多研究显示肺癌患者术后房颤发生率为5.6%~23.0%[3]。而术后房颤会增加肺癌患者肺叶切除术后的远期死亡率。此外肺癌患者的术后房颤与肺叶切除时的系统性淋巴结清扫有关。此外,结直肠癌患者行择期结肠切除术后房颤的发生率为12.6%[4],而食管癌患者食管切除术后房颤发生率为9.2%,对于行食管切除术患者,术后房颤可作为术后并发症和死亡的重要预测指标[5]。一项病例对照研究表明,结直肠癌或乳腺癌手术患者的房颤发生率是非肿瘤相关手术患者的2倍。
促进肿瘤外科术后房颤发生的因素可以分为急性因素和慢性因素,急性因素与手术直接相关,慢性因素包括年龄、高血压、糖尿病、肥胖和慢性阻塞性肺疾病等。
1.1 促进肿瘤术后房颤发生的急性因素
肿瘤术后房颤与胸部手术、全身炎症反应、氧化应激和交感神经激活密切相关。房颤是肺癌患者外科治疗或肺叶切除术后早期最常见的心律失常。近年来研究表明,有肺叶切除术史的房颤患者的肺静脉残端仍具有自律性。众所周知,肺静脉是房颤的主要触发灶,并且肺静脉残端与心脏自主神经在房颤发生中可能存在相互联系,连接肺静脉残端的神经和与内在神经节神经丛连接的神经放电被认为是房颤的潜在触发灶。研究表明,这些肺叶切除术后发生房颤的患者进行导管消融术与普通房颤患者的远期成功率相近。许多研究也证实了术后房颤的发生与促炎因子的激活存在时间关联,提示炎症激活可能是术后房颤发生的重要因素。另有研究显示,介导心脏组织和循环系统的免疫反应的免疫细胞和蛋白的浸润与房颤发生有关。此外,手术创伤后的交感神经损伤会影响食管切除术后房颤发生,并在房颤的发生中发挥重要作用。肺叶切除术后,心房钾通道蛋白表达发生改变,导致心房肌细胞外向钾电流增多、心房动作电位缩短、术后房颤易感性增加。术后低氧与食管癌术后房颤明显相关,氧化应激激活参与房颤发生发展,抗氧化治疗可能有助于预防肿瘤患者术后的房颤发生[6-7]。
1.2 促进肿瘤术后房颤发生的慢性因素
术后房颤也是肺叶切除或食管切除术后的一种常见并发症,其发生还与肿瘤患者术前合并的一些慢性疾病有关。老年、男性、心脏病史、高血压、术前脑钠肽水平≥30 pg/mL都是术后发生房颤的危险因素。食管癌手术发生房颤也较常见,可能与年龄、糖尿病、合并心血管疾病有关。既往研究显示肥胖是心脏外科手术术后新发房颤的独立危险因素,此外,糖尿病也是房颤发生发展的重要危险因素之一,且可预测卒中和血栓栓塞。糖尿病和高血压等病理状态下会导致心房肌细胞内钙稳态失衡,导致细胞内钙超载,进而引起触发活动,导致房颤。房颤在右心衰竭、肺血管疾病和慢性阻塞性肺病患者中很常见,并随着病情的进展发生率逐渐增加[8-9]。
2 抗肿瘤药物与心房颤动
心脏毒性是抗肿瘤治疗的重要不良反应之一,它会增加肿瘤患者远期死亡率。抗肿瘤治疗还会增加肿瘤患者的心血管疾病风险,各种抗肿瘤治疗方法如化疗、放疗、靶向治疗、激素疗法和抗血管生成治疗都对心血管系统有一定影响,并且抗肿瘤联合治疗尤其是放化疗联合常会加重心脏毒性[10]。表1总结了3种主要抗肿瘤药物(如烷化剂、蒽环类药物和靶向治疗)与心脏相关的潜在不良反应。可能导致房颤的抗肿瘤药物包括:化疗药物如烷化剂(如顺铂、马法兰、环磷酰胺)、蒽环类药物(如阿霉素)和靶向治疗(如曲妥珠单抗、索拉非尼、舒尼替尼)等。化疗药物导致房颤的机制有直接损伤心肌、激活炎症和氧化应激信号通路等。
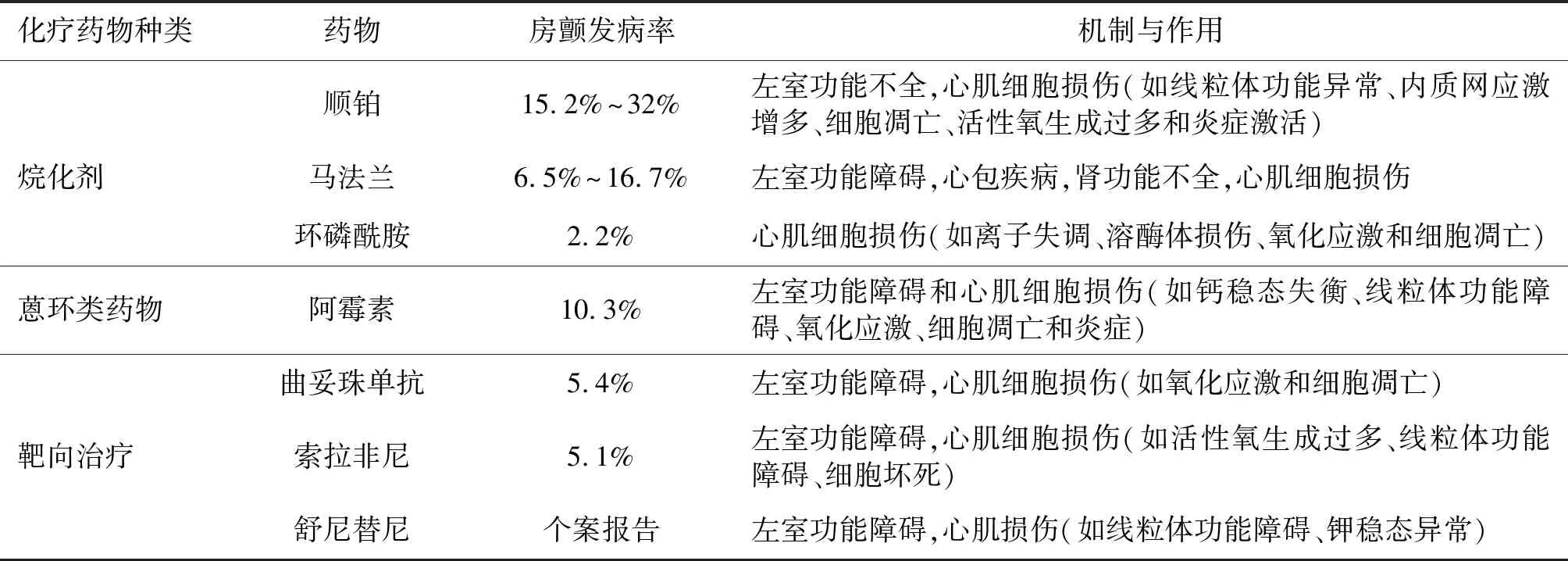
表1 诱发房颤的抗肿瘤药物
2.1 烷化剂
据报道,顺铂、马法兰、环磷酰胺等烷化剂可诱发肿瘤患者发生房颤[11-12]。应用顺铂的肿瘤患者中15.2%~32.0%可发生房颤,应用马法兰的肿瘤患者中6.5%~16.7%可发生房颤,高剂量环磷酰胺联合美司钠注射也能导致急性房颤发作。骨髓移植患者接受环磷酰胺和全身放疗的预处理后,45例患者中有5例出现各种类型心律失常,包括频发室性早搏(2例),阵发性房颤(1例),室上性心动过速(1例),QT间期延长合并室速(1例)。研究结果表明,顺铂导致的心脏毒性可能会诱发左室功能障碍、心肌细胞收缩功能下降、线粒体功能异常、内质网应激和凋亡增多、活性氧产生过多和炎症激活,而且与肿瘤坏死因子-α(TNF-α)和核因子(NF)-κB通路介导的炎症反应上调有关。有报道显示,应用顺铂的肿瘤患者发生室上性快速性心律失常可能与顺铂导致的镁代谢紊乱有关。夹竹桃麻素是一种特异性NADPH氧化酶拮抗剂,可通过抑制氧化应激和炎症通路来改善顺铂引起的心脏毒性,可能有助于房颤的预防。马法兰具有很强的潜在心脏毒性,报道称可引起肿瘤患者发生左室功能障碍、心包疾病和肾功能障碍。环磷酰胺诱发心脏毒性的可能机制包括氧化应激激活、炎症和细胞凋亡。4-氢过氧环磷酰胺(环磷酰胺的一种活性衍生物)通过增加细胞内钠和钙离子浓度、减少钾离子浓度和ATP的含量、损伤溶酶体来增加心肌细胞的细胞毒性。环磷酰胺还会导致心肌肥厚、心肌纤维化、心肌水肿和炎症因子如白介素-1β、肿瘤坏死因子-α和白介素-10等表达增加,促进房颤发生。
2.2 蒽环类药物
阿霉素被广泛地用于各种肿瘤的治疗,可引起剂量相关的心脏毒性,包括一过性心电图异常、心肌病和心力衰竭[13]。阿霉素也可以导致各种心律失常。阿霉素可以通过下调心脏Cx43/Cx45连接蛋白表达导致进行性心脏功能异常和左室重构。阿霉素可导致心肌细胞线粒体功能障碍、氧化应激和细胞凋亡。阿霉素可导致心肌肌浆网Ca2+ATP酶表达减少,诱发心力衰竭。阿霉素诱导钙调蛋白依赖性激酶Ⅱ(CaMKⅡ)激活,导致心肌肌浆网Ca2+渗漏,破坏细胞内Ca2+稳态,增加心脏触发活动和房颤的发生[14]。CaMKⅡ在房颤的发生中发挥重要作用,CaMKⅡ激活可以增加心房肌细胞晚钠电流和L型钙电流和钙调控蛋白磷酸化,导致肌浆网钙渗漏,抑制CaMKⅡ活性可以减轻阿霉素导致的心脏毒性[14],因此,抑制CaMKⅡ活性可以作为减少化疗诱发房颤的一种可能治疗方案。
2.3 靶向治疗
靶向治疗旨在干扰参与肿瘤发展进程中的特异性信号分子。靶向治疗药物一般分为单克隆抗体(如曲妥珠单抗)或小分子物质(如索拉非尼和舒尼替尼)。靶向治疗对肿瘤患者具有心脏毒性,这与心脏脱靶效应有关。乳腺癌患者发生新诊断的房颤(5.4%)与早期停用曲妥珠单抗有关。此外,最近的荟萃分析显示曲妥珠单抗应用过程中房颤的发生率为1.2%[15]。39名肝癌患者在进行索拉非尼联合5-氟尿嘧啶的Ⅱ期试验中,2例患者发生房颤,1例患者发生心衰。3例使用舒尼替尼预处理的转移性肾癌患者中有1例发生房颤。研究提示多数酪氨酸激酶抑制剂能显著增加肿瘤患者的QTc间期。曲妥珠单抗是一种作用于HER2的单克隆抗体,主要用于HER2过度表达的转移性乳腺癌的靶向治疗。在小鼠模型中,曲妥珠单抗通过增加心肌的氧化应激和凋亡、改变心肌细胞的超微结构导致心脏毒性。有证据表明,曲妥珠单抗与心肌细胞表面的HER2蛋白结合,阻断了ErbB2-ErbB4信号传递,进而造成左室收缩功能障碍。转移性胃肠间质瘤患者使用舒尼替尼治疗也可能引起左室功能障碍[16]。多靶向药物舒尼替尼能抑制一磷酸腺苷活化的蛋白激酶(AMPK),增加脂质沉积,阻滞钾通道,导致心律失常。索拉非尼造成心脏毒性的机制包括左室功能障碍、活性氧生成增加、线粒体功能障碍和心肌细胞坏死[17]。
3 免疫机制在肿瘤导致房颤中的作用
有研究提示肿瘤本身可能就是房颤发生的独立危险因素。一项入选乳腺癌和结肠癌患者的病例对照研究证实,肿瘤会影响房颤的发生发展。炎症激活参与恶性肿瘤和房颤的发生发展。在肿瘤和房颤发展进程中可发现多种炎症细胞因子如C反应蛋白、肿瘤坏死因子(TNF)-α,白介素(如白介素-6)和巨噬细胞迁移抑制因子水平升高。炎症在肿瘤发生发展中发挥重要作用,而房颤可能是肿瘤的一种炎症并发症。他汀类药物的抗炎作用可以有效预防房颤。因此,调节发生房颤的肿瘤患者的免疫应答可能是预防房颤的一个潜在策略。
3.1 C反应蛋白
C反应蛋白水平升高提示体内炎症激活,与房颤发生发展密切相关[18]。与肿瘤相关的全身性炎症能通过诱发心房结构重构来促进和维持房颤,临床研究发现,可以通过心房组织内局部C反应蛋白定位来确定心房局部炎症,相比持续性房颤,局部炎症更多参与阵发性房颤。乳腺癌患者在化疗的同时使用降低C反应蛋白的药物可以提高生存率。秋水仙碱能显著降低炎症介质如白介素-6和C反应蛋白的水平,可用于预防肺静脉隔离术后早期房颤的复发,临床使用秋水仙碱对肝癌患者有抗癌作用。越来越多的临床证据表明,他汀类药物除了能调节血清胆固醇水平外,对癌症的预防和治疗也有潜在的影响。他汀类药物治疗能减轻炎症,显著减少高敏炎症标志物如C反应蛋白,因此有助于预防房颤[19]。
3.2 肿瘤坏死因子-α
TNF-α主要由单核细胞和巨噬细胞产生,是免疫应答的重要调节因子,也是细胞因子网络中的重要成分。TNF-α在多种癌症类型中均表现为上调,且与肿瘤患者不良预后、激素治疗反应性缺失和恶病质的发生有关。既往研究发现TNF-α可能参与慢性房颤的发生。瓣膜性房颤患者与窦性心律的瓣膜病患者相比,NF-κB活性增强、TNF-α和IL-6浓度升高、单核细胞浸润增多、纤维化增多。持续性和永久性房颤患者TNF-α的浓度远高于阵发性房颤患者[20]。TNF-α诱发多种细胞包括心肌细胞的凋亡。TNF-α增加肺静脉起源房性心律失常的发生,破坏细胞内钙稳态,进而诱发房颤。TNF-α还通过一氧化氮依赖机制诱发大鼠心肌细胞电生理异常。同时,以TNF-α为靶点被认为是肿瘤治疗的一种潜在的免疫治疗方案。研究发现TNF-α是结肠癌发生和发展的重要调节因素,阻断小鼠体内的TNF-α可以减少与结肠炎相关结直肠癌的发生。因此,抗TNF-α药物可能有助于预防肿瘤治疗诱发的心脏毒性和房颤。
3.3 白介素-6
在多种类型的肿瘤和心脏疾病如心力衰竭和房颤中均有白介素的产生增加,心衰和房颤患者的促炎症细胞因子包括白介素-6的水平会升高。房颤患者血浆白介素-6水平升高,并且与房颤进程有关,同时与心脏复律后房颤复发以及血栓形成有关[21]。哺乳动物雷帕霉素靶蛋白(mTOR)的活化能减少白介素-6的产生、减少巨噬细胞的聚集,进而保护心脏功能。托珠单抗是一种抗白介素-6受体抗体,具有抗心律失常作用,通过抑制白介素-6可能减少房颤,有助于预防心脏手术后房颤的发生和复发。应用白介素-6阻滞剂作为抗肿瘤药物已经在多种癌症中应用,包括肺癌、多发性骨髓瘤、B细胞非霍奇金淋巴瘤、前列腺癌、肾细胞癌、卵巢癌以及头颈部癌症等。但是,应用抗白介素-6/白介素-6受体/gp30进行癌症治疗仍需进一步的临床前和临床研究的阐明。总的来说,这些研究强调了控制白介素-6的表达可能预防癌症患者心脏功能障碍。
3.4 巨噬细胞迁移抑制因子
巨噬细胞迁移抑制因子(MIF)是一种基因多效性的炎性细胞因子,作为多种急性和慢性炎症性疾病的调节因子。MIF在炎症通路中起重要作用,与多种表型肿瘤的形成密切相关[22]。MIF在心血管疾病的发病机制中发挥重要作用。心衰和房颤患者的MIF水平升高。MIF的表达与类风湿性关节炎的发病机制有关联,而类风湿性关节炎是房颤的一个重要的危险因素。细胞外MIF与携带CXCR2受体的单核细胞之间的相互作用能够增加炎症细胞动员并导致心脏功能受损。MIF可能是通过破坏钙通道和活化c-Src激酶来减少心房肌细胞的T型钙电流进而参与房颤的形成。阻滞MIF能显著减慢某些肿瘤在体内或体外系统的生长,如肺癌、甲状腺癌、膀胱癌、鳞状细胞癌、黑色素瘤和结肠癌,抑制MIF能预防高脂饮食诱发的心力衰竭以及压力负荷诱发的心肌肥厚[23]。
4 结语
大量研究已经证实,肿瘤患者发生房颤可能与手术、肿瘤药物治疗和肿瘤相关免疫有关,同时,房颤的发展也会影响肿瘤患者的预后和治疗效果。因此,研究肿瘤患者房颤的发生和维持机制十分重要,将有助于提高肿瘤患者的临床治疗效果。

