川西北高寒牧区不同人工草地对土壤微生物多样性影响
伍文宪,张蕾,黄小琴,杨潇湘,薛龙海,刘勇*
(1.四川省农业科学院植物保护研究所,四川 成都 610066;2.农业部西南作物有害生物综合治理重点实验室,四川 成都 610066)
川西北高寒草地位于青藏高原东部边缘半湿润地区,主要由草甸草原和沼泽湿地组成,是四川省重要的畜牧业生产基地,也是我国长江、黄河两大水系的重要水源涵养区,其生态地位、生态价值和战略意义突出[1]。与此同时,该区域作为全球高寒草原的典型区域,受全球气候变化影响强烈,是我国境内对全球变化反应较为敏感的生态系统之一。近几十年来,受全球气候变化及人为因素影响,川西北高寒草地“三化”(退化、沙化、荒漠化)现象严重,导致草地生产力下降,草畜矛盾尖锐,草原生态环境不断恶化,极大限制了该地区经济社会的可持续发展,削弱了川西北地区生态环境屏障的作用[2-3]。
建植和培育人工草地是恢复草原植被、遏制草原退化、改善生态环境的有效措施,同时也对该地区畜牧业稳定和可持续发展具有重大意义[4]。紫花苜蓿(Medicagosativa)、燕麦(Avenasativa)等牧草对高寒气候适应性强,容易栽培,饲用价值优良,已成为川西北高寒牧区大力推广的优选人工草地牧草种类[5]。通过十多年的努力,川西北高寒牧区采取了人工种草等一系列植被恢复综合治理措施,在维持天然草地草畜平衡,缓解草地生态压力及遏制局部生态环境恶化上取得了积极成效[2]。
土壤微生物是土壤生态系统的重要组成部分,参与并推动了生态环境中物质和能量的流动和转移[6]。土壤中微生物群落多样性不仅有助于维持土壤生态系统的稳定,还具有提高对抗土壤生态环境恶化的缓冲能力[7-8]。前人研究表明,土壤微生物群落结构受土壤质量和地上植物种类、组成、生物量等变化影响,例如地上部植被可通过其根际生理过程和根系分泌物等化感物质影响到土壤微生物群落的结构和组成,而土壤微生物反过来也会通过其自身的生理生化作用或分泌一些激素等物质对植被产生影响[9]。因此,研究土壤微生物群落对地上植物群落变化的响应,有助于理解该地区植被变化带来的生态学效应及其机制。目前关于人工草地的研究主要集中在地上植被群落演替及地下土壤的理化性状研究[10-11],而人工草地对土壤微生物群落影响的研究有待加强,已经开展的研究也主要集中在采用变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis, PCR-DGGE)、磷脂脂肪酸(phospholipid-derived fatty acids, PLFAs)等方法分析土壤微生物生物量与群落结构变化[12]。本研究围绕人工草地上种植的不同牧草对其地下土壤微生物群落结构与组成的影响,采用Illumina Hiseq高通量测序等分子生态学方法,结合生物信息学技术分析土壤细菌和真菌物种组成、群落结构及多样性,研究紫花苜蓿人工草地、燕麦人工草地和天然草地土壤微生物群落的差异,为合理开发利用人工草地及科学评价人工草地生态系统健康状况提供理论依据。
1 材料与方法
1.1 试验区概况和土壤采集
研究区位于四川省阿坝藏族羌族自治州红原县邛溪镇(N 32°50′-32°83′,E 102°35′-102°58′,海拔3520 m),属典型的大陆高原寒温带季风气候,降水集中于5-10月,年均降水量792 mm,平均相对湿度71%;年均气温0.9 ℃,最高气温在7月,平均气温10.9 ℃,最低气温在12月,平均气温-10.3 ℃,年均积温1432.2 ℃,≥10 ℃年积温322 ℃,年均积雪期达70 d以上,无绝对的无霜期。主要植被类型为高寒草甸、沼泽草甸、高山灌丛草地等;土壤类型以亚高山草甸土为主,沼泽土、沼泽化草甸土和风沙土等均有分布[3,13-15]。
2017年9月在位于红原县邛溪镇的西南民族大学青藏高原基地选取3块试验样地,分别为紫花苜蓿人工草地、燕麦人工草地及天然草地,其中紫花苜蓿人工草地和燕麦人工草地建植期均为5年,天然草地植被主要为垂穗披碱草(Elymusnutans)+车前草(Plantagoasiatica)+密花早熟禾(Poapachyantha)+珠芽蓼(Polygonumviviparum),盖度为75%~90%。在3个样地内选取呈三角形的3个采样点,各样点间距离约50 m,每个样点按5点取样法取0~10 cm土层土样,混合均匀后合为一个土壤样品[16]。试验设置3个平行重复,最终得到3个紫花苜蓿人工草地土壤样品、3个燕麦人工草地土壤样品和3个天然草地土壤样品,土样装密封袋低温带回实验室,过2 mm筛后立即保存在超低温冰箱(-80 ℃)冷冻暂存。
1.2 土壤微生物总DNA提取、PCR扩增和高通量测序
采用E.Z.N.A.®Soil DNA Kit(OMEGA土壤基因组DNA提取试剂盒)提取土壤总DNA,DNA含量和纯度采用NanoDrop 2000(Thermo Fisher Scientific Massachusetts, The United States of America)测定,利用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA基因的V4高变区进行PCR扩增[17]。采用引物ITS1-1737F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS2-2043R(5′-GCTGCGTTCTTCATCGATGC-3′)对真菌rRNA内转录间隔区进行PCR扩增[18]。PCR反应体系50 μL:模板DNA(10 ng) 2 μL,10×PCR buffer(Mg2+Plus) 5 μL,dNTP(10 mmol·L-1) 5 μL,Bar-PCR引物F(50 μmol·L-1) 0.5 μL,引物R(50 μmol·L-1) 0.5 μL,TaKaRa Taq(5 U·μL-1) 0.5 μL,灭菌双蒸水36.5 μL。PCR反应条件为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共35个循环;72 ℃ 10 min。将纯化质量合格的PCR产物用于DNA文库构建,建库及测序工作委托北京诺和致源科技有限公司执行。
1.3 数据处理和统计分析
根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样品数据。使用FLASH(v1.2.7, http://ccb.Jhu.Edu/software/FLASH/)软件对每个样品的序列进行拼接并过滤掉低质量的序列[19-20]。参照QIIME(v1.9.1, http://qiime.org/scripts/split_libraries_fastq.html)的序列质量控制流程进行序列截取和长度过滤。经过以上处理后得到的序列需要进行去除嵌合体序列处理,通过UCHIME Algorithm(http://www.drive5.com/usearch/m- anual/uchime_algo.html)与数据库(Gold database, http://drive5.com/uchime/uchime_download.html)进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据。利用Uparse 软件(Uparse v7.0.1001, http://drive5.com/uparse/)对所有样品的全部有效序列进行聚类,将相似性大于97%的有效序列聚类成一个操作分类单元(operational taxonomic unit, OTU),并为每个OTU对应的代表序列分配分类单元[21-22]。对OTUs代表序列进行物种注释,用Mothur方法与SILVA(http://www.arb-silva.de/)[23]的SSUrRNA数据库[24]进行物种注释分析(设定阈值为0.8~1.0),获得分类学信息并分别在各个分类水平:界(kingdom),门(phylum),纲(class),目(order),科(family),属(genus),种(species)统计各样本的群落组成。使用MUSCLE[25](Version 3.8.31,http://www.drive5.com/muscle/)软件进行快速多序列比对,得到所有OTUs代表序列的系统发生关系。最后对各样品的数据进行均一化处理,以样品中数据量最少的为标准进行均一化处理,后续的Alpha多样性分析和Beta多样性分析都是基于均一化处理后的数据。对各个样品的OTU进行组成分析,得到不同分类水平上的细菌和真菌类群组成及相对丰度信息,将其中无法鉴定到分类水平的类群统称为未知类群(Unknown),将相对丰度低于1%的类群合并统称为其他类群(Others)[20]。
采用Excel 2013、SPSS 16.0统计软件对试验数据进行处理、分析,采用One-way ANOVA单因素方差分析和LSD多重比较检验分析紫花苜蓿人工草地(Group 1)、燕麦人工草地(Group 2)以及天然草地(Group 3)土壤在P=0.05水平上的组间显著性差异。利用各样品OTUs之间的系统发生关系,用QIIME软件(Version 1.9.1)计算丰富度指数(Chao index),香农指数(Shannon index),ACE指数(ACE index)以及覆盖度(Goods-coverage),使用R软件(Version 2.15.3)绘制稀释曲线,计算Unifrac距离(Unweighted Unifrac)和Weighted Unifrac距离(Weighted Unifrac),形成距离矩阵热图。使用R软件(Version 2.15.3)的Ade 4和Ggplot 2软件进行主成分差异分析并绘制主成分分析(principal component analysis, PCA)图。
2 结果与分析
2.1 人工草地与天然草地土壤细菌和真菌群落Alpha多样性特征
对3个区组共计9个土壤样本进行高通量测序,结果显示紫花苜蓿人工草地(Group 1)细菌和真菌分别获得有效序列为83615和79884条;燕麦人工草地(Group 2)细菌和真菌分别获得有效序列为84167和81628条;而天然草地(Group 3)细菌和真菌分别获得有效序列为85725和84091条。稀释曲线可反映测序深度,是评估测序量是否足以覆盖所有类群的一个关键指标,如图1所示,随着测序数量的增加,各区组土壤细菌和真菌稀释曲线趋向平坦,说明3个区组土壤样本测序深度已近乎饱和,基本涵盖了土壤中所有细菌和真菌种群。

图1 3种草地植被下土壤细菌和真菌的稀释曲线Fig.1 Bacterial and fungal rarefaction curve analysis in three vegetations Group 1: 紫花苜蓿人工草地土壤;Group 2: 燕麦人工草地土壤;Group 3: 天然草地土壤。下同。Group 1: Artificial meadow (alfalfa) soils;Group 2: Artificial meadow (oats) soils; Group 3: Natural grassland soils. The same below.
测序样本中,紫花苜蓿人工草地(Group 1)土壤中检测到3782个细菌OTUs,1206个真菌OTUs;燕麦人工草地(Group 2)土壤中检测到3872个细菌OTUs,962个真菌OTUs;天然草地(Group 3)土壤中则检测到3821个细菌OTUs,1016个真菌OTUs。OTUs表示土壤微生物丰富度实际观测值,可以看出,紫花苜蓿人工草地、燕麦人工草地与天然草地土壤微生物OTUs值相当,差异不显著。3种草地类型下的土壤细菌覆盖率均超98.90%,真菌覆盖率分别为92.37%、92.10%和93.45%(表1和表2),表明测序土壤样本中细菌和真菌序列没有被测出的概率低,测序结果能够表示土壤中细菌和真菌的真实存在情况。Chao指数和ACE指数表示土壤微生物的丰富度,而Shannon指数可反映土壤微生物的多样性程度[26]。如表1所示,土壤细菌α-多样性指数在不同草地植被类型之间均无显著性差异。从表2可知,各草地植被类型在土壤真菌Chao指数和ACE指数上也无显著性差异,但紫花苜蓿人工草地(Group 1)土壤真菌Shannon指数显著高于燕麦人工草地(Group 2)和天然草地(Group 3),表明各区组土壤样本间的细菌和真菌群落丰富度无显著性差异,仅紫花苜蓿人工草地土壤真菌群落多样性程度与燕麦人工草地和天然草地比较有显著性提高(P<0.05)。
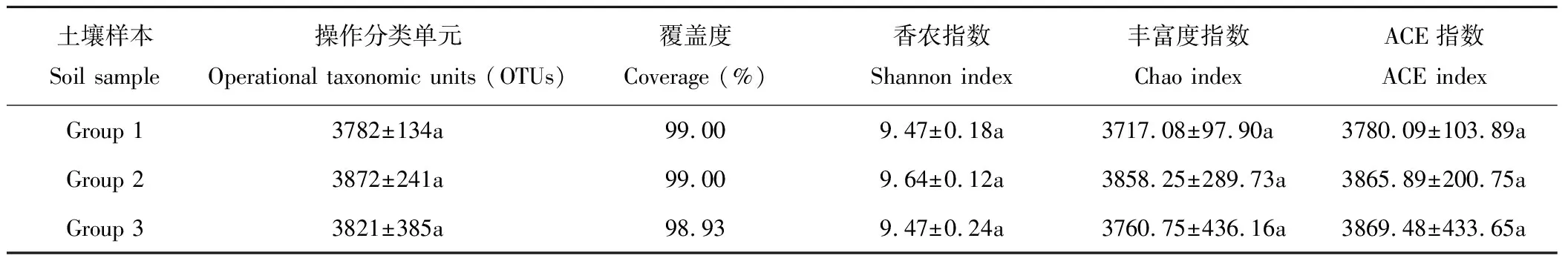
表1 3种草地植被类型下土壤细菌多样性指数 Table 1 Diversity indices for soil bacteria communities in three vegetation types
注:同列不同小写字母表示差异显著(P<0.05),下同。
Note:The different letters mean the significant differences atP<0.05, the same below.
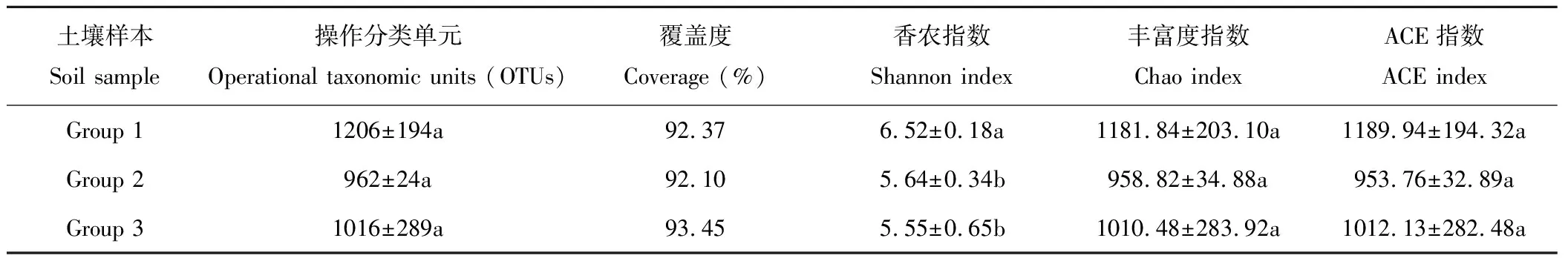
表2 3种草地植被类型下土壤真菌多样性指数 Table 2 Diversity indices for soil fungal communities in three vegetation types
2.2 人工草地与天然草地土壤细菌群落组成分析
OTU物种注释结果表明,3个草地植被类型土壤中的11475个OTUs隶属于42门92纲171目330科547属。主要细菌门类(相对丰度≥1%)分别是:变形菌门(Proteobacteria)28.47%、酸杆菌门(Acidobacteria)21.13%、放线菌门(Actinobacteria)15.11%、疣微菌门(Verrucomicrobia)12.19%、绿弯菌门(Chloroflexi)5.34%、浮菌门(Planctomycetes)3.54%、硝化螺旋菌门(Nitrospirae)2.74%、芽单胞菌门(Gemmatimonadetes)3.68%、拟杆菌门(Bacteroidetes)2.81%以及厚壁菌门(Firmicutes)1.66%,其余门类所占比例均低于1%,共占3.32%。通过物种差异分析得出,天然草地土壤中的酸杆菌门(Acidobacteria)和硝化螺旋菌门(Nitrospirae)丰度显著高于人工草地(P<0.05);人工草地土壤中放线菌门(Actinobacteria)丰度显著高于天然草地(P<0.05);紫花苜蓿人工草地土壤中绿弯菌门(Chloroflexi)丰度显著高于燕麦人工草地和天然草地。紫花苜蓿人工草地土壤样本中厚壁菌门(Firmicutes)丰度显著高于天然草地(P<0.05),但与燕麦人工草地比较却无显著性差异;其他细菌门在燕麦人工草地与天然草地之间存在显著差异(P<0.05)(图2)。
细菌纲分类水平上,3种植被类型的土壤优势菌为:Spartobacteria纲,α-变形菌纲(α-proteobacteria),β-变形杆菌纲(β-proteobacteria),Thermoleophilia纲,酸杆菌纲(Acidobacteria),放线菌纲(Actinobacteria),Blastocatellia纲,γ-变形菌纲(γ-proteobacteria)以及硝化螺旋菌纲(Nitrospira)等。3个草地植被类型土壤中纲水平优势菌群丰富度高低顺序不一致,在紫花苜蓿人工草地土壤中,Spartobacteria纲丰度最高,α-变形菌纲次之;在燕麦人工草地土壤中,细菌纲水平相对丰度顺序为:α-变形菌纲>Spartobacteria纲>β-变形杆菌纲>Thermoleophilia纲>放线菌纲;而在天然草地土壤中的丰度从高到低依次为:β-变形杆菌纲>Spartobacteria纲>α-变形菌纲>酸杆菌纲>Blastocatellia纲>γ-变形菌纲。物种差异结果如图3所示,人工草地与天然草地土壤中的α-变形菌纲、Thermoleophilia纲、酸杆菌纲、放线菌纲、Blastocatellia纲和硝化螺旋菌纲相对丰度存在显著性差异(P<0.05)。
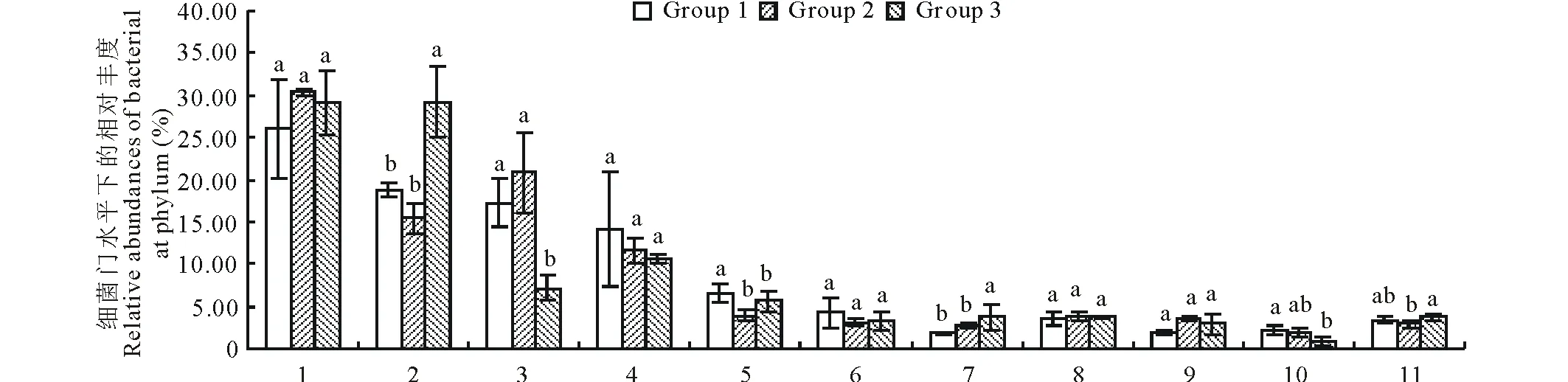
图2 门水平下的细菌群落组成Fig.2 Composition of bacterial community at phylum level 1:变形菌门 Proteobacteria;2:酸杆菌门 Acidobacteria;3:放线菌门Actinobacteria;4:疣微菌门 Verrucomicrobia;5:绿弯菌门 Chloroflexi;6:浮霉菌门 Planctomycetes;7:消化螺菌门 Nitrospirae;8:芽单胞菌门 Gemmatimonadetes;9:拟杆菌门 Bacteroidetes;10:厚壁菌门Firmicutes;11:其他Others.不同小写字母表示差异显著(P<0.05),下同。The different letters mean the significant differences at P<0.05, the same below.
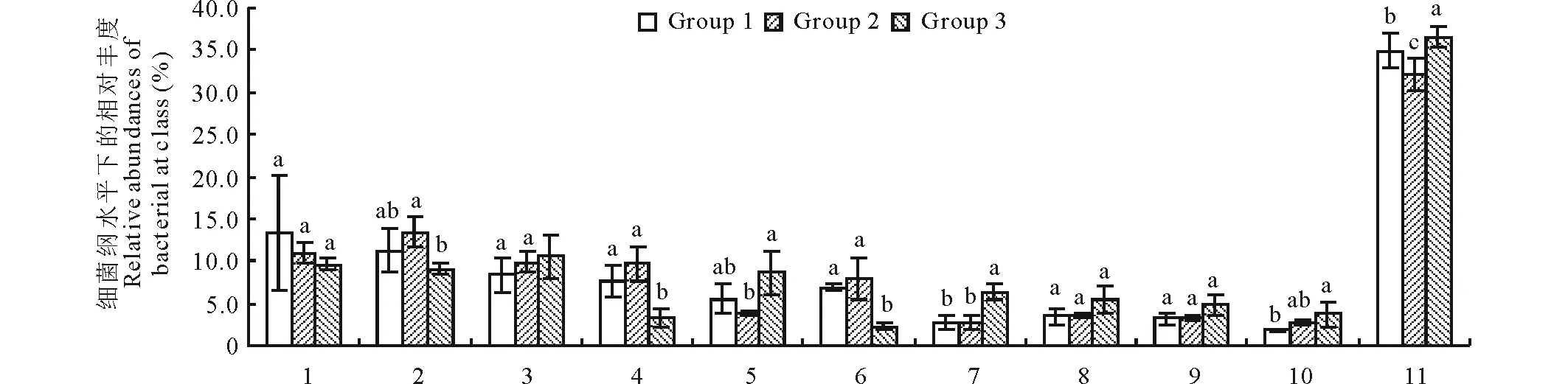
图3 纲水平下土壤细菌群落组成Fig.3 Composition of bacterial community at class level 1:Spartobacteria;2:α-变形杆菌纲 α-proteobacteria;3:β-变形杆菌纲 β-proteobacteria;4:Thermoleophilia;5:酸杆菌纲 Acidobacteria;6:放线菌纲 Actinobacteria;7:Blastocatellia;8:Subgroup_6;9:γ-变形菌纲 γ-proteobacteria;10:硝化螺旋菌纲 Nitrospira;11:其他 Others.
根据每个区组土壤中各细菌属的丰度均值,选取丰度排名为前35的细菌属,对不同植被类型之间细菌的相对丰度进行聚类分析,得到热图(Heatmap)(图 4)。从图4中可知,紫花苜蓿人工草地土壤有11个属相对丰度较高,分别为红游动菌属(Rhodoplanes)、节杆菌属(Pseudarthrobacter)、嗜酸栖热菌属(Acidothermus)、芽孢杆菌属(Bacillus)、芽孢八叠球菌属(Sporosarcina)、Pseudolabrys属、嗜盐囊菌属(Haliangium)、Bryobacter属、Dokdonella属等;燕麦人工草地土壤相对丰度较高的有12个属,主要是鞘氨醇单孢菌属(Sphingomonas)、马赛菌属 (Massilia)、芽单孢菌属(Gemmatimonas)、土壤红杆菌属(Solirubrobacter)和类诺卡氏菌属(Nocardioides);而在天然草地土壤中则以地杆菌属(Geobacter)、厌氧粘细菌(Anaeromyxobacter)和其他未命名细菌属为主。
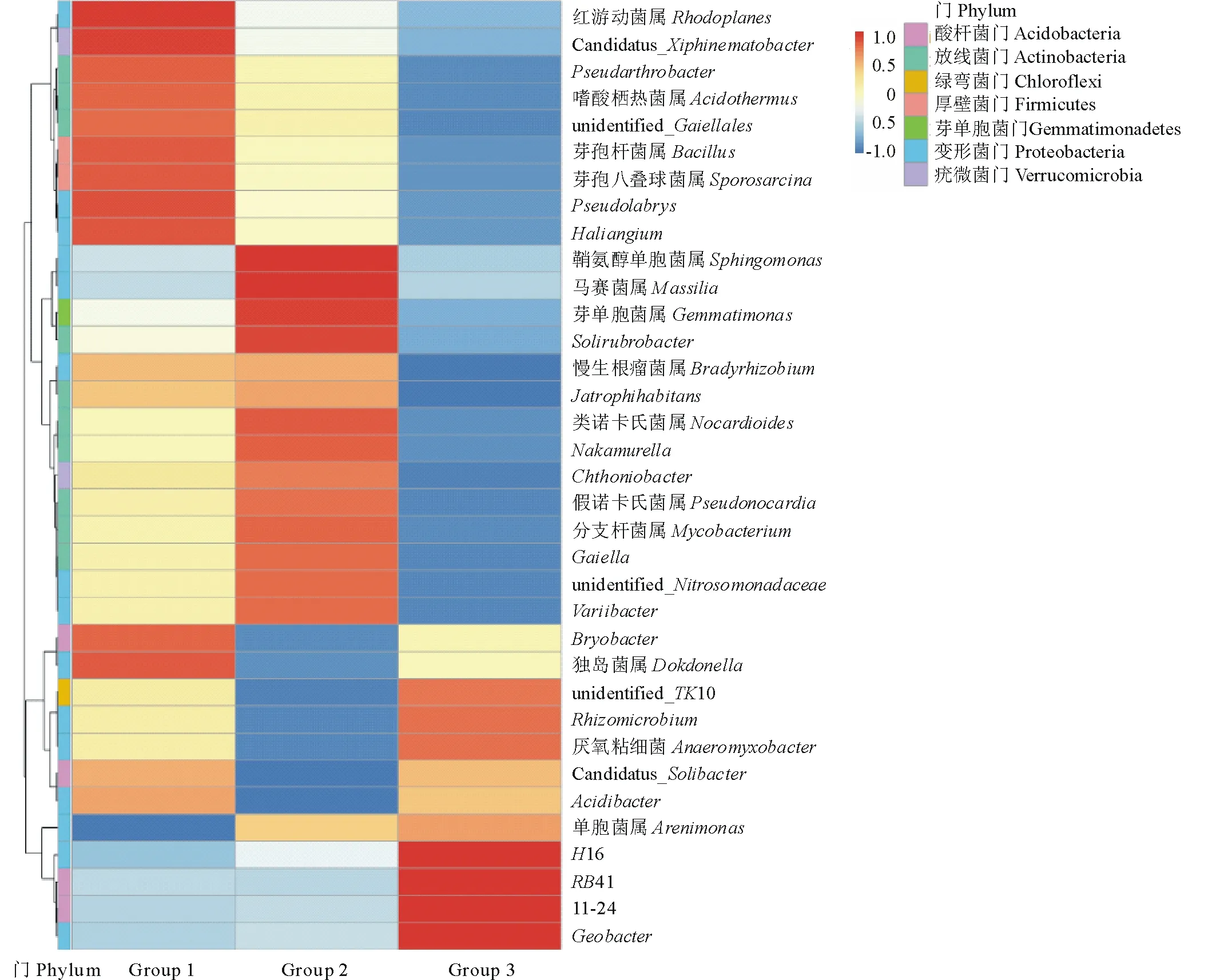
图4 3种土壤样品细菌属水平相对丰度热图Fig.4 Heatmap diagram of bacterial genus in different soil samples
2.3 人工草地与天然草地土壤真菌群落组成分析
3个草地植被类型土壤样品中的3184个OTUs分属于6门29纲95目221科331属,大于1%的真菌门类有子囊菌门(Ascomycota)、接合菌门(Zygomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)、壶菌门(Chytridiomycota),如图5所示,燕麦人工草地与紫花苜蓿人工草地土壤中接合菌门丰度有显著性差异(P<0.05),除此之外,3个草地植被类型土壤中的其他真菌门类相对丰度均无显著性差异。
纲水平上,3种植被类型的土壤优势菌纲有接合菌纲(Zygomycotes)、粪壳菌纲(Sordariomycetes)、伞菌纲(Agaricomycetes)、散囊菌纲(Eurotiomycetes)、Archaeorhizomycetes纲、盘菌纲(Pezizomycetes)、锤舌菌纲(Leotiomycetes)、座囊菌纲(Dothideomycetes)、球囊菌纲(Glomeromycetes)、子囊菌纲(Ascomycetes),还有10.97%的未能分类。在紫花苜蓿人工草地土壤中,按照丰富度由高到低排列顺序为:粪壳菌纲>接合菌纲>座囊菌纲>锤舌菌纲>伞菌纲>散囊菌纲;燕麦人工草地土壤纲水平相对丰度排名为:接合菌纲>粪壳菌纲>锤舌菌纲>伞菌纲>座囊菌纲>散囊菌纲;而在天然草地土壤中的丰度顺序是:接合菌纲>Archaeorhizomycetes纲>伞菌纲>散囊菌纲>粪壳菌纲>盘菌纲。图6分析显示3个区组在纲水平上物种差异较大,表明紫花苜蓿人工草地、燕麦人工草地及天然草地土壤中真菌纲水平的相对丰度差异明显。
图5 土壤真菌在门水平上的群落组成Fig.5 Soil fungal phylum community composition 1:子囊菌门 Ascomycota;2:接合菌门 Zygomycota;3:担子菌门 Basidiomycota;4:球囊菌门 Glomeromycota;5:壶菌门 Chytridiomycota.

图6 土壤真菌在纲水平上的群落组成Fig.6 Soil fungal community composition at the class level 1:接合菌纲 Zygomycetes;2:粪壳菌纲 Sordariomycetes;3:伞菌纲 Agaricomycetes;4:散囊菌纲 Eurotiomycetes;5:Archaeorhizomycetes;6:盘菌纲 Pezizomycetes;7:锤舌菌纲 Leotiomycetes;8:座囊菌纲 Dothideomycetes;9:球囊菌纲 Glomeromycetes;10:子囊菌纲 Ascomycetes;11:其他 Others.
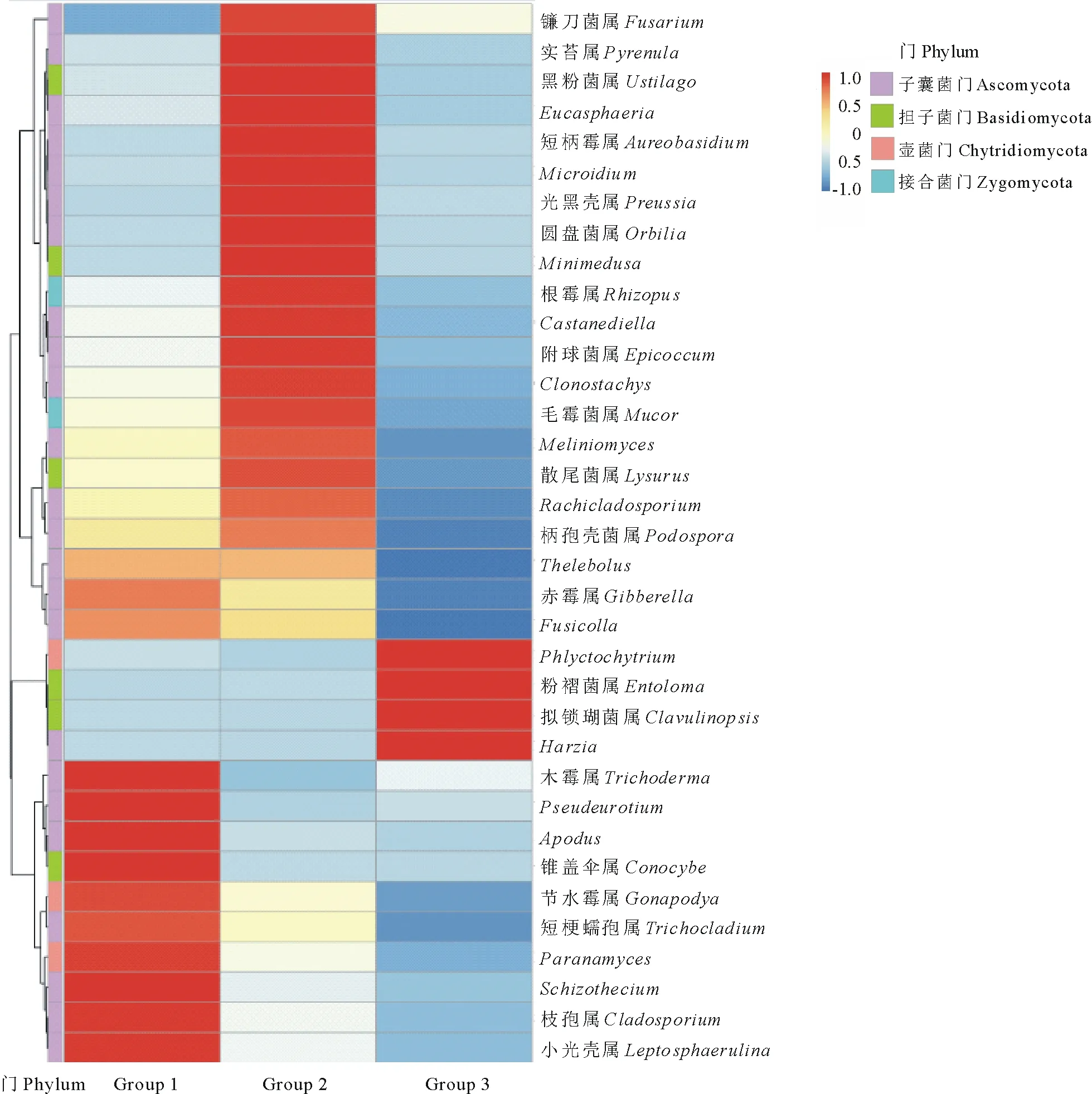
图7 3种土壤样品真菌属水平相对丰度热图Fig.7 Heatmap diagram of fungal genus in three soil samples
在属分类水平上,紫花苜蓿人工草地土壤真菌组成中丰度较高的有10个属,主要为:木霉属(Trichoderma)、假散囊菌属(Pseudeurotium)、锥盖伞属(Conocybe)、节水霉属(Gonapodya)、短梗蠕孢属(Trichocladium)、裂壳菌属(Schizothecium)、枝孢属(Cladosporium)、小光壳属(Leptosphaerulina)等;在燕麦人工草地土壤中,丰度排名靠前的已知真菌属主要为镰刀菌属(Fusarium)、实苔属(Pyrenula)、黑粉菌属(Ustilago)、Eucasphaeria属、短梗霉属(Aureobasidium)、光黑壳属(Preussia)、圆盘菌属(Orbilia)、附球菌属(Epicoccum)等16个属;在天然草地土壤中,丰度较高的有4个真菌属,分别是囊壶菌属(Phlyctochytrium)、粉褶菌属(Entoloma)、哈氏菌属(Harzia)和拟锁瑚菌属(Clavulinopsis)。
2.4 人工草地与天然草地土壤微生物群落Beta多样相关性分析
Beta多样性分析关注样品间的微生物群落构成差异,距离矩阵热图、主坐标分析(principal co-ordinates analysis, PCoA)、主成分分析(principal component analysis, PCA)、无度量多维标定法(non-metric multi-dimensional scaling, NMDS)等均可反映样品间的Beta多样性差异。距离矩阵热图是由Unweighted Unifrac距离和Weighted Unifrac 距离构成,Unweighted Unifrac 距离是利用各样品中微生物序列间的进化信息来计算样品间距离,Weighted Unifrac距离则是利用OTUs的丰度信息对Unweighted Unifrac距离进一步构建而成,这两个指标均可以指示样品间的微生物群落构成差异性, 其值越大, 表示样品间在物种结构上存在的差异越大[27]。 主成分分析是通过正交变换将变量个数较多的复杂数据转换为一组线性不相关的变量,从而将多维数据的差异反映在二维坐标图上,从中发现不同样品(组)间的差异,如果样品的群落组成差异越大,则它们在PCA图中的距离越远[20-22]。

图8 土壤样品细菌(A、C)、真菌(B、D)距离矩阵热图(A、B)及主成分相关分析(C、D)Fig.8 Distance matrix heatmap (A, B) and principle component analysis (C, D) of bacteria (A, C) and fungi (B, D) difference in groups among soil samples A、B方格里的上方数字为Weighted Unifrac距离系数,方格里下方数字为Unweighted Unifrac距离系数。The upper numbers in the grid are weighted unifrac distance coefficient; the numbers below are unweighted unifrac distance coefficient.
由图8A可知,紫花苜蓿人工草地(Group 1)与天然草地(Group 3)土壤细菌Weighted Unifrac、Unweighted Unifrac距离系数分别为0.158和0.382;燕麦人工草地(Group 2)与天然草地(Group 3)土壤细菌Weighted Unifrac、Unweighted Unifrac距离系数分别是0.167和0.327;而紫花苜蓿人工草地(Group 1)与燕麦人工草地(Group 2)土壤细菌Weighted Unifrac与Unweighted Unifrac距离系数分别是0.114和0.339。图8B分析得知,对真菌而言,紫花苜蓿人工草地(Group 1)与天然草地(Group 3)相比,组间Weighted Unifrac距离系数达到1.103,Unweighted Unifrac距离系数为0.589;燕麦人工草地(Group 2)与天然草地(Group 3)相比,组间Weighted Unifrac距离系数达到0.969,Unweighted Unifrac距离系数为0.626;而紫花苜蓿(Group 1)与燕麦人工草地(Group 2)土壤真菌Weighted Unifrac距离系数是0.633,Unweighted Unifrac距离系数是0.579。以上结果说明天然草地与人工草地之间的土壤微生物差异系数大于两种人工草地之间的土壤微生物差异系数。PCA分析可知,在细菌和真菌水平上,紫花苜蓿人工草地(Group 1)、燕麦人工草地(Group 2)以及天然草地(Group 3)3组间距离大,组内之间距离小,并且天然草地与人工草地土壤之间的微生物差异距离大于两种人工草地土壤之间的微生物差异距离,表明草地植被类型改变了地下土壤微生物群落结构。
3 讨论
为探讨人工种植牧草后对地下土壤微生物群落和结构的影响,本研究采用高通量测序结合生物信息学技术对土壤细菌和真菌物种组成、群落结构及多样性等进行了分析,以期合理开发利用人工草地及科学评价人工草地生态系统健康状况提供依据。
在3个不同处理土壤样本中,我们共检测到变形菌门、酸杆菌门、放线菌门、疣微菌门等42个细菌门类,变形菌门是3种草地植被土壤中丰度最高的细菌类群,这一结果与其他学者关于草地土壤细菌多样性的大多数研究一致[16]。在已有的报道中,变形菌门被认为与碳利用有关,是世界上最为普遍的菌门。酸杆菌门与土壤营养相关性较大,一般而言,营养贫瘠的土壤中,酸杆菌门丰富度较高,酸杆菌门丰度与碳的可用性呈负相关关系[28-30],本研究中天然草地土壤中的酸杆菌门丰度显著高于人工草地,且在纲水平上,天然草地土壤酸杆菌纲也显著高于人工草地,这间接说明人工草地土壤相较于天然草地,其土壤养分更为肥沃。本研究中放线菌门是仅次于变形菌门、酸杆菌门的另一类优势类群,在门和纲水平上,人工草地土壤放线菌丰度均显著高于天然草地,放线菌最突出的特性是能分泌产生多种抗生素类物质,说明人工草地土壤中具有比天然草地更多抗生素资源。细菌属水平上,分析了紫花苜蓿人工草地、燕麦人工草地和天然草地土壤相对丰度热图,在人工草地中,丰度较高的有芽孢杆菌属、土壤杆菌属、类诺卡氏菌属等生防菌类群,而在天然草地土壤中,丰度较高的是厌氧菌属和一些未知细菌属,说明川西北高寒草地土壤经人工种草后,生防菌资源丰富度增加。
本研究中,3种草地类型土壤优势真菌门按照丰富度由高到低排列顺序依次为子囊菌门 >接合菌门>担子菌门>球囊菌门>壶菌门,高雪峰等[16]在短花针茅(Stipabreviflora)荒漠草原土壤微生物群落研究中发现子囊菌门、接合菌门、担子菌门和壶菌门是优势真菌类群,朱琳等[31]对辽宁人工林根际土壤真菌研究中检测到子囊菌门、接合菌门、担子菌门和壶菌门这4个门外,还有球囊菌门和芽枝霉门,本研究与这些研究结果的真菌群落主要构成类似。前人报道子囊菌门大多数为腐生菌,对降解土壤有机质等养分循环起着重要作用,担子菌门腐生或寄生,在潮湿的土壤中,可分解木质纤维素[32-33],子囊菌和担子菌均是土壤中主要的真菌分解者,本研究结果发现人工草地与天然草地在子囊菌门和担子菌门上丰度无显著性差异,说明人工种草不会对土壤有机质等养分循环起到干扰作用。真菌门水平上,人工草地土壤与天然草地土壤间的接合菌门丰度存在差异,这可能与耕作特别是施肥会影响土壤中接合菌门的含量有关。对真菌属水平聚类分析发现,3个区组间差异较大,紫花苜蓿人工草地优势类群为木霉属、散囊菌属、锥盖伞属、短梗蠕孢属、小光壳属等;燕麦人工草地优势真菌属是镰刀菌属、黑粉菌属、附球菌属、圆盘菌属等;而天然草地优势菌群集中于囊壶菌属、粉褶菌属、哈氏菌属等。紫花苜蓿优势真菌类群中,短梗蠕孢属真菌大多可引起苜蓿根腐病的发生,小光壳属则是苜蓿叶斑病的主要病原。燕麦人工草地优势真菌属中,镰刀菌可以引起禾本科植物根腐病的发生,黑粉菌属是引起燕麦黑穗病的病原,附球菌属可以引起叶片叶斑病发生。说明经人工种植牧草后,草地土壤中病原真菌丰度相应地增加。
土壤微生物的多样性反映微生物群落的稳定性及土壤环境对其群落结构的影响,是土壤生态特征的关键指标,可以通过α-多样性和β-多样性来反映,α-多样性最常用的指标有Chao、ACE、Shannon指数等,Chao指数和ACE指数表示土壤微生物的丰富度,而Shannon指数可反映土壤微生物的多样性程度。研究结果表明,人工草地与天然草地在细菌Chao、ACE、Shannon指数上无显著性差异,在真菌Chao、ACE指数上差异也不显著,但紫花苜蓿人工草地土壤真菌Shannon指数显著高于燕麦人工草地和天然草地,表明各区组土壤样本间的细菌和真菌群落丰富度无显著性差异,仅紫花苜蓿人工草地土壤真菌群落多样性程度与燕麦人工草地和天然草地比较有显著性提高。β-多样性分析表明,草地植被改变了地下土壤微生物群落结构组成,且天然草地与人工草地之间的土壤微生物差异系数大于两种人工草地之间的土壤微生物差异系数。
4 结论
人工种植牧草后基本不会改变川西北高寒草地土壤中微生物群落丰富度和多样性;但改变了地下土壤微生物群落构成,天然草地与人工草地之间的土壤微生物差异系数大于两种人工草地之间的土壤微生物差异系数;人工种植牧草降低了土壤酸杆菌门的相对丰度,提高了放线菌、芽孢杆菌、土壤杆菌、木霉菌等生防菌类群的相对丰度,与此同时,人工草地土壤中的诸如镰刀菌属、黑粉菌属、小光壳属等病原真菌丰度较天然草地土壤大幅增加。研究结果表明,人工种植牧草不会对土壤有机质等养分循环起到干扰作用,相反土壤养分更为肥沃,生防菌资源丰富度增加,但土壤中病原真菌丰度会相应地大幅增加。本研究结果可为认识人工种草对川西北高寒牧区土壤微生物群落组成及多样性影响提供科学参考。

