多环芳烃生物降解及转化途径的研究进展
唐涛涛, 李 江,2,3, 杨 钊, 向福亮
(1.贵州大学 资源与环境工程学院, 贵州 贵阳 550025; 2.贵州大学 应用生态研究所, 贵州 贵阳 550025;3.贵州省喀斯特环境生态工程研究中心, 贵州 贵阳 550025)
多环芳烃(PAHs)是由2个或2个以上的苯环以线性排列、弯曲连接或者聚簇状的方式构成的有机污染物,其水溶性和挥发性会随相对分子质量的增大而减小[1]。根据苯环数目,分为低相对分子质量(2~3环)PAHs和高相对分子质量(4环及以上)PAHs;根据来源分为天然来源和人为来源,其中人为来源是环境中PAHs主要来源[2]。PAHs的生物毒性主要从两方面表现:一方面是PAHs本身具有的化学结构;另一方面是PAHs进入生物体后被细胞色素P450依赖的混合氧化酶氧化或羟基化[3]。
尽管PAHs在环境中会受到化学氧化、光解作用、生物积累、挥发和吸附,但微生物降解和转化被视为是降解的主要过程[4-6]。细菌、古菌、真菌均能降解PAHs。它们不仅能通过释放生物表面活性剂等方式提高PAHs的生物可利用性,而且还能通过生物转化、矿化作用将有机物分解为一些复杂的代谢产物及无机物,如H2O、CO2(好氧)、CH4(厌氧)。在好氧环境下,微生物易培养、降解效率高,但在降解过程中会产生有毒中间产物[7],容易对环境造成二次污染。厌氧环境对PAHs的降解会产生结构简单、毒性小、分解更完全的中间产物,且在降解过程中会产生清洁能源CH4,因此厌氧降解逐渐成为降低PAHs危害的另一有效途径[8]。
目前,关于微生物降解PAHs的研究已较为深入,主要集中于降解机理、产物分析、关键酶及相关反应类型等方面。由于微生物生长环境不同,其代谢产物、代谢关键酶及降解转化存在差异性,因此降解机理的研究仍是今后的研究重点。笔者通过查阅国内外相关文献,总结归纳微生物在不同环境下降解PAHs的转化机理、中间产物、关键酶及相关反应类型,为今后深入研究PAHs的生物降解机理及途径提供参考。
1 PAHs降解菌种
1.1 PAHs好氧降解菌
在好氧环境下,细菌和真菌对PAHs均有较好的降解效能,其中细菌发挥主要作用(见表1)。在PAHs降解菌中,假单胞菌属(Pseudomonassp.)和分枝杆菌属(Mycobacteriumsp.)因具有较好的降解能力备受关注,而且假单胞菌属对高浓度PAHs也具有较好的耐受性。陈远志[9]发现,Mycobacteriumsp.WY10对菲(100 mg/L)和芘(50 mg/L)的降解效率可达到100.0%和92.3%。李想等[10]发现,Pseudomonassp.LX2在芘质量浓度为50 mg/L的无机盐液体培养基中培养21 d后对芘的降解率达到32.1%。徐成斌等[11]发现,Pseudomonasotitidis对菲的最大耐受质量浓度为2000 mg/L。
1.2 PAHs厌氧降解菌
在厌氧环境下,细菌及古菌均可降解PAHs,这些细菌大多数被识别为假单胞菌属(Pseudomonassp.)[23]、厚壁菌属(Firmicutesp.)和梭状芽胞杆菌属(Clostridiumsp.)[28-29],如:梭状芽胞杆菌属能降解萘酸化合物[22,30]、芴及部分菲、蒽和芘[29]。有研究也发现,δ-变形菌和厚壁菌属在产甲烷条件下能降解萘、菲等低相对分子质量PAHs[31],同时假单胞菌属和微杆菌属在特定环境下能降解苯并[a]芘[32-33]。Zhang等[34]利用稳定同位素探针技术也发现,在产甲烷环境下降解蒽的主要菌种为Proteobacteria、Methylibium、Legionella及一种尚未识别的菌株Rhiszobiales。
古菌对PAHs也具有一定的降解效能,产甲烷菌因其能将有机物转化为CH4而备受关注。Christensen等[35]发现,若氢型古菌能通过氧化PAHs去除H2,则能达到降解PAHs(萘)的目的。Berdugo-Clarijo等[36]也指出,Methanosaeta和Methanobacteria在降解低相对分子质量PAHs中起重要作用,同时还发现产甲烷菌在降解萘、1-甲基萘、2,6-二甲基萘时,Methanosaeta和Methanoculleus起主要作用。Bonalis等[37]发现,厌氧降解PAHs的主要产甲烷菌为Methanoregular、Methanosarcina和Methanobacterium。而Schmidt等[38]研究也发现,在厌氧环境下降解PAHs及其中间产物时,Methanoregular是主要的产甲烷菌。
2 PAHs降解机理
PAHs生物降解可分为好氧降解和厌氧降解。在好氧环境下,PAHs的断开主要靠加氧酶作用,即加氧酶能将氧原子加到C—C键上形成C—O键,随后再通过加氢、脱水等作用使C—C键断裂,使苯环数减少。而厌氧环境不同于好氧环境,PAHs开环不仅能在酶的作用下进行,还能与其它物质相结合发生羧化反应、还原反应、羟基化及甲基化反应等。羧化反应是由外源碳原子添加到PAHs的苯环上,生成相应的脂肪酸。羟基化和甲基反应,主要是羟基或甲基结合PAHs的苯环生成相应的酚类物质[4]。还原反应主要是与H2结合实现PAHs的开环。

表1 PAHs的降解菌Table 1 Bacteria for PAHs degradation
Ant—Anthracene; Flu—Fluorene; PYR—Pyrene; CHR—Chrysene; FLA—Fluoranthene; BaA—Benzo[a]anthracene; DBA—Dibenzo[a,h] anthracene; Nap—Naphthalene; Phe—Phenanthrene; BaP—Benzo[a]pyrene
2.1 好氧降解机理
有研究发现,微生物在降解PAHs过程中主要取决于酶的活性,其中细菌产生双加氧酶,真菌产生单加氧酶[39]。双加氧酶是多种成分所组成的酶,通常由还原酶、铁氧化还原蛋白和末端亚基加氧酶所组成[40]。在双加氧酶作用下,PAHs会转化为二氢二醇化合物,并在脱氢酶作用下生成二醇中间产物,随后通过邻位断裂途径或间位断裂途径的内环断裂双加氧酶或外环断裂双加氧酶降解,形成中间产物,如邻苯二酚,最终转变为三羧酸(TCA)循环的小分子物质[40]。而在单加氧酶作用下,可催化PAHs芳香环形成一种不稳定芳香氧化物,芳香氧化物会进一步通过一种环氧化物酶催化反应形成反-二氢二醇化合物[41]。
2.2 厌氧降解机理

同时,由于苯环数不同,PAHs初始反应也不同。如萘在厌氧条件下会在β位上发生羧基化反应[44],而在α位上会先发生甲基化反应生成1-甲基萘,1-甲基萘在引入延胡索酸后会进一步降解[45]。也有研究表明,在厌氧条件下,菲的最初反应可能是羧化作用[46]或甲基化作用[47]。此外,Liang等[32]研究发现,在厌氧条件下降解苯并[a]芘,其最初反应是甲基化作用和加氢还原作用;Qing等[33]研究发现,厌氧降解苯并[a]芘的主要反应是加氢还原作用。综上所述,在厌氧条件下不同PAHs的降解机理均不相同,因此在今后的研究中具体的厌氧降解机理还有待进一步探索。
3 PAHs降解途径
3.1 低相对分子质量PAHs的降解途径
低相对分子质量PAHs分子结构简单,水溶性较好,因此大多数微生物都能将其完全矿化。
3.1.1 萘的降解途径
(1)好氧降解
在好氧环境下,萘的生物降解包括转化为龙胆酸或邻苯二酚2种途径。首先,萘在多种酶的作用下转化为水杨酸,随后在多种酶的作用下转化为龙胆酸和邻苯二酚,最终实现降解。Narancic等[48]研究Pseudomonasp.TN301菌株时发现,龙胆酸及邻苯二酚在邻苯二酚-2,3-双加氧酶和邻苯二酚-1,2-双加氧酶等多种酶作用下逐步分解,并最终进入TCA循环。但也有研究发现,萘在降解过程中并不会通过龙胆酸进行降解,如PseudomonaaeruginosaPAO1降解萘时会产生水杨酸和邻苯二酚等中间产物,而并未产生龙胆酸[49]。细菌降解萘的一般代谢途径在以往的研究中有所报道[50]。
真菌对萘的降解也通过邻苯二酚进行。研究发现,真菌降解萘的代谢途径中,邻苯二酚在粘康酸酯化酶和羧基粘康酸环化酶等多种酶作用下进入TCA循环[51]。由此可见,无论是细菌或真菌,萘均会通过邻苯二酚途径降解。
(2)厌氧降解
在厌氧环境下,萘通过β位发生甲基化反应或羧化反应逐渐实现降解。有研究发现,在厌氧环境下未被取代PAHs最初反应机理包括羧化作用[52]、甲基化作用[53]或羟化作用[54]。Zhang等[52]通过13C对萘的降解进行示踪,发现萘的降解产物为2-萘甲酸,证明羧化反应是萘最初的激活反应,同时还发现加氢辅酶对萘的苯环进行两次加氢作用后逐渐变为较易被厌氧微生物降解利用的化合物结构。另一种途径是引入延胡索酸后的甲基化反应,随后经过脱氢酶的多次作用转化为2-萘甲酸,最终合并到2-萘甲酸降解途径中。以往的研究也指出,萘在经过甲基化反应或羧化反应后可通过加氢辅酶作用逐渐实现开环[55],可推测还原反应可能是萘的主要降解反应。同时有研究已证实,2环PAHs在降解过程中,还原反应可能会优于环的断裂反应[56]。
3.1.2 菲的降解途径
(1)好氧降解
微生物对菲的降解是通过水杨酸或邻苯二甲酸途径进入TCA循环,最终完全降解。鉴于水杨酸为萘的降解产物,因此菲的降解与萘相似。细菌降解菲的一般途径已有所报道[1]。
菲的降解可通过1,2-位、3,4-位、9,10-位进行。其中,1,2-位、3,4-位在一系列酶的作用下转化为1-羟基-2-萘甲酸,并通过1-羟基-2-萘甲醛羟化酶的作用转化为1,2-二羟萘,随后通过与萘相似的途径进行降解。利用菲和萘作为唯一碳源生长的菌株常常通过水杨酸途径降解,其中假单胞菌属、鞘氨醇单胞菌属是最常见的菌株。但近年的研究发现,其他菌株也可通过水杨酸途径降解菲,刘鑫鑫等[57]发现Burkholderiasp.FM-2菌株降解菲通过水杨酸途径进行。
9,10-位在双加氧酶作用下生成9,10-二氢二醇菲,随后在单加氧酶及其它酶催化下形成邻苯二甲酸,并在邻苯二甲酸双加氧酶、邻苯二甲酸脱羧酶等作用下转化为原儿茶酸,最终通过氧化开环进入TCA循环。气单胞菌属、产碱杆菌属、微球菌属、芽孢杆菌属、分枝杆菌属、粪产碱菌属等通过邻苯二甲酸途径进行降解。
(2)厌氧降解
在厌氧环境下,菲的降解主要是通过在苯环上多次甲基化和羟基化逐渐实现开环,由3环开环至较低环数的化合物[50]。目前国内外学者关于厌氧降解菲的研究集中于由硫酸盐还原菌(SRB)降解,其中Tsai等[58]发现,在SRB环境下,菲首先会转化为甲酚,但具体转化途径尚不明确,其次通过羟基化作用形成对羟基苯甲醇,随后通过脱氢酶、水合作用、脱羧反应形成苯酚,最终转变为乙酸,直至完全分解。该研究虽证实,菲在SRB环境下会逐渐降解,但并未解释反应激活机理。羧化作用虽作为2环和3环PAHs最初的激活机理[59],但不适于SRB环境,随着研究的不断深入,已有研究证实,羧化作用是SRB系统代谢菲的最初反应[52]。
3.2 高相对分子质量PAHs的降解途径
高相对分子质量PAHs是指4环及以上PAHs,其中苯并[a]芘是强致癌性物质,具有复杂的化学结构、较高的辛醇-水分配系数、较强的难降解特性及较低的生物可利用性,因此微生物对苯并[a]芘的降解效能不佳。郑天凌等[60]发现,细菌对苯并[a]芘的降解率最高不超过50%。目前,对于高相对分子质量PAHs主要采用共代谢方式降解。共代谢有助于为微生物生长提供大量碳源,增加微生物生长,从而加速关键酶的合成,促进高相对分子质量PAHs降解。
共代谢是通过添加共基质为微生物提供碳源促进生长,并诱导其产生降解PAHs的关键酶。如添加葡萄糖以后,Armillariasp.F02降解苯并[a]芘的速率提高了2~5 倍[61];真菌FS10-C能够将初始质量浓度为15 mg/L的苯并[a]芘降解54.0%[62]。王鸣等[63]选择苯酚、葡萄糖、乙酸钠、曲拉通(Triton X-100)4种基质及其组合作为苯并[a]芘的代谢基质,研究不同基质对苯并[a]芘降解的影响,同时考察4种易降解基质分别与萘、菲、蒽、荧蒽、芘和苯并[a]芘6种混合PAHs的共基质降解。研究表明,添加单一基质时,乙酸钠的促进作用最明显,苯酚促进效果最弱,苯并[a]芘分别能被降解39.9%和27.1%。6种PAHs存在条件下,乙酸钠的效率依然最高,萘、菲、蒽、荧蒽、芘和苯并[a]芘的降解率分别为66.1%、60.7%、43.2%、22.0%、15.5%和14.7%。综上所述,在建立共代谢体系时,一般会选择易被微生物分解利用的物质及与目标污染物结构类似的物质。因为它们不仅有利于微生物的迅速繁殖,增强微生物活性,而且选择结构类似的物质作为共基质还能诱导关键酶的产生。
3.2.1 苯并[a]芘好氧降解
环境中可降解苯并[a]芘的细菌较少,主要以假单胞菌属、分枝杆菌属、副球菌属为主。李艳秋等[64]发现,Pseudomonassp.SL-1对5mg/L苯并[a]芘的降解率为35.7%。毛健等[65]筛选出一株副球菌也能高效降解苯并[a]芘,其降解率可达到89.7%。微生物可通过4,5-位、7,8-位、9,10-位、11,12-位实现对苯并[a]芘的降解。其中,7,8-位、9,10-位形成芘的酸性化合物,4,5-位形成的酸性化合物,11,12-位形成环氧化物。苯并[a]芘首先在双加氧酶和脱氢酶作用下形成顺-二醇化合物,随后在其它酶的作用下使苯环断裂,并转化为芘和的酸性化合物以降低苯并[a]芘的毒性。但关于其衍生物的毒性是否强于苯并[a]芘仍有待进一步确认。图1 为细菌降解苯并[a]芘的一般途径[66]。

图1 细菌降解苯并[a]芘的一般途径[66]Fig.1 General pathways for benzo[a]pyrene degradation by microorganism
3.2.2 苯并[a]芘厌氧降解
低相对分子质量PAHs在降解过程中可通过还原反应实现降解,而关于高相对分子质量PAHs是否会通过还原反应实现降解尚未知。近年的研究充分证明,还原反应也可作为苯并[a]芘最初的激活反应。Liang等[32]发现,在厌氧环境下,苯并[a]芘的最初反应是甲基化反应和还原反应。Qing等[33]也发现,苯并[a]芘在厌氧降解过程产生的H2能使PAHs发生还原反应。
目前关于厌氧降解苯并[a]芘菌株的研究集中于假单胞菌属和微杆菌属,图2为假单胞菌菌株JP1降解苯并[a]芘的一般途径。苯并[a]芘首先通过甲基化反应、还原反应使苯环断裂,随后在脱甲基作用下形成苯并[a]蒽和,最终经过甲基化反应形成蒽和菲。由于蒽的γ位比α、β位活泼,因此γ位会由于α、β位发生脱氢作用转化为9,10-蒽醌。
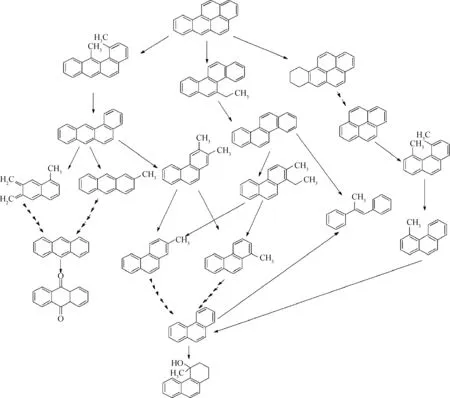
图2 假单胞菌菌株JP1厌氧降解苯并[a]芘[32]Fig.2 Proposed pathways for anaerobic degradation of benzo[a]pyrene by Pseudomonas JP1[32]
图3为微杆菌菌株CSW3在反硝化条件下降解苯并[a]芘的一般途径。苯并[a]芘通过还原反应使苯环断裂形成芘和,芘在甲基化反应和酶的作用下形成4,5-二甲基菲、4-甲基菲和菲。在一系列酶的作用下转变为萘,随后通过羟基化作用、还原反应及酶作用下逐渐降解。
研究结果显示,苯并[a]芘在厌氧环境下的激活反应与降解菌并无直接联系,都可通过还原途径实现苯环断裂,均以菲为主要中间产物进行降解,后续降解出现差异性是否与降解菌特性有关,有待进一步研究。此外,苯并[a]芘在好氧微生物作用下,其降解产物以芘和的酸性化合物为主。由此可推测,厌氧微生物对苯并[a]芘的降解效能优于好氧微生物。

图3 在反硝化条件下微杆菌菌株CSW3厌氧降解苯并[a]芘的途径[33]Fig.3 Proposed pathways of benzo[a]pyrene degradation by Microbacterium CSW3 under nitrate-reducing condition[33]
4 结论与展望
微生物是去除环境中PAHs的最有效且廉价的手段。目前,国内外学者对PAHs降解研究主要集中于降解机理及降解菌种等方面。但研究往往存在局限性,单一菌种只有在特定环境下对某些特定的PAHs具有较好的降解效能。其并不能有效解释PAHs在环境中的迁移转化途径,因为环境中PAHs和微生物具有多样性特点,各菌株及降解产物在降解过程中会呈现协同作用或抑制作用。虽然共代谢方式可以增加碳源促进微生物生长及关键酶的合成,但目前所选用的共基质均为易分解物质,且种类较少。因此深入分析能与高相对分子质量PAHs进行共代谢的底物、探索PAHs降解机理、分析共代谢产生的关键酶,对于指导共代谢降解PAHs具有重要意义。
但当前的研究仍存在不足之处,为此今后的研究方向包括:(1)微生物修复虽能降低PAHs毒性,但修复过程中可能会产生毒性更强的产物,因此在今后的研究中应进一步分析产物毒性效应,并解释PAHs解毒机理。(2)分析产甲烷菌降解PAHs的初始反应,并以不同PAHs作为碳源,观察产甲烷菌的变化,研究某些PAHs是否会对产甲烷菌产生抑制作用,同时通过宏基因技术确定产甲烷菌降解PAHs的相关功能基因,以便于鉴定产甲烷菌功能菌株。

