五味子中山葡萄HPLC指纹图谱的建立及其伪品鉴别
干建伟, 胡 敏, 钱广生, 韦 婷
(1.四川大学华西药学院,四川成都 610041;2.华润三九 (雅安)药业有限公司,四川雅安 625000)
五味子为木兰科植物五味子Schisandra chinensis(Turcz.)Baill.的干燥成熟果实,习称北五味子。秋季果实成熟时采摘,晒干或蒸后晒干,除去果梗和杂质。作为一种传统中药,它具有收敛固涩、益气生津、补肾宁心。临床用于久嗽虚喘、梦遗滑精、遗尿尿频、久泻不止等症[1]。在对五味子药材的质量检查中发现有部分样品存在伪品,常见的为南五味子。文献主要对北五味子和南五味子物质成分对比,建立高效液相色谱进行鉴别[2-8],主要是南五味子和北五味子中木脂素成分存在较明显的差异,同时还发现在南五味子和北五味子中有其他类别伪品[9-12]。在检验中首次发现另一类伪品,研究表明该伪品与文献所描述的山葡萄类似[13]。 《中国药典》中对五味子原料杂质比例可接受范围为1%,经检验发现该类伪品的比例在2%~4%,且难以发现及挑选,为了保证用药安全,对该伪品五味子进行高效液相色谱鉴别。
1 仪器与材料
1.1 仪器 Agilent 1260高效液相色谱仪 (美国Agilent公司);岛津UV-2600紫外-可见分光光度仪 (日本岛津公司);奥林巴斯BX43/DP26显微镜 (日本奥林巴斯公司);BS244S电子天平 (德国赛多利斯公司);XFB-200高速中药粉碎机 (吉首市中诚制药机械厂)。
1.2 试剂 乙腈 (色谱纯,德国Merk公司);无水乙醇、水合氯醛 (分析纯,成都市科隆化学品有限公司);超纯水。
1.3 材料 五味子对照药材购自中国食品药品检定研究院 (批号120922-201610);五味子购于同仁堂 (批号20150901、20150902、20150903), 经华润三九 (雅安)药业有限公司唐莉副总工程师鉴定为木兰科植物五味子Schisandra chinensis(Turcz.)Baill.的干燥成熟果实;五味子 (批号161001、 161002、 161003、 161004、 161005、161007、 161008、 161009、 161010), 购买于吉林市场,从其中挑选出五味子伪品。山葡萄采自东北野外,经副总工程师唐莉鉴定为葡萄科葡萄属植物山葡萄Vitis amurensis Rupr.的干燥成熟果实。
KM小鼠 [清洁级,来源于四川省医学科学院(四川省人民医院实验动物研究所),动物合格证编号 SCXK [111]2013-15]。
2 方法与结果
2.1 鉴别
2.1.1 性状
2.1.1 .1 五味子 本品呈不规则的球形或扁球形。表面暗红色,皱缩,略显干瘪;有的表面出现“白霜”。果肉较少,种子1~2粒,肾形,表面棕黄色、有光泽,种皮薄而脆。
2.1.1 .2 山葡萄 本品呈不规则椭圆形。表面棕红色、皱缩、略有光泽。果肉薄而软,内含种子4~5粒,相互抱合成近球形,种子之间被果肉隔开;种子黄棕色,种仁白色呈油性,倒卵圆形,基部有短喙,种脐在种子背面中部呈椭圆形,腹面中棱脊微突起,两侧洼穴狭窄呈条形,向上达种子中部或近顶端。
2.1.1 .3 伪品 与山葡萄性状一致。掺伪北五味子药材性状图,见图1,油润五味子、干瘪五味子、伪品、山葡萄果实及种子性状比较图,见图2。

图1 掺伪北五味子药材性状Fig.1 Adulteration of S.chinensis

图2 真伪品五味子药材及其种子性状鉴别Fig.2 Identification of S.chinensis and its seed characters
2.1.2 显微鉴别
2.1.2.1 供试品粗粉制备 取五味子伪品,在60℃以下烘烤约2 h,取出放入干燥器内,约1 h(放至室温)后取出,立即粉碎成粉,过4号筛,混合均匀。
2.1.2.2 对照药材粗粉制备 取五味子对照药材,按 “2.1.2.1”项下方法制备。同法制备山葡萄粗粉。
2.1.2.3 鉴别 取对照药材和供试品粉末,按照显微鉴别2015年版 《中国药典》四部2001要求制片、检查。
五味子种皮表皮石细胞表面观呈多角形或长多角形,壁厚,孔沟极细密。种皮内层石细胞呈多角形、类圆形或不规则形。果皮表皮细胞表面观类多角形,垂周壁略呈连珠状增厚,表面有角质线纹,见图3。

图3 五味子粉末Fig.3 Powder of fruit from S.chinensis
山葡萄果皮表皮细胞表面呈类多角形、类方形,种皮表皮细胞数列类圆形,种皮表皮下石细胞表面呈类长方形、类方形,壁薄,具极细密的孔沟及纹孔,见图4。

图4 山葡萄粉末Fig.4 Powder of fruit from V.amurensis
伪品显微鉴别结果与山葡萄一致,见图5。
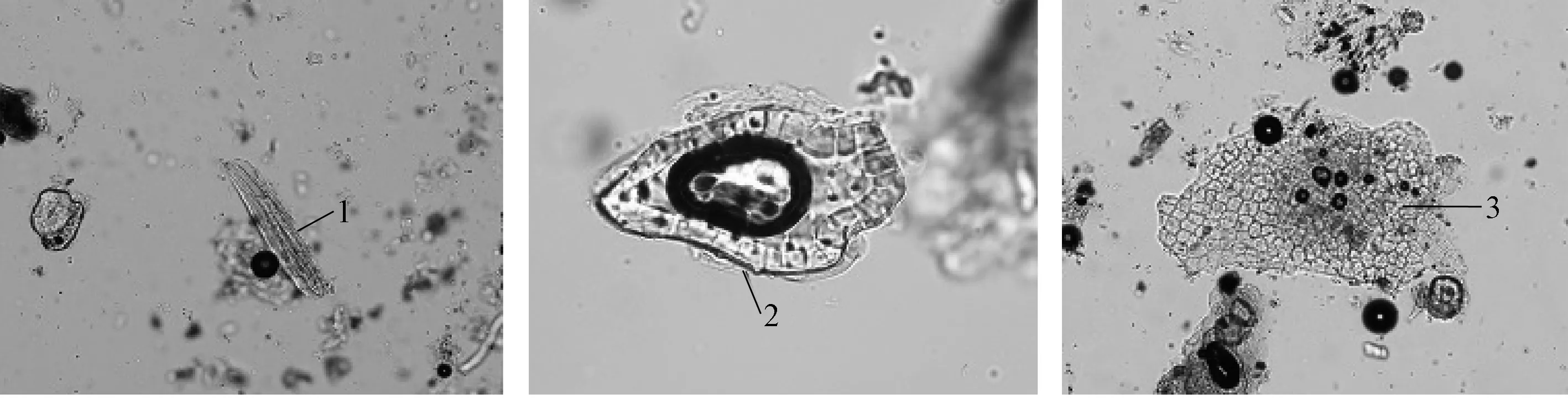
图5 伪品粉末Fig.5 Powder of fruit from counterfeit
2.1.3 紫外鉴别
2.1.3.1 供试品溶液制备 取五味子伪品粉末(过4号筛)2.0 g,置于锥形瓶中,加100 mL纯化水煎煮120 min,过滤,取滤液5 mL,稀释8倍,搅匀即得。
2.1.3.2 对照溶液制备 取五味子对照药材粉末(过4号筛)2.0 g,按 “2.1.3.1”项下方法制备,即得。同法制备山葡萄对照溶液。
2.1.3.3 紫外检测 取供试品和对照溶液,按照紫外分光光度法2015年版 《中国药典》四部0401检查185~500 nm处紫外吸收,五味子于210 nm处有1个较高吸收峰值;伪品于200、320 nm处有较高吸收峰值;山葡萄于208、320 nm处有较高吸收峰值,五味子与山葡萄、伪品存在较大的紫外吸收差异,伪品与山葡萄紫外吸收基本一致,见图6。
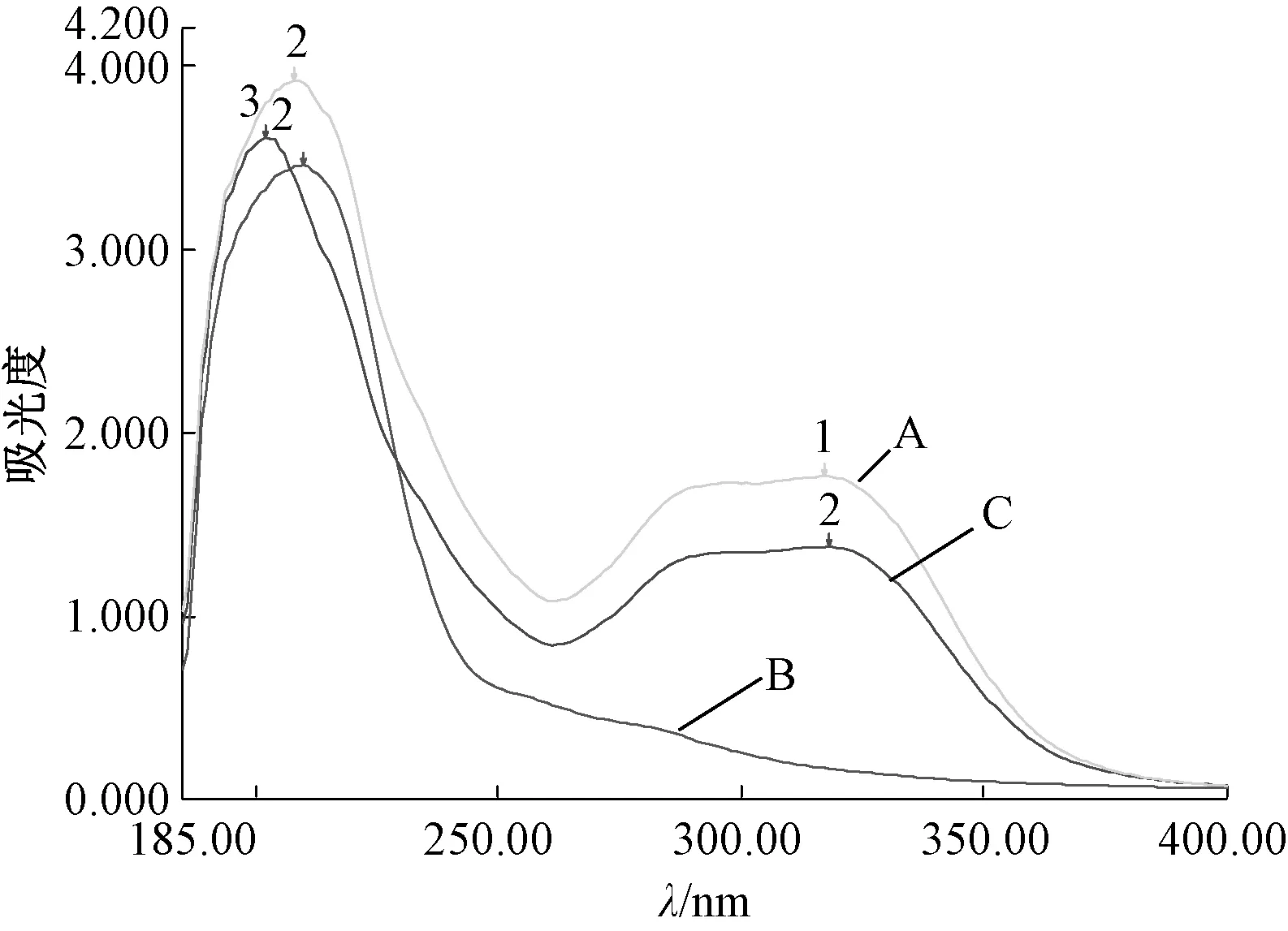
图6 各样品紫外光谱图Fig.6 UV spectrogram of various samples
2.2 高效液相色谱鉴别
2.2.1 色谱条件 Waters symmetry shieldTMRP18色谱柱 (4.6 mm×250 mm, 5.0 μm); 流动相乙腈(A) -水(B), 梯度洗脱 (0~10 min, 10%A; 10~20 min, 10% ~15%A; 20~65 min, 15% ~60%A;65~80 min, 60%A; 80~90 min, 60% ~80%A;90~100 min,80%~100%A);柱温30℃,进样量10 μL; 体积流量1.0 mL/min; 检测波长210 nm。
2.2.2 对照溶液制备 精密称定五味子粉末 (过4号筛)2.0 g,置于锥形瓶中,加入100 mL纯化水煎煮120 min,过滤,滤液浓缩至10 mL,加入40 mL无水乙醇,搅匀后过滤,挥去部分乙醇转移至量瓶中,定容至 10 mL。摇匀后,取溶液过0.45 μm微孔滤膜,收集滤液即得。
2.2.3 供试品溶液制备 精密称定五味子伪品粉末 (过4号筛)2.0 g,按 “2.2.2”项下方法制备供试品溶液。
2.2.4 方法学考察
2.2.4.1 精密度试验 取伪品样品 (批号161001)粉末按 “2.2.2”项下方法制备供试品溶液,在 “2.2.1”项条件下连续进样6次,测得各共有峰相对保留时间RSD 0.14%~1.36%,相似度均大于0.999,表明仪器精密度良好。
2.2.4.2 重复性试验 取伪品样品 (批号161 0 01)粉末,混匀,精密称取粉末 1.6、2.0、2.4 g各3份,按 “2.2.3”项下方法制备供试品溶液,在 “2.2.1”项条件下进样检测,测得各共有峰相对保留时间的RSD 0.78%~1.05%,相似度均大于0.989,表明该方法重复性好。
2.2.4.3 稳定性试验 取伪品样品 (批号161001)粉末,混匀,精密称取粉末 2.0 g,按“2.2.3”项下方法制备供试品溶液,在 “2.2.1”项条件下,分别于 0、1、3、6、12、24 h进样,测得各共有峰相对保留时间的RSD 0.64%~1.36%,相似度均大于0.999,表明供试品溶液在24 h内稳定性良好。
2.2.5 指纹图谱建立及评价 取伪品样品及五味子各10批,按 “2.2.2”及 “2.2.3”项下方法制备对照溶液及供试品溶液,在 “2.2.1”项条件下,进样分析,见图7~8。伪品在80 min内有10个峰为共有峰,其面积占所有色谱峰面积的92.0%以上。经中药色谱指纹图谱相似度评价系统[14]分析,相似度均在 0.90以上。五味子在80 min内有11个峰为共有峰,与伪品的指纹图谱完全不同。

图7 10批伪品HPLC指纹图谱Fig.7 HPLC fingerprint of ten batches of counterfeit

图8 10批五味子HPLC指纹图谱Fig.8 HPLC fingerprint of ten batches of S.chinensis
2.2.6 伪品鉴别 取伪品样品,按照1%、2%、3%比例加入五味子中,按 “2.2.3”项下方法制备供试品溶液,在 “2.2.1”项条件下,进样分析,指纹图谱中2号特征峰为伪品中特有的成分,能够通过2号特征峰显著区别五味子中是否存在伪品,而且随着伪品比例增加峰面积增加,见图9~11。
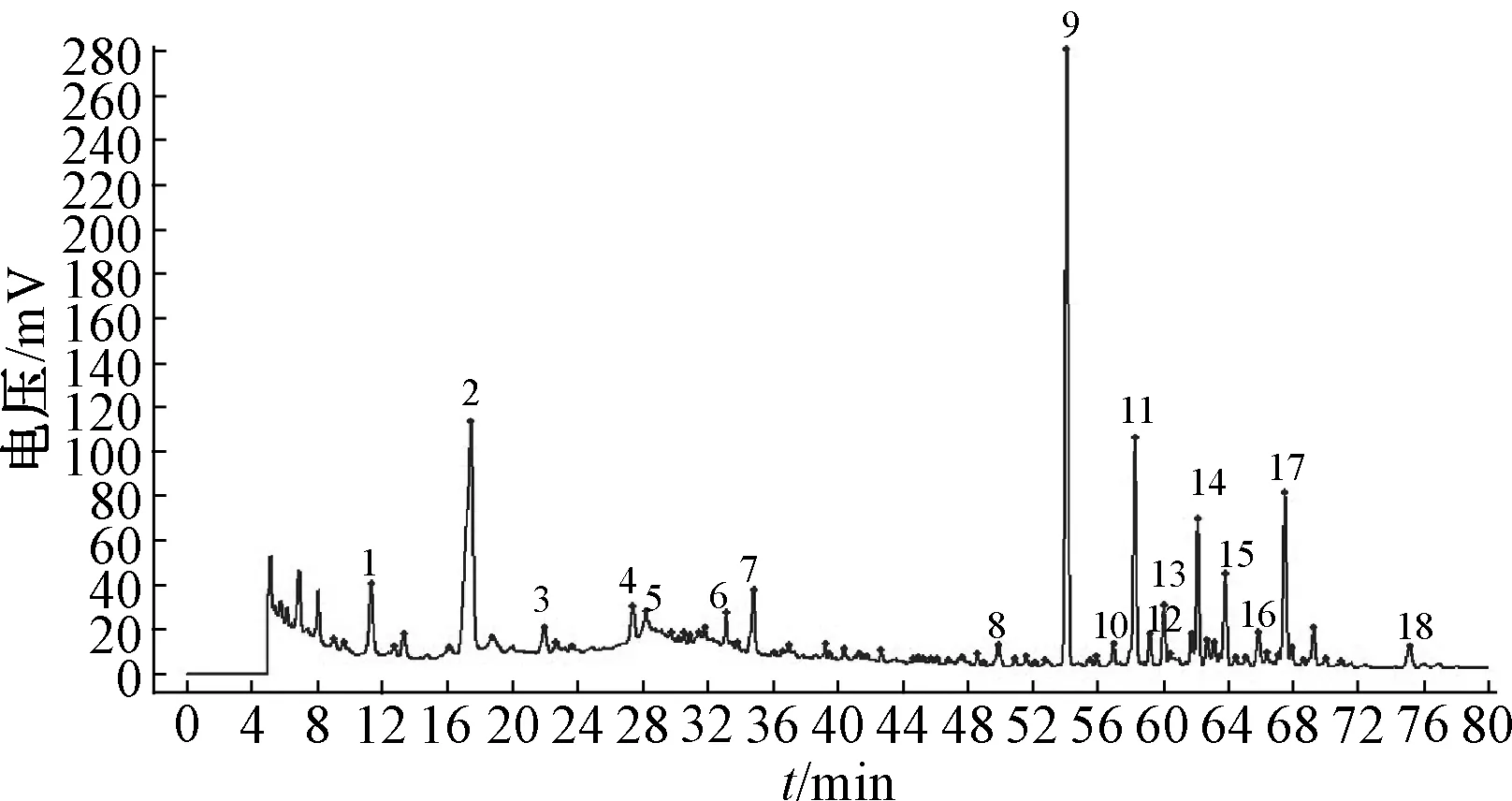
图9 1%伪品五味子HPLC色谱图Fig.9 HPLC chromatogram of S.chinensis of 1%counterfeit

图10 2%伪品五味子HPLC色谱图Fig.10 HPLC chromatogram of S.chinensis of 2%counterfeit

图11 3%伪品五味子HPLC色谱图Fig.11 HPLC chromatogram of S.chinensis of 3%counterfeit
2.3 异常毒性分析
2.3.1 异常毒性检测方法 取清洁级KM小鼠5只,3只雄性2只雌性,体质量18~22 g。每只小鼠分别给予静脉注射供试品溶液0.5 mL,在4~5 s内匀速注射完毕。全部小鼠在给药后48 h内不得有死亡;如有死亡,应另取体质量19~21 g的小鼠10只复试,全部小鼠在48 h内不得有死亡。
2.3.2 五味子中伪品占比较高时异常毒性
2.3.2.1 对照溶液制备 取五味子780 g按照生脉注射液提取工艺制备[15],煎煮3次,每次加入3 L纯化水,煎煮40 min。将煎煮液浓缩至比重1.19~1.20,用乙醇醇沉2次,第1次使醇度达到80%,第2次使醇度达到85%,过滤,调pH近中性,回收乙醇,加入3%活性炭煮沸30 min后脱炭。将五味子液分别按照五味子质量浓度0.156、0.234、 0.312、 0.390 g/mL 配制成对照溶液,100℃,35 min灭菌。
2.3.2.2 供试品溶液制备 取五味子437 g和五味子伪品343 g,按 “2.3.2.1”项下方法制成供试品溶液。
2.3.2.3 异常毒性检测 取对照溶液及供试品溶液,按 “2.3.1”项下方法检测异常毒性,未见小鼠死亡,但五味子伪品异常毒性高于五味子。见表1。

表1 含伪品与五味子异常毒性结果Tab.1 Results of abnormal toxicity for S.chinensis and counterfeit
2.3.3 1%、2%、3%五味子伪品异常毒性比较 取五味子780 g,按照 “2.3.2.1”项下方法制备成 0.156 g/mL对照溶液。分别取五味子772.2 g、五味子伪品7.8 g,五味子764.4 g、五味子伪品15.6 g,五味子756.6 g、五味子伪品23.4 g,按照 “2.3.2.1”项下方法制备成0.156 g/mL供试品溶液。
取对照溶液及供试品溶液检测异常毒性,结果发现伪品比例较低时异常毒性与五味子无显著差异。见表2。

表2 含五味子伪品1%、2%、3%样品异常毒性结果Tab.2 Results of abnormal toxicity for 1%,2%and 3%counterfeit samples
3 讨论
3.1 伪品分析 通过粉末显微比较研究,发现伪品与五味子药材之间差异明显,外观性状方面与干瘪型五味子较相似,与油润性五味子差异较大。伪品的性状、显微鉴别与山葡萄一致,由此可确证五味子的此种伪品为葡萄科葡萄属植物山葡萄的干燥成熟果实。经调查发现,该山葡萄在青果时采摘晾干,被混入野生干瘪型五味子中,由于家种五味子采摘后性状为油润型,性状差异与野生五味子有较明显差异,暂未发现有山葡萄混入。
3.2 小结 本研究对伪品山葡萄的异常毒性进行了评价,在山葡萄比例加入到接近50%时略有毒性反应加强的现象,而在3%以内均未发现异常毒性加强,表明现有掺入比例对产品的异常毒性暂未出现显著影响,临床使用暂不能评价,应注意随着五味子价格上涨引起伪品掺入比例增加。
现阶段在干瘪类五味子中发现掺杂伪品,而油润型的五味子中暂未发现该类伪品,建立的高效液相色谱指纹图谱分析方法可通过特征峰确定是否有山葡萄加入,方法灵敏有效,可有效控制伪品的加入,用于五味子的质量控制。

