阿尔茨海默病的tau蛋白病理传播机制与调节*
李思苹, 李文惠,孙安阳△
(1上海理工大学医疗器械与食品学院, 2上海健康医学院脑退行性疾病重点实验室, 上海 201318)
阿尔茨海默病(Alzheimer’s disease,AD)是一种以进行性认知功能减退为典型表现的神经退行性疾病,其标志性病理特征之一是神经纤维缠结形成。八十年代的研究揭示,神经纤维缠结的主要成分是微管相关蛋白tau。AD患者脑中tau蛋白过度磷酸化导致其与微管结合能力降低,磷酸化的tau蛋白聚集形成细胞内的神经纤维缠结,干扰神经元的正常功能,并最终导致神经元的变性与死亡。早期研究主要关注神经纤维缠结在体外和单个细胞水平形成的机制、不同脑区的发展变化次序与功能意义,并未涉及不同细胞之间的病理联系。近年来研究发现,tau蛋白异常而形成的病理分子并非只有神经纤维缠结一种,还有其它不同的分子形式(如tau寡聚体)与病理状态,这些tau蛋白异常统称为tau病理(tau pathology)。后期还发现,tau蛋白具有和朊病毒(prion)类似的特性,可以在大脑不同功能区之间进行传播[1]。目前认为,病脑内先是一小部分细胞产生了tau蛋白聚集物,然后通过某些机制再传播到邻近或较远的正常细胞,最终导致大量的tau病理形成和神经元变性,造成严重的神经功能障碍。随着近几年对tau病理传播研究的逐步深入,将为AD的发病机制以及干预策略提供新的思路。
1 Tau蛋白的亚型与基本功能
Tau蛋白是一种微管相关蛋白,正常状态下主要定位于神经元轴突,主要功能是促进微管的形成和维持微管的稳定。生理状态下,位于树突的tau蛋白水平极低;人脑的tau蛋白在额叶、颞叶、海马和内嗅皮层等脑区水平较高,并具有高度可溶性和热稳定性。Tau蛋白长度因mRNA加工时外显子2、3和10的可变剪接(或称选择性剪接)而异,依据N端插入序列(0N/1N/2N)的数目以及微管结合重复区(3R/4R)的数目不同,将tau蛋白分为6种亚型[2]。以最长的2N4R tau为例,虽然理论上可有84个磷酸化位点,但正常成熟脑内平均仅有数个生理性磷酸化位点,负性调节tau蛋白与微管的结合。然而,在特定病理状态下,tau蛋白高度异常的磷酸化位点很多,已报道的病理性磷酸化位点已经达到40个左右。大量实验资料显示,不同亚型tau蛋白的生理和病理表现存在显著差异。
2 Tau病理传播的现象与特征
早在1991年,Braak等[3]对AD患者大脑病理解剖时观察到,神经纤维缠结一般先出现在内嗅皮层及其周边区域,随后可以在海马和杏仁核等位置观察到,最后会广泛地分布在大脑中。直到2009年,Frost等[4]首次提出病变tau蛋白会以某种机制在大脑各区域之间进行传播,并观察到外部tau蛋白进入细胞内后会引起内部原有tau蛋白的聚集,这一发现引起了研究人员对tau病理传播的关注。在随后几年中,各种体外实验发现,磷酸化tau蛋白可以在细胞间进行传播,并可以通过突触在神经元间进行传递[5-7];在体内实验中,Liu等[8]通过对比不同月龄小鼠脑部磷酸化tau蛋白的分布,观察到tau蛋白可以传播到有神经投射的2个脑区。Ahmed等[9]向2月龄P301S-tau转基因小鼠左侧海马及上方大脑皮层/白质注射含tau聚集体的转基因小鼠脑提取物,2周后观察到神经纤维缠结病理开始形成,随着时间的推移,tau病理蛋白数量不断增加,并传播到了对侧半脑与注射点有突触连接的亚区,而非注射点邻近的脑区。Tau蛋白病理传播这一现象也在人脑中观察到,DeVos等[10]通过对不同分期的AD患者脑组织的研究分析发现,tau病理蛋白早期也沿着有突触连接的神经元传播,病理分布与Braak分期的脑区发展路径一致。虽然所有tau蛋白亚型都可以在神经元之间传播,但不同tau蛋白分子在传播速率和特性上有一定差别,例如,4R tau产生的tau病理可以传播到较远的脑区,而3R tau和突变tau产生的tau病理大多停留于病理初始形成部位,而不会传播到其它较远的脑区[11]。
3 Tau病理蛋白作为“种子”传播的形态
Tau蛋白高度可溶,对于加热和酸处理十分稳定。溶液中的tau蛋白并不折叠成已知的二级结构,而呈“无规卷曲”的结构;但在与微管结合的过程中,tau蛋白将折叠成稳定的构象[12]。病理性tau蛋白在聚集与纤维化过程中,一部分微管结合重复区转变为刚性的β折叠结构,构成神经纤维缠结的核心,而其余区域仍保留未折叠状态,构成tau纤维的绒毛状外衣[2]。Tau蛋白易于产生错误折叠(misfolding)。与朊病毒部分相似,错误折叠的tau蛋白可以充当“种子”使正常tau蛋白也错误折叠。此外,肝素可以促进惰性的tau单体向“种子”转变,进而聚集更多的tau分子[13]。
细胞生物学研究显示,tau的三聚体是最小的可传播“种子”,tau聚合物与细胞表面的硫酸肝素蛋白多糖(heparan sulfate proteoglycans,HSPGs)结合后被细胞摄入,再作为“种子”引起细胞内tau聚集[14]。将不同生化特性的病理性tau蛋白作为“种子”注射至P301S-tau转基因小鼠脑内可产生各不相同的神经病理表型[15],因而认为,tau蛋白的结构差异决定各自的“种子”活性。
4 Tau病理传播途径
在神经元没有发生细胞死亡和膜渗漏的情况下,病理性tau蛋白也可从细胞中释放出来,被受体细胞内吞,其中错误折叠的tau分子作为“种子”使正常tau蛋白也发生错误折叠,导致tau病理在细胞间传播。细胞间释放与摄取病理性tau蛋白涉及依赖于ATP的囊泡机制与直接的非囊泡机制,见图1。
4.1病理性tau蛋白的囊泡释放 有研究发现当细胞过度表达tau蛋白时,可通过囊泡方式将其释放出来[16]。Saman等[17]对人类神经瘤母细胞M1C进行培养,通过减少培养皿中四环素以诱导细胞表达tau蛋白,在免疫电镜及生化实验中观察到磷酸化tau蛋白位于细胞内的多泡体(multivesicular body)中,以外泌体(exosomes)形式释放至细胞外。Wang等[18]培养小鼠神经瘤母细胞N2A及大鼠皮层神经元,通过微流体设备检测到神经元通过外泌体释放tau蛋白。此外,Dujardin等[19]对大鼠皮层神经元及N1-E115细胞进行培养,观察到tau蛋白也可以通过细胞膜出芽包裹在微泡(ectosomes)内,而后释放到细胞外。AD早期患者脑脊液中磷酸化tau蛋白含量较高也有很大可能与此相关。
4.2病理性tau蛋白的胞吐释放 Michel等[20]在实验中观察到,tau寡聚体可以被溶酶体摄取,推测tau蛋白可以通过胞吐作用(exocytosis)被细胞释放。Fontaine等[21]观察到,上调DnaJ50/Hsc70蛋白的表达可以促进tau蛋白的释放,而通过小干扰RNA(small interfering RNA, siRNA)抑制胞吐释放关键蛋白SNAP-23的表达,会使DnaJ50过度表达的细胞中tau蛋白释放量减少,表明tau蛋白可以通过SNAP-23介导的胞吐方式被细胞释放。胞吐释放的tau蛋白在细胞外无囊泡包裹。
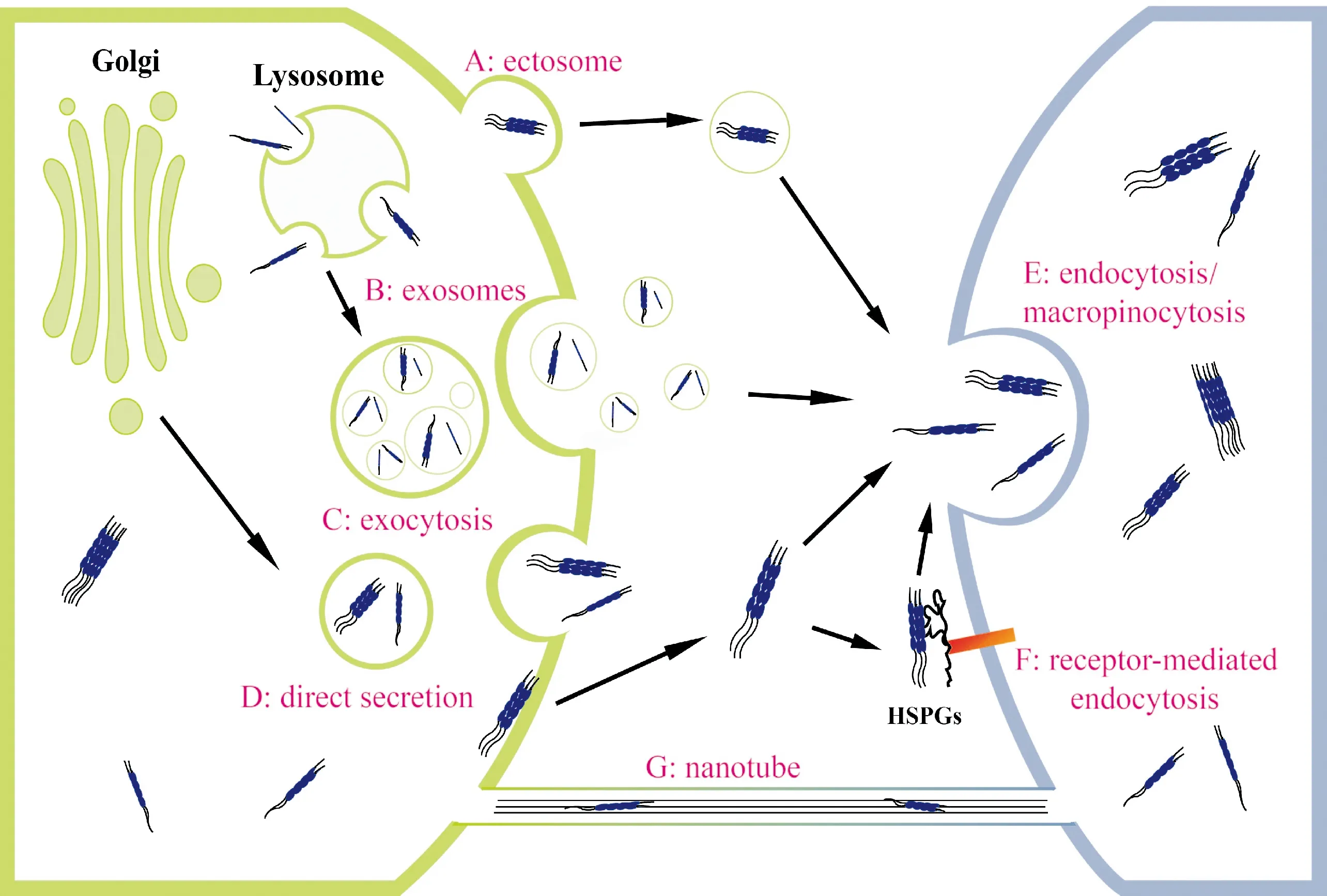
Figure 1.Potential mechanisms for neuron-to-neuron transmission of tau aggregates. Tau aggregates are released via a mechanism of ectosomes (A), exosomes (B), exocytosis (C) and direct secretion (D). The uptake of tau aggregates takes place by recipient neuron through endocytosis /macropinocytosis (E), and receptor-mediated endocytosis (F). Neuron-to-neuron transmission of pathological tau aggregates is also mediated through tunneling nanotubes (G).
图1Tau聚集体在神经元之间传播的主要机制
4.3病理性tau蛋白的直接分泌 Merezhko等[22]通过小鼠神经瘤母细胞N2A和大鼠皮层神经元原代培养实验观察到,过表达的tau蛋白以磷酸化寡聚物的形式聚集在质膜微区内,并以无囊泡形式分泌;这一非常规的过程不需要ATP,但对膜特性的改变(如胆固醇和鞘磷脂含量变化)非常敏感。细胞表面硫酸肝素糖蛋白可能通过促进病理性tau蛋白穿膜后释放而易化tau蛋白的分泌。这种不依赖ATP的直接释放方式可能使病理性tau蛋白从神经元逃逸变得更加便捷。
4.4病理性tau蛋白的摄取 生理性和病理性tau蛋白可以通过非受体介导和受体介导的内吞(endocytosis)进入细胞。内吞的种类与机制比较复杂,大致包括网格蛋白依赖性与网格蛋白非依赖性2种,传统的内吞不依赖于肌动蛋白(actin)。Michel等[20]使用活细胞聚集传感器检测到,荧光标记的外源性tau蛋白单体可被SH-SY5Y细胞以内吞的方式快速摄取,在pH较低的内小体房室聚集形成病理性种子,进而诱导内源性tau蛋白参与聚集;利用超分辨率成像技术还证实,这种内源性和外源性tau蛋白组成的纤维性种子可以再从细胞中释放出来,实现tau蛋白病理传播的进出环节。
巨胞饮(macropinocytosis)是内吞的另一种形式,由肌动蛋白驱动细胞膜皱褶形成,产生大的细胞内液泡,直径一般为0.5 μm~5 μm。巨胞饮参与清除凋亡细胞、免疫反应和更新细胞膜等细胞功能。Holmes等[23]通过免疫荧光标记tau蛋白聚集体,发现C17.2小鼠神经干细胞是通过巨胞饮机制摄取tau蛋白聚集体。然而,Evans等[24]在人类神经干细胞实验中观察到与前期报道不同的结果。细胞外tau蛋白单体和聚集体均可被人类神经元快速高效地摄取,tau蛋白单体通过快速的动力蛋白依赖性内吞和缓慢的肌动蛋白依赖性巨胞饮进入神经元;tau蛋白聚集体进入人类神经元不依赖于肌动蛋白,这一特点符合传统的内吞,而不符合巨胞饮机制。也有实验报道,tau蛋白可以与受体(如HSPGs和APP)结合,而被接受细胞所摄取[25]。因而,细胞摄取tau蛋白的机制既取决于tau蛋白的分子种类,也存在种属和细胞类型差异。
4.5经隧道纳米管(tunneling nanotubes,TNTs)传播 隧道纳米管是一种细胞间通道,这种细胞间动态的结构可以持续几分钟到几个小时不等,直径一般在20 nm~500 nm之间[26],对于细胞之间的物质传输尤其是距离较远的细胞具有重要作用。研究人员通过荧光显色对tau蛋白在体外培养细胞间的分布进行观察,在细胞间的隧道纳米管中发现了tau寡聚体的存在,说明tau寡聚体可以通过隧道纳米管在细胞间进行传播[27]。另外,tau蛋白也会影响隧道纳米管的形成和功能,细胞外加入tau蛋白聚集体将促进神经元之间隧道纳米管的形成[28],两者之间起到相互促进的作用。
5 Tau病理传播的调控因素
Tau蛋白传播受到很多因素的影响,通过研究影响tau病理传播的调控因素,可以找到抑制tau病理传播的方法,减轻tau病理对AD的影响。
5.1β-淀粉样蛋白(amyloid β-protein, Aβ)对tau蛋白病理传播的影响 研究人员选用APPsw/PS1dE9转基因小鼠与内嗅皮层表达病变tau蛋白的rTgTauEC小鼠杂交后代作为实验组小鼠,并在小鼠10个月龄和16个月龄时观察tau病理传播,发现与仅在内嗅皮层表达tau蛋白的对照组小鼠相比,实验组小鼠在海马DG区和CA1区tau蛋白的表达更多,证明了大脑皮层中的Aβ加速了tau蛋白的传播[29]。向5xFAD转基因小鼠的海马和大脑皮层注射来源于AD患者的配对螺旋样纤维(paired helical filament, PHF)-tau,Aβ病理通过促进AD tau的种子活性,加速神经毡类斑块内tau的聚集,从而促进tau病理传播[30];另一组研究通过体外和在体实验也观察到,聚集前的Aβ“种子”可以交叉激活“沉默的”tau“种子”,加速tau蛋白聚集与tau病理形成[31]。另有离体研究显示,正常培养的神经细胞主要释放C末端被酶切的tau片段(不含微管结合区),不具有tau传播活性,仅在加入Aβ引起神经细胞损伤后,才释放含有微管结合区的可聚集tau[32]。
5.2Tau病理传播随神经元运动活动增强 Tau蛋白和Aβ作为AD的2大关键特征,具有一定的相似性。在之前的实验中发现,Aβ数量会随着神经元活性增强而增加[33],故提出tau病理传播是否也会随神经元活性增强而增加这一问题。Wu等[34]在体外实验中,用GABAA受体拮抗剂印防己毒素持续刺激神经元以增加其兴奋性,同时观察到神经元的tau蛋白释放量明显增加。在体内实验中,通过光遗传学或化学遗传学技术刺激rTg4510转基因小鼠的海马神经元,也观察到了类似的结果,说明tau病理传播会随神经元活动增强而增加。
5.3小胶质细胞通过外泌体途径促进tau传播 Asai等[35]通过向小鼠内嗅皮层注射AAV-GFP/tau构建tau传播至齿状回的实验模型,另外用P301S-tau转基因小鼠作为平行验证。通过侧脑室注射氯膦酸二钠脂质体或喂饲PLX3397(CSF-1R抑制剂)清除小鼠脑内小胶质细胞后,内嗅皮层向齿状回tau蛋白的传播受到明显抑制。此外,小胶质细胞促进tau传播作用可能是通过外泌体途径发挥作用的,因为经RNA干扰或药物GW4869抑制鞘磷脂酶2 (sphingomyelinase-2)活性以抑制外泌体合成后,也可显著抑制tau病理传播。
5.4上调星型胶质细胞溶酶体活性抑制tau传播 不同神经元可经过突触传播tau病理,而星形胶质细胞则位于神经突触的周围。培养的星形胶质细胞表达外源性转录因子EB将促进tau纤维的摄取和溶酶体活性;在体诱导星形胶质细胞表达转录因子EB则降低P301S-tau转基因小鼠(PS19小鼠)海马的病理,并显著减弱了tau蛋白从同侧向对侧海马的扩散[36]。另外,培养的原代神经元通过亮抑蛋白酶肽(leupeptin)抑制溶酶体功能,使神经元分泌的磷酸化tau蛋白量和tau蛋白总量也明显增加[37]。
6 总结及展望
Tau蛋白异常形成tau病理是阿尔茨海默病的关键特征之一。病理性tau蛋白具有朊病毒样特性,可以在不同神经元和脑区之间传播。已有多个研究揭示,tau病理的远程传播主要发生在有突触连接的2个脑区之间。生理状态下脑内tau蛋白主要位于神经元轴突,也以pM级浓度存在于细胞间液中;在特定病理状态下细胞间液的浓度可升高10倍以上。虽然正常tau单体分子能否进入神经元目前资料尚不一致,但病理性tau聚集物能够高效地进入神经元或非神经细胞已经被大量实验所证实。含tau病理的神经元通过外泌体、胞吐或直接释放等机制将tau病理“种子”释放到胞外,被另一个神经元通过内吞或巨胞饮等方式摄入,从而实现tau病理传播的出进环节。进入神经元的tau病理“种子”继续聚集内源性tau单体及其他分子,最终形成神经纤维缠结。已有人建立超灵敏的方法检测tau病理的“种子”活性(seeding activity),以反映tau病理传播的体内状况,希望可用作AD辅助诊断和追踪疗效的手段之一。Tau病理传播的程度也会受到胞外Aβ水平、神经元兴奋性以及小胶质细胞等因素的调节。通过深入研究疾病状态下tau病理传播途径及关键调控因素,人们希望找到阻遏tau病理传播的关键靶点,从而研发出治疗阿尔茨海默病的有效药物。
目前,对于tau病理传播的分子细节和临床意义尚有许多不明确之处,例如,疾病状态下脑内tau病理传播与离体实验的情况是否类似?Tau病理传播对相关疾病如AD和额颞叶痴呆的认知障碍的贡献度有多大?有哪些可成为有潜力阻遏tau病理传播的潜在靶点?叶酸、维生素B12以及黄酮类中药提取物抑制AD动物模型的tau病理发展[38],这些内源性活性分子是否会影响tau病理的传播也值得进一步研究。最新研究发现,Aβ可以通过医源性方式进行人际传播[39],tau蛋白是否也有类似的人际传染性?这也是tau病理研究的方向之一。

