沉默FoxM1通过促进线粒体释放细胞色素C诱导口腔鳞癌细胞凋亡*
王晓庚,刘 林,左 健,张非煜,李若萱
(首都医科大学附属北京安贞医院口腔科, 北京 100029)
口腔鳞癌是发生于头颈部的常见恶性肿瘤,目前以手术治疗和放化疗等为主要治疗手段,这些治疗方法取得了一定的效果,但是中晚期的口腔鳞癌患者生存率仍然不高,因此探讨口腔鳞癌发病机制,寻找靶基因提高口腔鳞癌患者生存率是目前的重点[1-2]。叉头框蛋白M1 (forkhead box protein M1, FoxM1)是一种转录调控因子,在增殖活性较高的细胞中高表达,而在静止期的细胞中表达水平极低,参与胚胎发育、成人组织自我更新、细胞增生等过程,具有抗衰老和促进损伤修复等作用[3]。目前在多种肿瘤组织中发现FoxM1高表达,FoxM1具有促进肿瘤生长作用,FoxM1表达升高的肿瘤主要有前列腺癌、肺癌、口腔鳞癌和血液系统肿瘤等,FoxM1表达水平的高低与肿瘤患者分期和分级等有关[4-5]。目前在宫颈癌、喉癌和乳腺癌等癌细胞中已经证实,沉默FoxM1表达具有诱导肿瘤细胞凋亡作用,而其在口腔鳞癌细胞凋亡中的作用尚不清楚[6-8]。本实验通过沉默口腔鳞癌SCC9细胞中FoxM1的表达,探讨其在口腔鳞癌细胞凋亡中的作用,以期为靶向基因治疗口腔鳞癌提供参考资料。
材 料 和 方 法
1 材料
胞浆蛋白提取试剂盒和线粒体蛋白提取试剂盒购自生工生物工程(上海)股份有限公司;FoxM1-shRNA慢病毒和阴性对照慢病毒由汉恒生物技术(上海)有限公司构建包装;RevertAid 第一链cDNA Synthesis试剂盒和Power SYBR Green PCR Master Mix试剂盒购自Thermo Scientifc;抗细胞色素C(cytochrome C)、cleaved caspase-3和cleaved caspase-9抗体购自Abcam;口腔鳞癌SCC9细胞购自湖南丰晖生物科技有限公司;JC-1线粒体膜电位检测试剂盒购自碧云天生物技术研究所。
2 方法
2.1细胞感染及沉默效果检测 SCC9细胞感染携带绿色荧光蛋白的FoxM1-shRNA慢病毒或阴性对照慢病毒(MOI=20)。SCC9细胞培养密度约为30%时,添加病毒液,感染10 h后,更换细胞培养液,荧光显微镜下观察培养3 d后绿色荧光表达情况,感染效率高于70%,进行嘌呤霉素筛选,筛选稳定感染的细胞做后续实验。把感染FoxM1-shRNA慢病毒和阴性对照慢病毒后的SCC9细胞记为Lv-FoxM1-shRNA和Lv-control,把没有感染病毒的细胞作为control。用RT-qPCR和Western blot测定沉默效果。
RT-qPCR检测:各组细胞中添加PBS洗涤后,加入TRIzol裂解液,将细胞吹打至匀浆状态以后,转移到离心管中,添加200 μL的氯仿,振荡反应15 s后,在冰上孵育10 min。12 000×g离心10 min。吸取上清500 μL,加入预冷的异丙醇,混合振荡30 s,冰浴5 min。12 000×g离心10 min。把上清吸除,添加75%乙醇洗涤后,在室温中晾干。RNA样品的A260/A280在1.8~2.0之间。用RevertAid 第一链cDNA Synthesis试剂盒合成cDNA。取cDNA,进行qPCR。PCR引物由上海生工合成。FoxM1的上游序列为5’-GGAGGAAATGCCACACTTAGCG-3’,下游引物序列为5’-TAGGACTTCTTGGGTCTTGGGGTG-3’;β-actin的上游引物序列为5’-CCACATGTGCCCATCTACG-3’,下游引物序列为5’-AGGATCTTCATGAGGTAGTCAGTCAG-3’。PCR步骤同Power SYBR Green PCR Master Mix试剂盒,反应结束后读取每个反应的Ct值,以β-actin作为内参照,用2-ΔΔCt法计算分析FoxM1表达变化。
Western blot检测:各组细胞中添加蛋白裂解液(每106个细胞中加入50 μL蛋白裂解液),混合后,在冰上裂解30 min后,4 ℃、12 000×g离心10 min。把上清溶液转移到离心管中,吸取2 μL的蛋白测定浓度。在蛋白样品中加入1/4体积的5×Loading Buffer,在沸水中反应5 min。采用5%的浓缩胶和10%的分离胶进行电泳,每个上样孔中加入30 μg的蛋白样品,分离胶中75 V电泳40 min,浓缩胶中110 V电泳80 min。电泳结束后,进行转膜,转膜的电压设置为100 V,转膜时间为100 min。将电转移后的NC膜放在5%脱脂奶粉中封闭2 h后,进行抗原抗体反应,Ⅰ抗以1∶400稀释,Ⅱ抗以1∶3 000稀释。用ECL显色。根据每组蛋白条带的吸光度值分析蛋白表达水平,内参照为β-actin。
2.2MTT测定细胞活力 各组细胞制成浓度为3×107/L的单细胞悬浮液,铺板,每个96孔板中加入100 μL的单细胞悬浮液,分别在培养1 d、2 d、3 d和4 d后取出培养板,在每个孔内添加MTT,孵育4 h以后,弃上清,用DMSO将结晶溶解以后,测定490 nm每孔的A值,同时以空白孔调零,分析细胞活力。
2.3克隆形成实验测定细胞克隆能力 各组细胞用0.25%的胰蛋白酶消化以后,配制成单细胞悬浮液,在每个6孔板中加入100个细胞,置于37 ℃、5% CO2培养箱内培养2~3周,观察出现肉眼可见的克隆时,终止培养,期间每间隔2 d观察1次细胞克隆形成情况,当观察到肉眼可见的细胞克隆形成时,终止培养。PBS洗涤3次,甲醇固定20 min,结晶紫染色。观察≥50个细胞的克隆数目。克隆形成率(%)=克隆细胞数目/接种细胞数目×100%。
2.4流式细胞术测定细胞凋亡 各组细胞用0.25%的胰蛋白酶消化以后,配制成单细胞悬浮液,细胞密度为3×109/L。吸取1 mL的细胞悬浮液,离心后,收集细胞沉淀,用PBS悬浮洗涤2次以后,添加400 μL的结合缓冲液,再依次加入PI和Annexin V-FITC染液各5 μL,孵育结合20 min后,用流式细胞仪检测凋亡变化。
2.5Western blot测定细胞中cleaved caspase-3和cleaved caspase-9蛋白水平 取各组细胞,用Western blot方法检测细胞中cleaved caspase-3和cleaved caspase-9蛋白水平,以β-actin作为内参照,分析蛋白表达变化。
2.6线粒体膜电位及胞浆、线粒体中cytochrome C蛋白水平检测 取各组细胞,用JC-1染色法检测线粒体膜电位变化,结果用红色荧光与绿色荧光的比值表示,步骤同试剂盒说明书。同时提取细胞线粒体和胞浆中的蛋白,用Western blot方法检测cytochrome C蛋白水平,线粒体中cytochrome C蛋白水平变化用VDCA1作为内参照,胞浆中cytochrome C蛋白水平变化用β-actin作为内参照,Western blot步骤同上,胞浆和线粒体蛋白提取步骤同胞浆和线粒体蛋白提取试剂盒。
3 统计学处理
所得数据采用SPSS 22.0软件分析。数据用均数±标准差(mean±SD)表示。多组间比较用单因素方差分析(one-way ANOVA),各组间两两比较用SNK-q检验。以P<0.05表示差异有统计学意义。
结 果
1 FoxM1-shRNA可以明显下调口腔鳞癌细胞中FoxM1的表达水平
RT-qPCR和Western blot结果显示,FoxM1-sh-RNA慢病毒感染可以显著下调口腔鳞癌细胞中FoxM1 mRNA和蛋白水平(P<0.05),见图1、表1。
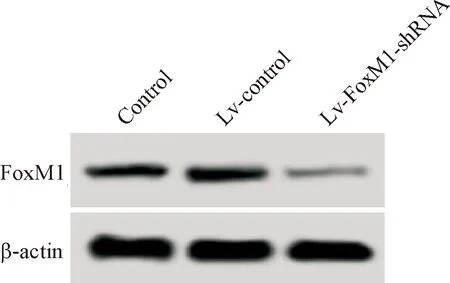
Figure 1.FoxM1-shRNA down-regulated the level of FoxM1 protein in oral squamous-cell carcinoma cells.
图1FoxM1-shRNA下调口腔鳞癌细胞中FoxM1的蛋白水平
表1FoxM1-shRNA对口腔鳞癌细胞中FoxM1蛋白和mRNA表达水平的影响
Table 1.Effect of FoxM1-shRNA on FoxM1 protein and mRNA expression in oral squamous-cell carcinoma cells (Mean±SD.n=3)

GroupFoxM1 proteinFoxM1 mRNAControl0.45±0.041.00Lv-control0.47±0.051.04±0.10Lv-FoxM1-shRNA0.20±0.02∗0.39±0.05∗
*P<0.05vscontrol and Lv-control groups.
2 沉默FoxM1下调口腔鳞癌细胞活力
沉默FoxM1的口腔鳞癌细胞在490 nm的A值明显降低(P<0.05),说明沉默FoxM1显著下调口腔鳞癌细胞活力,见表2。

表2 沉默FoxM1降低口腔鳞癌细胞活力
*P<0.05vscontrol and Lv-control groups.
3 沉默FoxM1可明显降低口腔鳞癌细胞克隆形成能力
沉默FoxM1的口腔鳞癌细胞克隆形成率降低(P<0.05),说明沉默FoxM1可降低口腔鳞癌细胞的克隆形成能力,见表3。
4 沉默FoxM1可以明显诱导口腔鳞癌细胞凋亡
如图2和表4中所示,沉默FoxM1的口腔鳞癌细胞凋亡率升高(P<0.05),细胞中caspase-3和caspase-9活化水平升高(P<0.05),说明沉默FoxM1可激活caspase-3和caspase-9,并诱导口腔鳞癌细胞凋亡。
表3沉默FoxM1降低口腔鳞癌细胞克隆形成能力
Table 3.Silencing ofFoxM1decreased the colony-forming ability of oral squamous-cell carcinoma cells (Mean±SD.n=3)

GroupColony formation rate (%)Control38.56±3.26Lv-control39.54±2.35Lv-FoxM1-shRNA20.16±1.25∗
*P<0.05vscontrol and Lv-control groups.
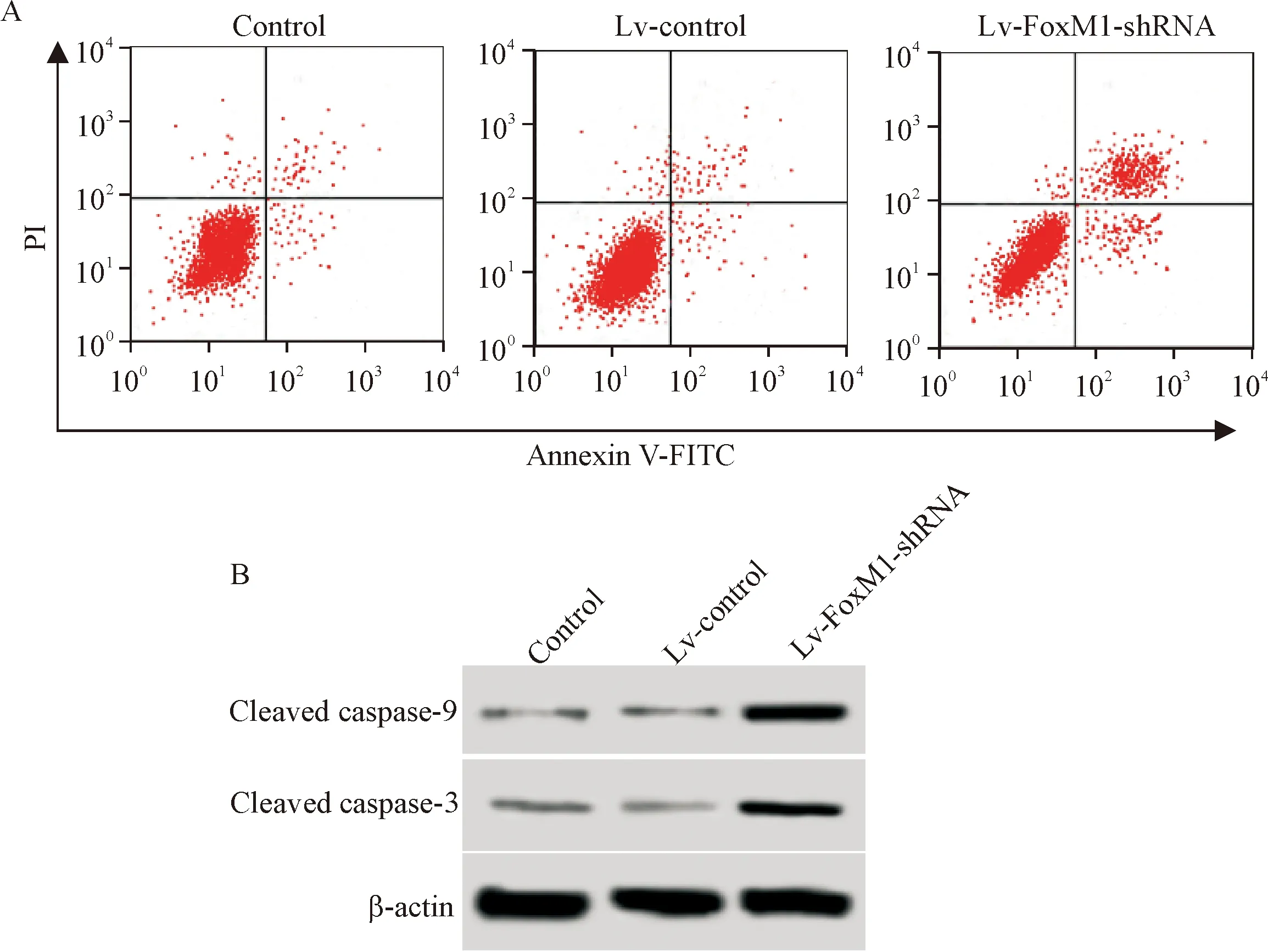
Figure 2.Silencing ofFoxM1 activated caspase-3 and caspase-9 to induce the apoptosis of oral squamous-cell carcinoma cells. A: apoptosis was measured by flow cytometry; B: Western blot was used to measure the levels of cleaved caspase-3 and cleaved caspase-9 protein.
图2沉默FoxM1激活caspase-3和caspase-9诱导口腔鳞癌细胞凋亡
表4沉默FoxM1诱导口腔鳞癌细胞凋亡及caspase-3和caspase-9活化
Table 4.Silencing ofFoxM1 induced the apoptosis and activation of caspase-3 and caspase-9 in oral squamous-cell carcinoma cells(Mean±SD.n=3)
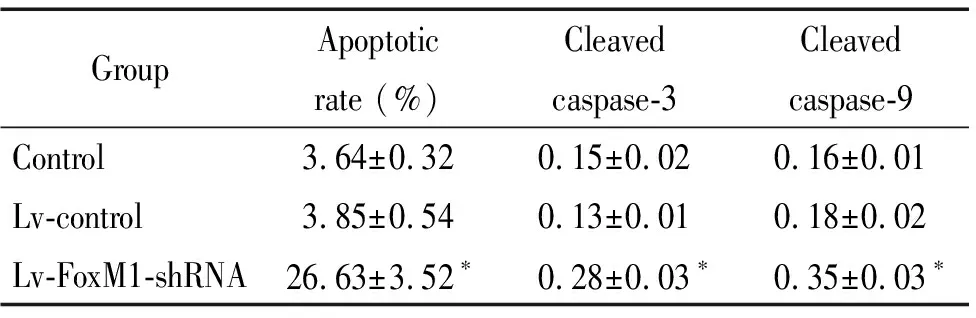
GroupApoptotic rate (%)Cleaved caspase-3Cleaved caspase-9Control3.64±0.320.15±0.020.16±0.01Lv-control3.85±0.540.13±0.010.18±0.02Lv-FoxM1-shRNA26.63±3.52∗0.28±0.03∗0.35±0.03∗
*P<0.05vscontrol and Lv-control groups.
5 沉默FoxM1降低口腔鳞癌细胞线粒体膜电位并促进线粒体释放cytochrome C
如图3和表5中所示,沉默FoxM1的口腔鳞癌细胞线粒体膜电位降低(P<0.05),胞浆中cytochrome C蛋白水平升高(P<0.05),线粒体中cytochrome C蛋白水平降低(P<0.05),说明沉默FoxM1能够降低口腔鳞癌细胞线粒体膜电位,促进线粒体释放cytochrome C。
讨 论
FoxM1蛋白包含有转录激活结构域、核定位序列和DNA结合结构域,其表达水平的高低与细胞增殖活跃程度有关[9]。FoxM1在胚胎组织中的表达水平普遍较高,具有促进神经系统、心脏和肺脏发育等作用,FoxM1在成人增生细胞或自我更新组织中的表达水平较高,具有抗衰老和促进损伤修复等作用[10-11]。FoxM1是一种促增殖转录因子,受到细胞内多种癌基因和抑癌基因的调控作用,参与肿瘤的发生、生长和进展,与肿瘤细胞的增殖、凋亡和分化等有关,沉默FoxM1具有降低食管癌和卵巢癌等肿瘤细胞增殖能力等作用[12-14]。研究表明,FoxM1在口腔鳞癌组织中表达水平异常升高[15]。本实验显示,FoxM1沉默后的口腔鳞癌细胞活力降低,克隆形成能力也降低,说明沉默FoxM1具有抑制口腔鳞癌细胞生长的作用。

Figure 3.Silencing ofFoxM1 promoted cytochrome C release from mitochondria of oral squamous-cell carcinoma cells. A: Western blot was used to determine the level of cytochrome C protein in the cytoplasm; B: Western blot was used to determine cytochrome C protein level in mitochondria.
图3沉默FoxM1促进口腔鳞癌细胞线粒体释放cytochromeC
表5沉默FoxM1促进口腔鳞癌细胞线粒体释放cytochromeC,降低线粒体膜电位
Table 5.Silencing ofFoxM1 promoted the release of cytochrome C from mitochondria and decreased the mitochondrial membrane potential in oral squamous-cell carcinoma cells (Mean±SD.n=3)
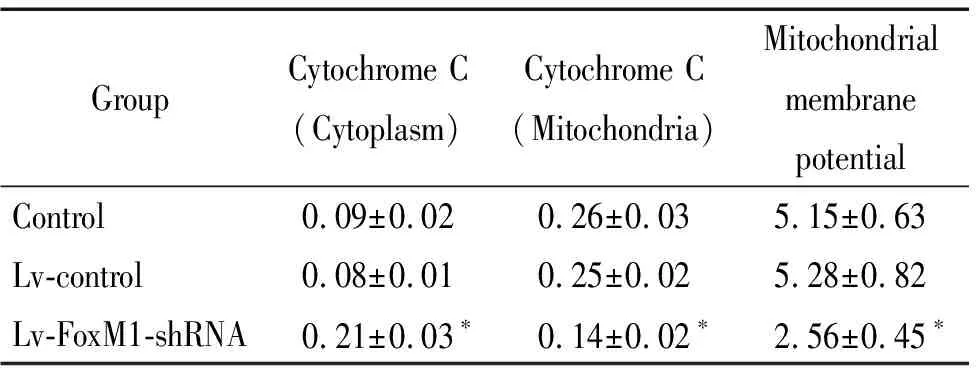
GroupCytochrome C(Cytoplasm)Cytochrome C(Mitochondria)Mitochondrial membrane potentialControl0.09±0.020.26±0.035.15±0.63Lv-control0.08±0.010.25±0.025.28±0.82Lv-FoxM1-shRNA0.21±0.03∗0.14±0.02∗2.56±0.45∗
*P<0.05vscontrol and Lv-control groups.
细胞凋亡是受到基因调控作用的细胞死亡,目前的研究认为,细胞凋亡的发生受到caspase级联反应的高度调控作用,caspase-3是该级联反应的下游效应子,其可以将细胞内的底物降解诱导细胞凋亡的发生,caspase-3被认为是凋亡执行者[16]。Caspase-3以酶原的形式合成后,必须受到起始型caspase成员激活才可以发挥凋亡促进作用[17]。Caspase-9和cytochrome C等形成的复合物是caspase-3激活的诱导因素之一,也是目前研究的与细胞凋亡有关的线粒体凋亡途径。细胞在受到活性氧和ATP等刺激以后,线粒体通透性转变孔被打开,导致线粒体内外的H+浓度梯度和线粒体内外的渗透压被破坏,使原本存在于线粒体内的cytochrome C释放至胞浆中,cytochrome C可以同caspase-9结合促进细胞凋亡的发生[18-20]。本实验的结果显示,沉默FoxM1后的口腔鳞癌细胞中线粒体膜电位降低,caspase-3和caspase-9活化水平升高,胞浆中cytochrome C蛋白水平升高,线粒体中cytochrome C蛋白水平降低,线粒体膜电位降低,提示沉默FoxM1可以通过线粒体途径诱导口腔鳞癌细胞凋亡。
目前对于FoxM1调控肿瘤细胞凋亡机制研究尚不清楚,在鼻咽癌中的研究显示,FoxM1沉默可以通过线粒体途径诱导鼻咽癌细胞凋亡,在喉癌细胞中的研究也显示,沉默FoxM1可以降低线粒体膜电位并激活caspase-9,这与本实验结果相符合,均提示沉默FoxM1可以通过线粒体途径诱导肿瘤细胞凋亡[21-23]。也有研究报道显示,FoxM1还可以通过调控JNK信号通路的传导影响肿瘤细胞生长,FoxM1可能是p53下游靶基因[24-25]。本实验没有探讨FoxM1与JNK信号通路、p53等多种信号之间的调控作用,在后续实验中会进行深入研究。
综上所述,沉默FoxM1具有诱导口腔鳞癌细胞凋亡作用,其作用机制与激活线粒体凋亡途径有关。这为靶向FoxM1治疗口腔鳞癌提供了依据,为阐明FoxM1在口腔鳞癌发生中的调控机制奠定了基础。

