精氨酸加压素对大鼠视前区GABAA受体亚单位磷酸化的影响*
唐 瑜,孙士林,尹双双,彭哲宇,曾宪刚,姚姝婷,何钰婷,彭 娜
(成都医学院 1基础医学院, 2体温与炎症四川省高校重点实验室, 3检验医学院, 四川 成都 610500)
精氨酸加压素(arginine vasopressin,AVP)作为一种内分泌九肽激素,在自主神经功能中发挥着重要作用,比如参与心血管活动调节和体温调节[1]。AVP受体是G蛋白偶联受体,包括V1a、V1b和V2共3种亚型,其中V1a受体激活磷脂酶C (phospholipase C,PLC)信号通路,引起细胞内钙离子浓度升高并激活蛋白激酶C(protein kinase C,PKC)和钙/钙调蛋白依赖性蛋白激酶II(calcium/calmodulin-dependent protein kinase II,CaMKII)[2]。整体动物实验研究表明,外源性AVP会引起动物体温降低,而注射V1a受体抑制剂可升高体温[3]; 其对体温的紧张性负调节作用可能与AVP改变视前区(preoptic area, POA)神经元放电活动和温度敏感性有关[4]。
中枢控制体温调节反应涉及视前区神经元协调整合中枢和外周温度信号[5]。皮肤感觉的冷/热信号分别传递到背根神经节后传入到脊髓后角。臂旁外侧核的外侧亚核(external lateral subnucleus of la-teral parabrachial nucleus,LPBel)和背侧亚核(dorsal subnucleus of lateral parabrachial nucleus,LPBd)分别接受脊髓后角传来的冷和热信号[6]。冷激活神经元从LPBel投射到正中视前核,然后通过这里分布的γ-氨基丁酸(γ-aminobutyric acid,GABA)能中间神经元再投射到内侧视前区,控制可以调节皮肤血管收缩、棕色脂肪组织代谢和战栗产热的热敏神经元[7]。内侧视前区神经元接受GABA能突触传递的紧张性抑制,这可调制内侧视前区热敏神经元的放电活动和温度敏感性[8]。激活外侧视前核的腹侧GABA能神经元可以降低体温,同时伴有大鼠活动度的减少[9]。最近我们发现,AVP差异性地调制视前区温度敏感和不敏感神经元的抑制性突触后电流[10],但是具体作用机制尚不清楚。本实验应用RT-qPCR和Western blot法,探讨精氨酸加压素对大鼠视前区GABAA受体亚单位(α、β和γ2)表达和磷酸化的作用。
材 料 和 方 法
1 动物
应用SPF级健康雄性SD大鼠,体重200~250 g(6~7周龄),由成都达硕实验动物有限公司提供,合格证号:SCXK(川)2015-030。在饲养时大鼠可自由进食和饮水,控制环境温度在24~26 ℃,相对湿度在60%~65%,保持12 h昼/12 h夜节律。
2 主要试剂
RNAlater和TRIzol(Invitrogen);DEPC(Sigma);PrimeScript RT reagent Kit(TaKaRa); FastStart Essential Probes Master(Roche);TEMED 、RIPA裂解液和PMSF(上海碧云天生物技术有限公司);BCA蛋白含量检测试剂盒(江苏凯基生物技术股份有限公司);4×上样缓冲液(BIO-RAD);蛋白Marker(Thermo Fisher);ECL化学发光试剂盒(Millipore);荧光定量PCR探针(Roche),探针所匹配的特异引物由成都梓熙擎科生物技术公司合成,见表1;所用抗体及稀释浓度见表2。

表1 RT-qPCR探针及引物序列
UPL: Universal ProbeLibrary.
3 主要方法
3.1实验分组、给药及取材 实验SD大鼠随机分为4组(n=10),分别为对照(control)组(saline+saline)、AVP组(saline+AVP)、V1a受体抑制剂(V1a receptor antagonist,V1a Anta)+AVP组和V1a受体抑制剂组(V1a Anta+saline)。每组动物均腹腔注射2次,第1次注射V1a受体抑制剂(30 μg/kg)或等量的生理盐水,20 min后第2次注射AVP(10 μg/kg)
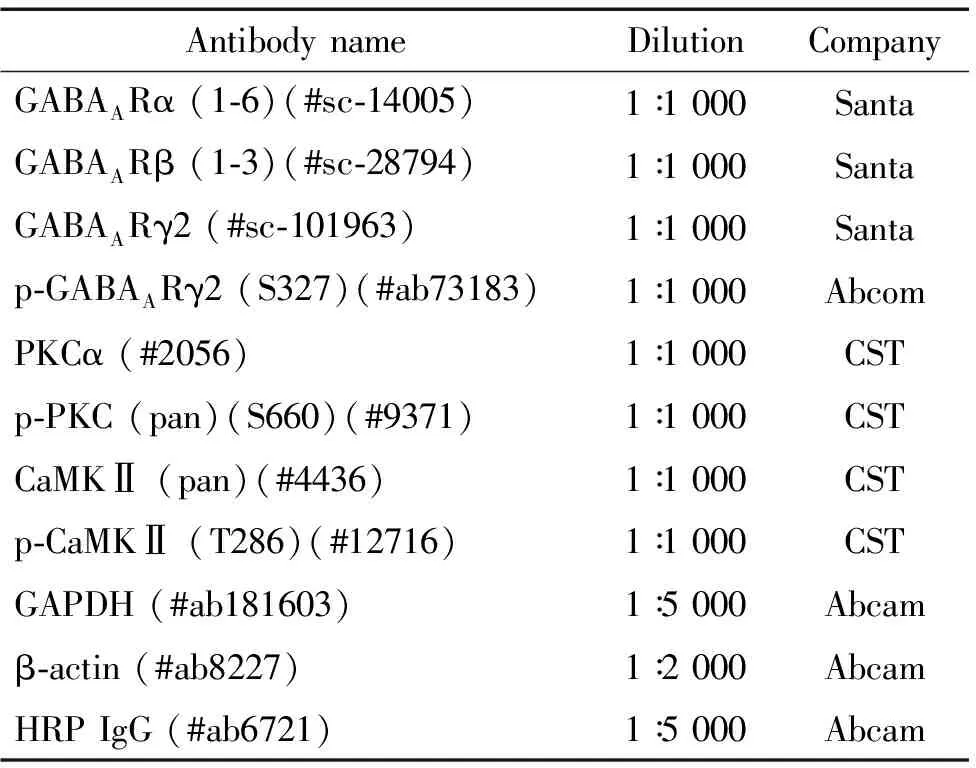
表2 抗体名称、稀释比和来源
或等量的生理盐水,30 min后腹腔注射4%戊巴比妥钠麻醉(1 mL/kg),快速断头处死。取脑组织放入冰水混合的人工脑脊液中,修块后用502胶将组织块固定在振动切片机上,切成300 μm厚的水平下丘脑片,在体视显微镜下分离POA组织,放入-80 ℃冰箱保存备用,进行后续的分子生物学实验。
3.2RT-qPCR实验 参照TRIzol试剂说明书严格操作,获得RNA样本后测定RNA 浓度及纯度。电泳检测RNA 完整性,可见明亮的28S、18S 及较淡5S 3条带,无DNA 污染条带。随后冰上制备RT反应体系,先去基因组DNA,反应体系为:5× gDNA Era-ser 缓冲液 2 μL,gDNA Eraser 1 μL,总RNA 2 μg,加无酶水至总体系为10 μL。混匀离心后转至PCR仪,42 ℃孵育2 min。然后在体系内加入10 μL的反转录预混液,该预混液含:PrimeScriptRT Enzyme Mix I 1 μL,RT Primer Mix 4 μL,5× PrimeScript Buffer 24 μL,RNase-free dH2O 1 μL。混匀离心后在PCR仪内反应:37 ℃ 15 min,85 ℃ 5 s。逆转录所得cDNA用于qPCR,配制预混液比例为每10 μL反应体系含FastStart Essential Probes Master 5 μL、引物及探针各0.15 μL和RNase-free dH2O 1 μL,涡旋混匀后分装于八联管,加入2 μL cDNA模板,再次混匀离心后上机。扩增程序为:95 ℃预变性10 min;95 ℃ 10 s,60 ℃ 30 s,读取荧光值,循环45次;最后40 ℃延伸30 s。反应结束后,以β-actin为内参照,使用2-ΔΔCt法计算各组mRNA相对含量。
3.3Western blot实验 按照组织∶裂解液(RIPA∶PMSF=100∶1)=1 g∶5 mL的比例,冰上裂解组织30 min。离心后取上清,并按1∶20稀释。严格按照BCA蛋白定量试剂盒说明书完成蛋白定量。PSD中加入4×样品缓冲液,煮沸5 min,取100 μg蛋白上样,用8% SDS-PAGE分离蛋白并转至经甲醇活化的PVDF膜。5%脱脂奶粉37℃恒温振荡封闭1 h,TBST漂洗后,将PVDF膜放入5%脱脂奶粉稀释的Ⅰ抗(表2),水平摇床4 ℃孵育过夜。TBST再次漂洗,用经5%脱脂奶粉稀释过的辣根过氧化物酶标记Ⅱ抗(表2)37 ℃恒温孵育2 h,TBST漂洗后滴上发光液,放入凝胶成像仪中显影。用凝胶图像分析系统测定条带的相对灰度,结果以目的蛋白相对表达量表示。
4 统计学处理
实验数据以均数±标准误(mean±SEM)表示。不同组样本均数间比较采用单因素方差分析(one-way ANOVA)检验,方差齐则采用Dunnett检验,方差不齐则采用Tamhane’s T2检验。所有数据的统计分析由SPSS 19.0统计软件完成,以P<0.05为差异有统计学意义。
结 果
1 AVP不影响视前区GABAA受体mRNA表达
除β3亚单位外,AVP有增加其它亚单位mRNA表达的趋势,而V1a受体抑制剂减弱了这种趋势。但与对照组相比,AVP组、V1a受体抑制剂+AVP组和V1a受体抑制剂组GABAA受体亚单位mRNA变化均没有统计学意义,见图1。
2 AVP通过V1a受体激活PKC和CaMKⅡ
与对照组相比,外源性AVP显著增强大鼠视前区组织PKC和CaMKⅡ表达及磷酸化(P<0.01),这一效应可以被V1a受体抑制剂消除(P<0.01);单独注射V1a受体抑制剂还可以通过阻断内源性AVP减少PKC和CaMKⅡ表达及磷酸化(P<0.01),见图2。
3 AVP通过V1a受体磷酸化GABAA受体γ2亚单位
与对照组比较,AVP组、V1a受体抑制剂+AVP组和V1a受体抑制剂组GABAA受体亚单位(α、 β和γ2)蛋白变化没有统计学意义。但外源性AVP显著增加GABAA受体γ2亚单位磷酸化水平,这一作用可以被V1a受体抑制剂所消除(P<0.05),而阻断内源性AVP并不会引起其磷酸化的减少,见图3。
讨 论
作为一种激素或神经递质/调质,AVP在体温的紧张性负调节过程中发挥重要作用[1]。本课题组前期研究表明,AVP可以调节视前区热敏神经元的自发放电活动和温度敏感性,而对冷敏和温度不敏感神经元却有相反的作用[4],这些结果提示AVP可以通过V1a受体兴奋视前区热敏神经元而抑制冷敏神经元的活动。视前区是重要的调节体温中枢,温度敏感神经元通过控制机体产热与散热反应调节体温,这可从电生理角度解释AVP对体温的紧张性负调节作用。视前区神经元的自发放电活动还受外周温度传入信号的调制。因此,我们最近研究表明,AVP差异性调制视前区温度敏感和不敏感神经元抑制性突触后电流[10]。但灌流正常人工脑脊液时,这些不同温度敏感类型神经元的抑制性突触后电流幅度和频率并没有显著差异。这提示AVP可能通过不同机制调制视前区热敏神经元、冷敏感神经元和温度不敏感神经元抑制性突触传递活动。
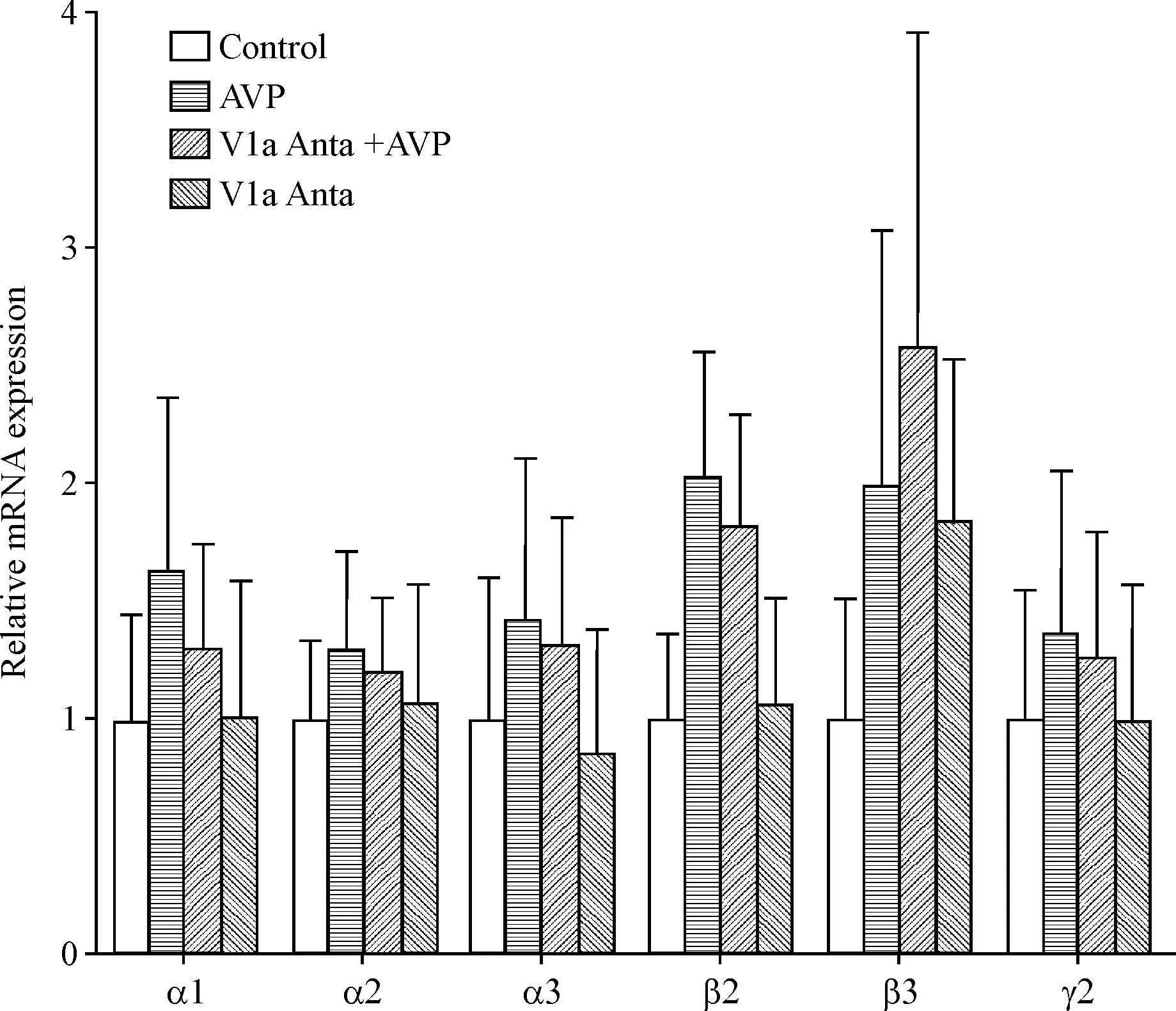
Figure 1.Effects of AVP and V1a receptor antagonist (V1a Anta) on GABAAreceptor subunit mRNA levels in POA tissues of rats. Mean±SEM.n=6.
图1AVP和V1a受体抑制剂对视前区组织GABAA受体mRNA表达的影响

Figure 2.AVP activated PKC and CaMKII in rat POA tissues. Mean±SEM.n=4.**P<0.01vscontrol group;##P<0.01vsAVP group.
图2AVP激活视前区组织PKC和CaMKII
与外侧隔区、海马和舌下运动神经元记录的抑制性突触后电流相似[2,11],AVP调制的视前区神经元抑制性突触后电流是由GABAA受体介导[10]。GABAA受体是异质寡聚体跨膜蛋白,由5个亚基聚合而成,氯离子通道位于5个亚基的中心。现已在哺乳类动物大脑中鉴定的GABAA受体亚基有21种,分8个亚基族,分别为α1~6、β1~4、γ1~4、ρ1~3、δ、ε、π和θ。不同亚基组合受体的功能会有所差异,展现出不同的生理学和药理学特性。一般情况下,构成受体的5个亚基由2个α亚基、2个β亚基或1个γ亚基组成。哺乳动物大脑中构成天然GABAA受体的亚基主要是α、β和γ,以α1、β2和γ2 3种亚基以2∶2∶1的比例组成的GABAA受体为主[12-13]。有单细胞转录组分析报道视前区热敏神经元表达GABAA受体亚单位主要为α2、α3、β2和 γ2[14]。本研究检测到视前区表达GABAA受体亚单位α1、α2、α3、β2、β3和γ2 mRNA,印证了上述结果。

Figure 3.AVP phosphorylated the GABAAreceptor γ2 subunit in rat POA tissues. Mean±SEM.n=4.*P< 0.05vscontrol group;#P<0.05vsAVP group.
图3AVP磷酸化视前区组织GABAA受体γ2亚单位
AVP受体主要有3种,V1a、V1b和V2受体,最早分别在血管平滑肌、垂体、肾脏远曲小管和集合管发现[1]。电生理结果证实V1a受体阻断剂可消除AVP对视前区神经元抑制性突触后电流的调制作用[10]。激活V1a受体,通过PLC信号通路引起胞内钙离子浓度升高并激活PKC和CaMKII[1]。AVP抑制视前区神经元GABAA受体的机制可能涉及3方面:首先,激活V1a受体调节GABAA受体表达;其次,PKC或CaMKII通过磷酸化调制GABAA受体功能[15-16];最后, PKC磷酸化引起GABAA受体内化,减少膜上表达[17]。本实验证实在视前区表达GABAA受体亚单位α1、α2、α3、β2、β3和γ2。但RT-qPCR和Western blot实验结果并不支持AVP通过激活V1a受体调节GABAA受体基因和蛋白表达。这可能和实验取材有关,实验取的视前区组织既含有热敏神经元,也有冷敏和温度不敏感神经元,无法分离单一温度敏感类型的神经元。由于AVP可以差异性调制视前区温度敏感和不敏感神经元抑制性突触后电流,所以我们推测AVP可能下调GABAA受体在热敏、冷敏神经元、中等斜率温度不敏感神经元和部分低斜率温度不敏感神经元的表达,而上调其在另外部分低斜率温度不敏感神经元的表达。因此,在后续的研究中可以通过单细胞RT-PCR或转录组技术,进一步证实AVP是否引起不同温度敏感类型神经元GABAA受体mRNA表达的差异。
本实验结果提示AVP提高了视前区PKC磷酸化水平。PKC通过磷酸化通道可以减少GABA引起的抑制性突触后电流幅度而不影响电流衰减时间常数[15],而近期课题组显示AVP降低热敏、冷敏神经元抑制性突触后电流幅度,却没有改变其通道动力学参数[10],这提示V1a受体激活的PKC可能对视前区热敏神经元和冷敏神经元的GABAA受体磷酸化水平产生影响,从而引起AVP对电流幅度的抑制而不改变通道动力学参数。抑制性突触后电流幅度的减少与PKC磷酸化GABAA受体β1 (S409)、β3和γ2 (S327和S343)亚单位有关[12,15]。本实验也证实了这一观点,AVP引起视前区组织GABAA受体γ2亚单位磷酸化水平增加。
本实验结果还提示AVP引起视前区CaMKII磷酸化水平升高。CaMKII的激活可以通过2个方面影响GABAA受体[13, 16]:第一,通过磷酸化含有β3亚单位受体的β3(S383)和γ2(Y365/7),增加抑制性突触后电流时间;第二,通过磷酸化促进受体从囊泡上膜,使含有β2亚单位的受体电流幅度增加而不改变通道动力学参数[18-19]。这可部分解释AVP增加视前区低斜率温度不敏感神经元抑制性突触后电流幅度并且影响通道动力学参数[10]。
综上所述,本研究证实AVP通过V1a受体激活PKC和CaMKII,影响视前区GABAA受体γ2亚单位磷酸化水平,而不改变受体mRNA和蛋白表达。这可能是AVP差异性地调制视前区神经元GABA能突触传递的分子机制之一。

