慢性束缚应激大鼠下丘脑弓状核食欲调控因子的变化*
王 霞,王少贤△,方朝义,王杰鹏,旷湘楠,赵 丹,王一旭
(1河北中医学院中医诊断教研室, 2河北省心脑血管病中医药防治重点实验室, 河北 石家庄 050200)
伴随着社会竞争日益激烈和生活节奏不断加快,紧张的工作环境、复杂的人际关系和沉重的经济压力等长期、慢性心理应激已成为威胁人类健康的重要因素。机体体重增长缓慢和饮食量下降,则是常见的慢性应激反应。本研究动态观察了慢性束缚应激大鼠摄食量及体重变化,并采用ELISA、Western blot和RT-qPCR方法分别测定其血清瘦素(leptin)水平及下丘脑弓状核(arcuate nucleus,ARC)中食欲调控因子瘦素受体(leptin receptor,LEPR)、神经肽Y(neuropeptide Y,NPY)、刺鼠相关蛋白(agouti-related protein,AgRP)、阿黑皮素原(proopiomelanocortin,POMC)和可卡因苯丙胺调节转录物(cocaine amphetamine-regulated transcript,CART)的表达情况,以探讨应激状态下机体出现摄食和能量代谢异常的中枢机制。
材 料 和 方 法
1 动物
雄性SD大鼠,体重180~200 g,购自北京维通利华实验动物技术有限公司,动物合格证号为SCXK(京)2012-0001。动物饲养于清洁级动物房,光照明暗各12 h(明7:00~19:00,暗19:00~7:00),恒温、恒湿[室温(21±1)℃,相对湿度40%~60%],自由摄食,饮水。
2 试剂与仪器
2.1主要试剂 Leptin和LEPR ELISA试剂盒购自Phoenix Pharmaceuticals;RIPA裂解液购自Pierce Biotechnology;兔抗AgRP抗体购自Santa Cruz Biotechnology;兔抗 LEPR抗体购自Invitrogen;兔抗POMC抗体购自Signalway Antibody;兔抗NPY和兔抗CART抗体购自Cell Signaling Technology; 辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG购自北京中杉金桥生物公司;TRIzol购自Invitrogen;M-MLV反转录试剂盒购自Promega;SYBR Green I荧光定量PCR试剂盒购自Fementas。
2.2主要仪器 T10型手持电动匀浆器购自IKA; SpectraMax® Plus 384读板机(酶标仪)购自MD; ND2000型微量分光光度计购自Thermo; ABI 7300 型荧光定量PCR System购自ABI; DYY-Ⅲ型电泳仪、DYY-Ⅲ40B型转膜槽和DYCZ-24D型垂直电泳槽购自北京六一生物科技有限公司;凝胶成像系统购自UVP;3K15低温离心机购自Sigma。
3 方法
3.1动物分组及模型制备 90只实验大鼠适应饲养1周,随机分为空白对照(blank control,BC)组、7 d应激(7-d stress,7-S)组和21 d应激(21-d stress,21-S)组,每组30只。应激方法同参考文献[1],将大鼠束缚于特制的T型束缚架上,每日3 h,束缚时点随机。7-S组和21-S组分别持续束缚应激7 d和21 d;BC组大鼠常规饲养21 d,不予束缚应激干预。
3.2摄食量和体重检测 称量大鼠应激前1 d(day 0)的体重和摄食量及应激后连续21 d(day 1~day 21)的体重和摄食量。摄食量计算以前 1 d给食量减去当天剩余食量。
3.3检测标本制备 7-S组于实验第8天、BC组和21-S组于实验第22天,以2%戊巴比妥钠(40 mg/kg)麻醉,断头取血2 mL分离血清备用;冰盘上快速取脑,液氮速冻,抠取ARC组织,-80 ℃保存备用。
3.4ELISA法测定大鼠血清leptin及下丘脑ARC LEPR的含量 根据ELISA试剂盒操作说明,于酶标仪上检测血清leptin含量。另取脑组织ARC置1 mL NaCl溶液中煮沸3 min,加0.5 mL 1 mol/L冰醋酸,手持电动匀浆器匀浆,以0.5 mL 1 mol/L NaOH中和混匀,离心,取上清,根据试剂盒说明检测ARC组织中LEPR蛋白含量。
3.5Western blot法测定下丘脑ARC中LEPR、NPY、AgRP、POMC和CART 的蛋白表达 ARC组织置EP管,加RIPA缓冲液 1 mL进行匀浆,冰浴反应,充分裂解,离心,取上清,提取总蛋白,采用分光光度计测定蛋白含量。每个蛋白样本取30 μg进行SDS-PAGE,转至PVDF膜。用蒸馏水振荡洗膜3次,每次5 min,然后以5%脱脂奶粉,脱色摇床摇动封闭1 h;TBST振荡洗膜3次,每次5 min,加兔源性 I 抗(β-actin、LEPR、NPY、POMC和CART抗体的稀释度均为1∶300,AgRP抗体的稀释度为1∶200),4 ℃孵育过夜;TBST振荡洗膜3次,每次5 min,加入1∶3 000的 II 抗(山羊抗兔IgG-HRP),4 ℃孵育1 h;TBST室温洗膜3次,每次10 min,然后用TBS 洗膜5 min,化学发光法获得目标条带。Image-Pro Plus 6.0软件分析条带积分吸光度(IA),β-actin为内参照,分别计算LEPR、NPY、AgRP、POMC和CART蛋白表达相对含量。
3.6RT-qPCR法测定下丘脑ARC中LEPR、NPY、AgRP、POMC、CART 的mRNA表达 每样本50 μg,TRIzol法提取ARC组织总RNA,1%琼脂糖凝胶电泳和紫外分光光度计测定A260与A280,结果28S和18S条带清晰可见,5S条带较弱弥散,表明所提取总RNA降解较少,完整性良好;A260/A280比值在1.8~2.0之间,纯度较高,可用于后续反转录反应。
根据M-MLV 反转录试剂盒说明操作,20 μL反应体系(总RNA 1 μg)于PCR仪上42 ℃ 50 min,95 ℃ 5 min,灭活反转录酶,逆转录合成cDNA。以cDNA为模板,根据试剂盒说明操作,进行荧光定量PCR扩增:95 ℃ 5 min; DNA变性94 ℃ 30 s,退火58 ℃ 30 s,引物延伸72 ℃ 30 s,40个循环,于每个循环引物延伸时收集荧光信号。以β-actin 作为内参照,空白对照组第1号样品设定为标准1,SDSV1.3软件分析获得各样本目的基因Ct值,ΔΔCt=(Ct实验组-Ctβ-actin)-(Ct对照组-Ctβ-actin),根据公式RQ=2-ΔΔCt计算各样本LEPR、AgRP、NPY、POMC和CART mRNA表达量,用于统计分析。
LEPR的上游引物序列为5’-GCCAAAGTCAACTACGCTCTT-3’, 下游引物序列为5’-CTTCCATACGCAAACCCA-3’;NPY的上游引物序列为5’-CGTGTGTTTGGGCATTCT-3’, 下游引物序列为5’-CAGTGTCTCAGGGCTGGAT-3’;AgRP的上游引物序列为5’-CTGCCGCTTCTTCAATACC-3’, 下游引物序列为5’-CTTTGCCCAACATCCGTT-3’;POMC的上游引物序列为5’-TGCTTCAGACCTCCATAGACG-3’, 下游引物序列为5’-AGGGCTGTTCATCTCCGTT-3’;CART的上游引物序列为5’-GACATCTACTCTGCCGTGGA-3’, 下游引物序列为5’-CGGAAT GCGTTTACTCTTGA-3’;β-actin的上游引物序列为5’-GGTCATCACCATTGGCAA-3’, 下游引物序列为5’-GAGTTGAAGGTAGTTTCGTGGA-3’。
4 统计学处理
采用SPSS 21.0软件进行统计分析。数据以均数±标准差(mean±SD)表示,采用一般线性模型的重复测量过程对体重和摄食量数据进行单变量方差分析,并用多因素方差分析LSD法进行相同时点上的两组间比较;其它数据进行单因素方差分析,多组间比较采用SNK-q法。21-S组大鼠体重/摄食量和下丘脑弓状核食欲因子表达的相关性采用Pearson相关分析。以P<0.05为差异有统计学意义。
结 果
1 慢性束缚应激对大鼠体重和摄食量的影响
从表1可以看出,束缚应激前,BC组和21-S组大鼠体重和摄食量的差异无统计学显著性。从束缚应激第2天开始,在相同时点内21-S组大鼠的体重明显低于BC组(P<0.05或P<0.01);从束缚第1天开始,在相同时点内21-S组大鼠摄食量始终低于BC组,尤其在应激第1、7、8、10、11及13~21天,2组间的差异最为明显(P<0.05或P<0.01),见表1。
2 慢性束缚应激对大鼠血清leptin及下丘脑ARC中LEPR含量的影响
大鼠血清中leptin含量7-S组和21-S组较BC组均明显增加(P<0.05);7-S组和21-S组相比差异无统计学显著性,见表2。
大鼠下丘脑ARC中LEPR含量7-S组和21-S组较BC组均有所增加,尤其21-S组增加更为明显(P<0.05),见表2。
3 慢性束缚应激对大鼠下丘脑ARC中 LEPR、NPY、AgRP、POMC和CART蛋白表达的影响
与BC组比较,7-S组和21-S组大鼠下丘脑的ARC中NPY和AgRP蛋白表达水平均显著下降(P<0.05),LEPR、POMC和CART的蛋白表达水平显著升高(P<0.05);21-S组较7-S组ARC中NPY和AgRP的蛋白表达水平明显减少(P<0.05),而LEPR和POMC表达则有所增高(P<0.05),7-S组和21-S组大鼠下丘脑ARC中CART蛋白表达虽然也有所变化,但组间比较差异无统计学显著性,见图1、表3。
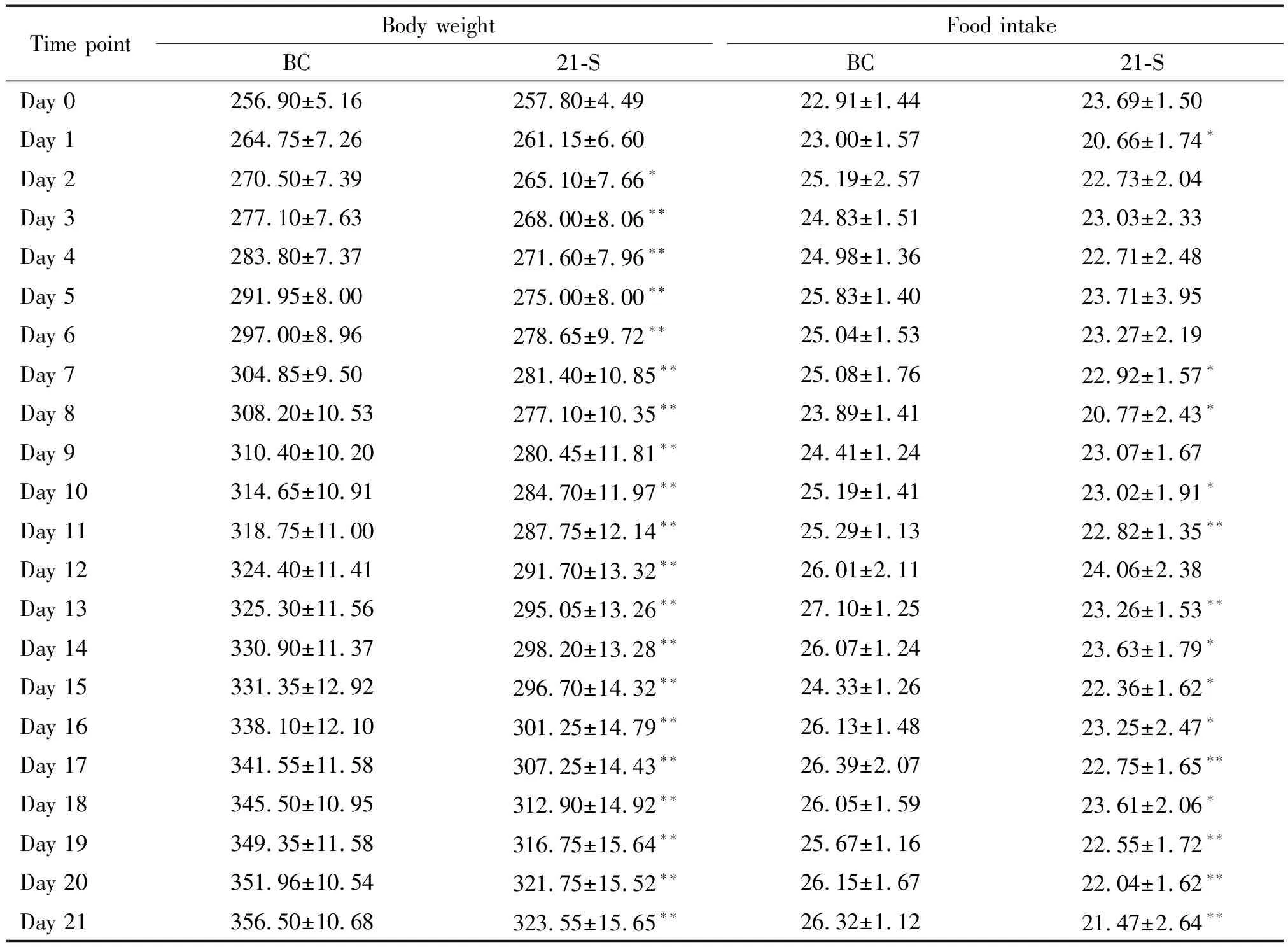
表1 慢性束缚应激对大鼠体重和摄食量的影响
*P<0.05,**P<0.01vsBC group at the same time point.
表2慢性束缚应激对大鼠血清leptin和ARC中LEPR含量的影响
Table 2.The effects of chronic immobilization stress on serum leptin and LEPR in ARC of rats (Mean±SD.n=10)

GroupLeptin (μg/L)LEPR (μg/L)BC3.58±1.317.53±2.957-S 6.40±1.81∗9.10±1.46∗21-S6.71±1.42∗11.69±2.14∗#
*P<0.05vsBC group;#P<0.05vs7-S group.
4 慢性束缚应激对大鼠下丘脑ARC 中LEPR、NPY、AgRP、POMC和CART mRNA表达的影响
7-S组和21-S组大鼠下丘脑ARC中NPY和AgRP的mRNA表达较BC组均显著减少(P<0.05),而LEPR和POMC的mRNA表达则不同程度增加(P<0.05);21-S组与7-S组比较,大鼠下丘脑ARC中NPY和AgRP的mRNA表达下降(P<0.05),而LEPR和POMC 的mRNA表达明显增加(P<0.05)。3组比较,大鼠下丘脑ARC中CART的mRNA表达差异无统计学显著性,见表4。

Figure 1.The images of Western blot showed the effects of chronic immobilization stress on the protein expression of LEPR, NPY, AgRP, POMC and CART in ARC of the rats.
图1Westernblot检测慢性束缚应激对大鼠下丘脑ARC中LEPR、NPY、AgRP、POMC和CART蛋白表达的影响
表3慢性束缚应激对大鼠下丘脑ARC中LEPR、NPY、AgRP、POMC和CART蛋白表达的影响
Table 3.The effects of chronic immobilization stress on the protein expression of LEPR, NPY, AgRP, POMC and CART in ARC of rats (Mean±SD.n=3)
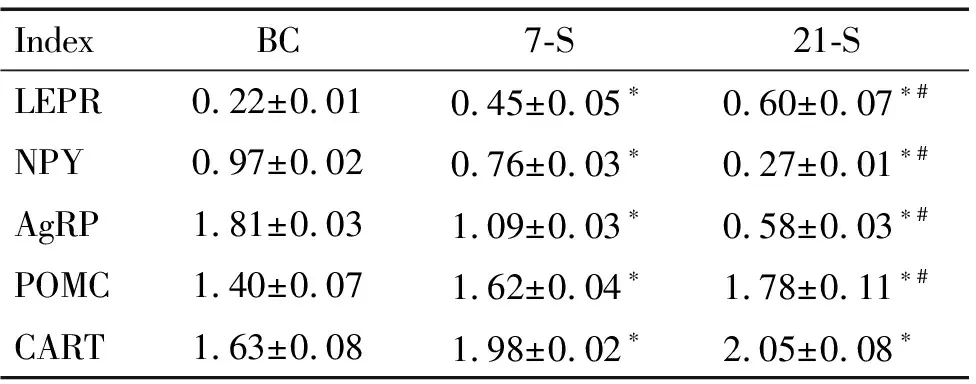
IndexBC7-S21-SLEPR0.22±0.010.45±0.05∗0.60±0.07∗#NPY0.97±0.020.76±0.03∗0.27±0.01∗#AgRP1.81±0.031.09±0.03∗0.58±0.03∗#POMC1.40±0.071.62±0.04∗1.78±0.11∗#CART1.63±0.081.98±0.02∗2.05±0.08∗
*P<0.05vsBC group;#P<0.05vs7-S group.
5 21-S组大鼠体重/摄食量与下丘脑ARC 中食欲因子表达的相关性
21-S组大鼠体重与其ARC中LEPR和CART的mRNA表达呈显著负相关(P<0.05或P<0.01),与
表4慢性束缚应激对大鼠下丘脑ARC中LEPR、NPY、AgRP、POMC和CARTmRNA表达的影响
Table 4.The effects of chronic immobilization stress on the mRNA expression of LEPR, NPY, AgRP, POMC and CART in ARC of rats (Mean±SD.n=6)
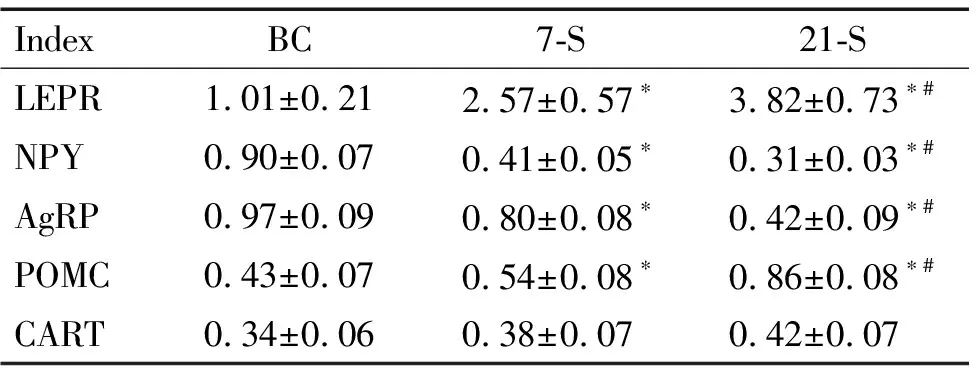
IndexBC7-S21-SLEPR1.01±0.212.57±0.57∗3.82±0.73∗#NPY0.90±0.070.41±0.05∗0.31±0.03∗#AgRP0.97±0.090.80±0.08∗0.42±0.09∗#POMC0.43±0.070.54±0.08∗0.86±0.08∗#CART0.34±0.060.38±0.070.42±0.07
*P<0.05vsBC group;#P<0.05vs7-S group.
NPY的mRNA表达呈显著正相关(P<0.05);摄食量与POMC的mRNA表达呈显著负相关(P<0.05)。体重与摄食量无显著相关性(P>0.05),见表5。
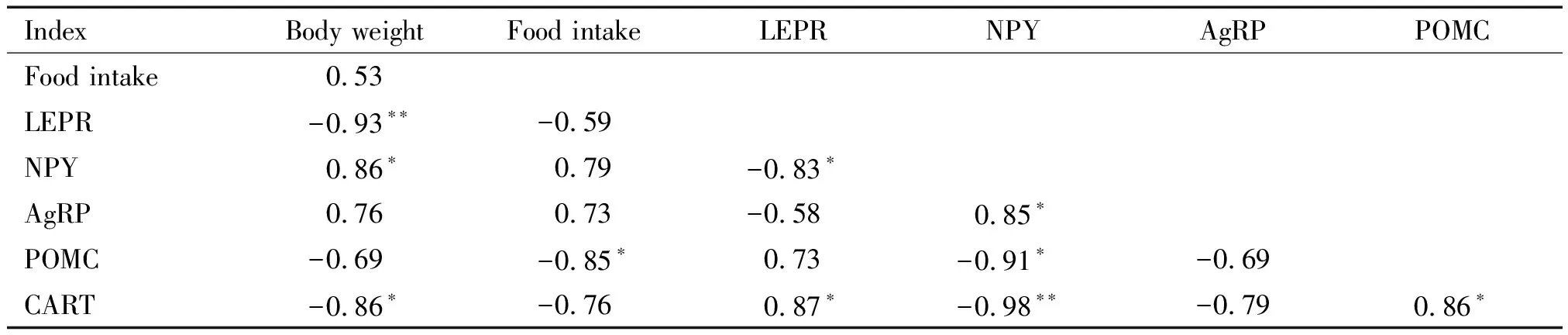
表5 21-S组大鼠体重、摄食量及下丘脑弓状核食欲因子mRNA表达的相关性
*P<0.05,**P<0.01.
讨 论
应激是机体整个适应、保护机制的一个重要组成部分。适度应激有利于机体在内外环境中保持自身稳态,而过强或持久、频繁的应激则可能诱发多种慢性疾病[2-4]。目前,束缚应激是研究动物心理应激反应最常用的模型之一[5]。束缚制动使动物躯体活动受限,并由此产生挣扎、愤怒、焦虑、无助和抑郁等一系列情绪变化及皮毛无光,耳廓淡白,食欲下降和体重减轻等躯体症状,这既很好地模拟了机体在应激状态下心理和生理的变化,又避免了造模本身对躯体的直接病理损伤[6-7]。本研究结果证实,束缚应激大鼠摄食量和体重较同期空白对照组大鼠明显下降,且应激时间越长,对体重增长影响越大,与前期研究结果一致[8],说明慢性束缚应激是影响机体能量储备的不利因素之一。
目前普遍认为,下丘脑是机体中枢维持能量平衡的核心,包含多个与食欲调控有关的神经核团,其中紧邻第三脑室的ARC作为一个食欲调节和能量平衡的综合体已成为广大研究人员关注的焦点[9-10]。ARC包含2组与摄食相关但作用相反的一级神经元NPY/AgRP和POMC/CART[11],这些神经元接收外周传入的营养信息后,协同调控NPY、AgRP、POMC和CART等食欲因子的合成和分泌,并通过神经纤维投射实现不同神经核团之间的信号传递,最终维持下丘脑“食欲调节网”的平衡。
瘦素是一种能感知自身能量状态的蛋白质类激素。作为食欲调节链上关键的一环,瘦素由白色脂肪细胞分泌后,通过外周和中枢(主导作用)2条途径参与机体能量代谢的调控。下丘脑ARC是瘦素中枢作用的关键部位。作为主要参与介导瘦素调节体重作用的功能性受体LEPR,在弓状核促食欲NPY/AgRP神经元及抑食欲POMC/CART神经元均显著表达[12-13]。经血液循环进入下丘脑的瘦素,通过与LEPR特异性结合,将饱食信号传递给该处的瘦素反应性食欲调控神经元,激活食欲调节网,从而全面启动摄食及能量平衡的瘦素调控通路。
下丘脑ARC的各种食欲因子是瘦素循环作用的直接靶点[14]。以往研究表明,NPY通过与ARC内广泛分布的NPY受体特异性结合,激发机体的摄食效应[15-16]。AgRP是一种较NPY更为强效和长效的食欲刺激素。表达于ARC的POMC在前转变素酶1的作用下释放其剪切产物α-促黑素细胞激素(α-melanocyte-stimulating hormone,α-MSH)和促肾上腺皮质激素,前者通过激活与机体新陈代谢密切相关的黑皮质素受体3/4(MC3-R/MC4-R),使机体产生饱腹感,并向其它脑区传达饱食的信号,以减少摄食行为[17]。同时对MC3-R和MC4-R高度敏感的AgRP可通过与之竞争性结合,从而抑制黑皮素受体信号,拮抗α-MSH 的抑制摄食作用[18]。CART广泛存在于与摄食及体重密切相关的脑区,与瘦素具有相互调节作用[19-20],其强大的抑食功能已在啮齿类动物和部分水生动物研究中被初步验证[21-23]。
本研究结果表明,应激因素对大鼠摄食行为及体重增长具有消极影响,并能显著提高其血清瘦素水平,下调ARC中促食欲因子NPY和AgRP表达,上调抑食欲因子POMC和CART表达。进一步的Pearson相关分析结果提示以NPY/AgRP和POMC/CART为代表的2类食欲因子表达失衡可能是慢性束缚应激大鼠出现摄食减少、体重增长缓慢的关键中枢神经内分泌基础之一,但具体作用机制及通路的研究有待进一步开展。本研究同时发现,应激大鼠体重与摄食量之间并无显著相关性,提示摄食量减少并非其体重增长延缓的唯一原因,很可能还与机体代谢水平有关,这已在本课题组基于代谢组学的相关研究中得到初步证实[24],并将成为我们下一步深入研究的关注点之一。

