颗粒细胞复合体在卵母细胞体外成熟培养中作用的研究
惠董娜,任文娟,冯晓琴,雷鑫,王治平,刘建荣,李弘
(山西省人民医院生殖医学科,太原 030012)
人卵母细胞体外成熟培养(in vitro maturation,IVM)自1991年获得首次成功妊娠后,取得了飞速发展,临床上已不仅限于多囊卵巢综合征(PCOS)的患者,而且在卵巢高/低反应患者、癌症患者生育力保存等方面也有了一定的应用[1]。目前,全世界范围内应用IVM技术出生的健康婴儿大约有5 000个,临床妊娠率可达到35%~40%[2]。虽有研究报道人未成熟卵母细胞经IVM后的成熟率可达70%,但IVM卵母细胞的发育潜能仍低于体内成熟的卵母细胞,表现在受精后卵裂率低、囊胚形成率和种植率低等方面[3],成为限制该技术应用和发展的重要因素之一。现有的培养体系多为单纯添加一些物质,难以达到卵母细胞IVM的最佳条件,影响卵母细胞IVM及随后的发育潜能[4]。本研究通过在培养液中添加成熟卵母细胞的颗粒细胞复合体,建立共培养体系,模拟体内卵母细胞生长的微环境,探索更适合ICSI-ET周期中卵母细胞IVM的培养条件,以期取得更好的IVM效果。
资料与方法
一、研究对象
根据《临床诊疗指南-辅助生殖技术与精子库分册》的标准,收集2015年1月至2017年6月在我院生殖医学科接受ICSI-ET治疗的156例不育患者促排卵周期中废弃的未成熟卵母细胞为研究对象。患者年龄21~38岁,平均年龄(29.96±4.37)岁,不孕年限1~10年,平均年限(3.82±2.67)年,治疗指征包括输卵管阻塞、少弱畸精子症和无精子症等。排除PCOS及子宫内膜异位症患者。本研究获得山西省人民医院生殖医学伦理委员会批准,经患者知情同意后签字进入本研究。
二、方法
1.卵母细胞采集:采用促性腺激素释放激素激动剂(GnRH-a,注射用醋酸曲普瑞林,辉凌制药,德国)和促性腺激素(FSH/HMG,果纳芬,雪兰诺,瑞士)联合长/短方案及微刺激方案。卵泡直径达到18 mm后,肌注HCG,36 h后B超引导下经阴道穿刺取卵,采集卵冠丘复合体(OCCC),取发育未成熟卵母细胞用于实验。
2.收集未成熟卵母细胞:符合研究标准且拟行ICSI-ET治疗的患者,取卵日收集OCCC后继续培养2~4 h后,用透明质酸酶80 U/ml(Quinn’s,SAGE,美国)处理OCCC,以机械法剥除卵丘颗粒细胞,在倒置镜下观察卵母细胞成熟度。剥除卵丘颗粒细胞的卵母细胞按成熟度分为:MⅡ期,即成熟卵母细胞,可见第一极体;MⅠ期,无第一极体也无生发泡;GV期,可见生发泡,收集MⅠ期、GV期卵母细胞用于IVM培养。
3.培养液及颗粒细胞复合体的准备:(1)IVM培养液的配制:HTF培养基+10%SPS+20%hFF +75 U/L FSH+75 U/L LH,充分混匀并用0.22 μm过滤器过滤,制成30 μl微滴置于共培养皿微孔中,覆盖矿物油,置于5%CO2培养箱中平衡;(2)卵丘颗粒细胞复合体的剥离:选取同一患者呈旭日状、放射冠与卵丘界限分明且具有粘附培养皿倾向的成熟的高质量卵母细胞,体视显微镜下(20×)用1 ml注射器前端针尖切割部分卵丘颗粒细胞团块组织,测微尺测量卵丘颗粒细胞团在500 μm,巴氏德吸管吸出,在未成熟卵母细胞培养液中洗涤数次,置于未成熟卵共培养皿微滴中。
4.未成熟卵母细胞分组及培养:将收集到的MⅠ、GV期未成熟卵母细胞以随机方式分组到对照组(C组,培养时不添加颗粒细胞复合体)和实验组(T组,培养时添加颗粒细胞复合体)中进行培养,并按照MⅠ期和GV期未成熟卵母细胞的不同分为4个亚组:MⅠ-C组、MⅠ-T组和GV-C组、GV-T组。对照组是将随机入组的未成熟卵母细胞置于IVM培养液配制的共培养皿微滴中;实验组将随机入组的未成熟卵母细胞置于IVM培养液配制的共培养皿微滴中,并加入同一患者的成熟卵母细胞的颗粒细胞复合体,将上述分组的未成熟卵母细胞置于5%CO2培养箱培养。
5.ICSI及胚胎培养:分别于培养后24 h、48 h观察卵母细胞的成熟情况,以排出第一极体为准,判断为成熟的MⅡ期卵母细胞,取出24 h成熟的卵母细胞后进行ICSI方式受精,受精后转入含卵裂液的胚胎培养皿中,在5%CO2培养箱中培养至第6 d,观察并记录胚胎发育情况。ICSI所用精子来自于同一患者前一日受精后留存的精子或当日IVF/ICSI受精后患者废弃的精子。卵裂期胚胎评分按照我科常规进行[5],囊胚期评分采用Gardner标准[6]。
6.观察指标:观察体外培养未成熟卵母细胞的成熟率(培养成熟的MⅡ卵数/培养的卵母细胞数)、正常受精率(2PN数/ICSI注射的卵母细胞数)、受精数(2PN+1PN+3PN/ICSI注射的卵母细胞数)、卵裂率(卵裂胚胎数/2PN 受精数)、优质胚胎率(优质胚胎数/卵裂胚胎数)以及囊胚形成率(囊胚数/可移植胚胎数)。
三、统计分析

结 果
一、未成熟卵母细胞IVM成熟情况的比较
本研究纳入156例ICSI-ET患者,共收集到305枚未成熟卵母细胞,其中MⅠ期卵母细胞186枚,GV期卵母细胞119枚,以随机方式入组到对照组(C组)和实验组(T组)进行培养,MⅠ-C组91枚、MⅠ-T组95枚、GV-C组59枚、GV-T组60枚。MⅠ-T组体外培养24 h成熟76枚(成熟率80.00%)显著高于MⅠ-C组(P<0.05);GV-T组体外培养24 h的成熟率与对照组比较无显著性差异(P>0.05)。体外培养48 h后,MⅠ-T及GV-T组卵母细胞成熟率显著高于同期对照组(P<0.01)(表1)。
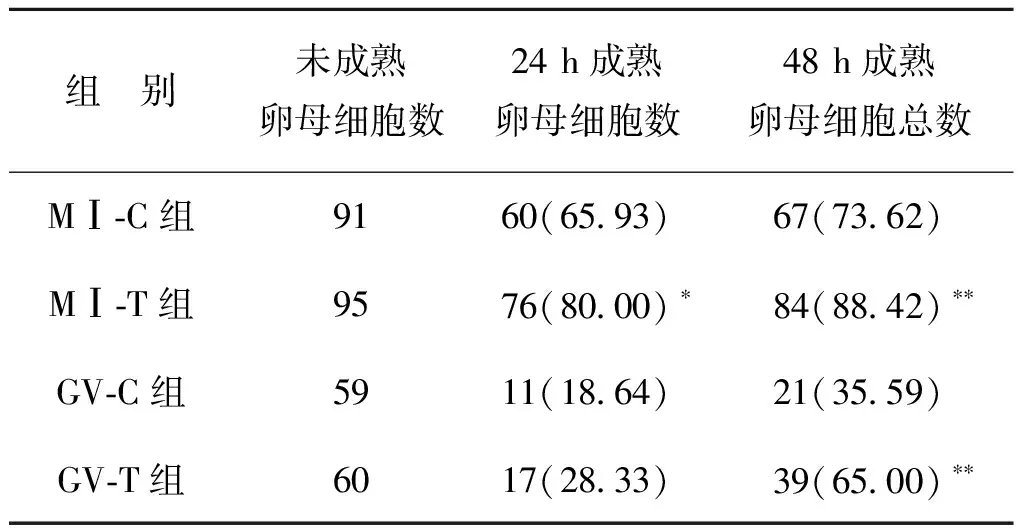
表1 未成熟卵母细胞IVM情况比较[n(%)]
注:与同期C组比较,*P<0.05,**P<0.01
二、未成熟卵母细胞体外培养24 h成熟后发育潜能的比较
体外培养24 h成熟的卵母细胞采用ICSI方式受精后观察胚胎发育情况:(1)MⅠ-T组培养24 h成熟卵母细胞76枚,正常受精率69.74%(53/76)、受精率75.00%(57/76)及优质胚胎率35.56%(16/45)均显著高于MⅠ-C组(P<0.05);两组的卵裂率比较无显著性差异(P>0.05)。与MⅠ-C组比较,MⅠ-T组囊胚形成数有所增加,但尚无显著性差异(P>0.05);MⅠ-T组卵母细胞利用率21.05%(16/76)显著高于MⅠ-C组(P<0.01)。(2)GV-T组与GV-C组的正常受精率、受精率及卵裂率比较均无显著性差异(P>0.05);GV-T组形成了1枚优质胚胎,但两组均未发育成囊胚,因数量少未行统计学分析;与GV-C组比较,GV-T组有一定的卵母细胞利用率,未行统计学分析(表2)。
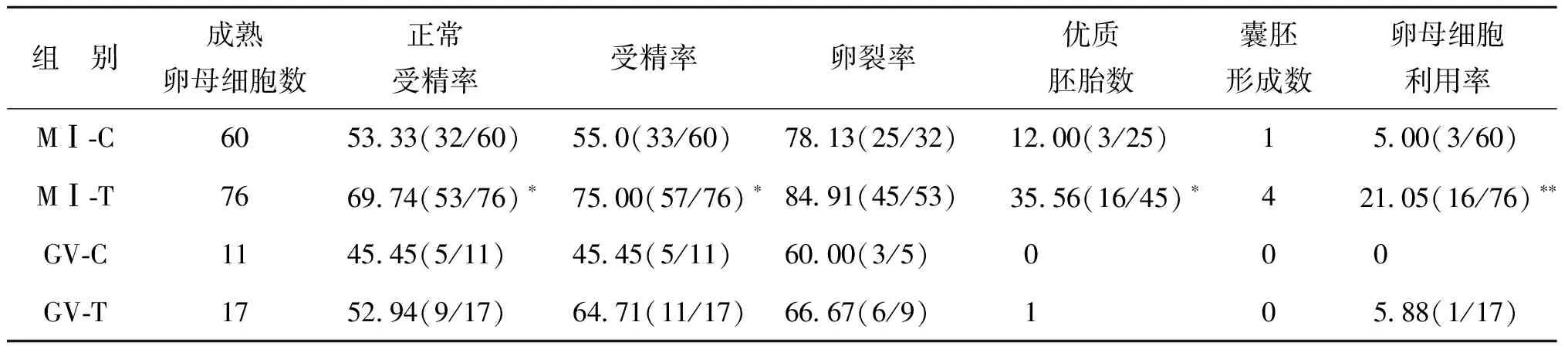
表2 未成熟卵母细胞体外培养24 h成熟后发育潜能比较(%)
注:与同期C组比较,*P<0.05,**P<0.01
讨 论
IVM技术在预防卵巢过度刺激、高剂量促性腺激素治疗所带来的风险上有着很好的优势,已报道的IVM临床妊娠率可达到45%~50%[7],因此,更加深入地研究IVM可扩大该技术的应用范围。常规促排卵周期中约有15%~20%的未成熟卵母细胞[8],通常会将其直接废弃,增加了部分患者的周期取消率。若能将这些卵母细胞充分利用,就可为他们增加一些妊娠机会。目前,对促排卵周期联合IVM的应用存在一定的争议,因促排卵周期中的未成熟卵母细胞经过HCG扳机作用,阻断了颗粒细胞上C型利钠肽(CNP)前体的分泌,导致卵母细胞内cAMP浓度降低,使减数分裂恢复启动,胞核成熟快于胞质的成熟[9-11],不同于通常意义上的IVM;而IVF/ICSI-ET周期中IVM的临床应用价值有限,还是能够挽救一部分卵母细胞,各方观点不同[11-13]。本研究采集到305枚未成熟卵母细胞,MⅠ期及GV期卵母细胞经IVM 48 h后分别获得了88.42%和65.00%的成熟卵率,MⅠ期来源成熟的卵母细胞正常受精率及优质胚胎率有所增加,并有一定数量的囊胚形成。我们认为,体外促排卵周期中获得的未成熟卵母细胞仍具有一定的发育潜能,可用来补充一次促排卵周期中胚胎的来源,提高卵母细胞的利用率。
IVM最为关键的环节是通过调整培养条件以满足卵母细胞成熟所需的营养物质,进而促使卵母细胞恢复正常的减数分裂。目前,体外培养系统多以基础培养基(如TCMl99、Ham’s、HTF等)中添加血清、蛋白质、促性腺激素(FSH和LH)、生长因子及类固醇激素等为主,可发育为MⅡ卵母细胞,但胚胎发育潜能较低[14]。近年来,培养体系研究已从单因素转向多因素联合,将卵丘颗粒细胞与未成熟卵母细胞体外共培养成为一个受关注的研究点。Jahromi等[15]将未成熟卵母细胞与颗粒细胞共培养的成熟率为84.28%,可利用胚胎率75.00%,表明颗粒细胞能够提高卵母细胞成熟率和胚胎发育潜能。颗粒细胞共培养通过模拟体内卵巢“微环镜”,与卵母细胞构成缝隙连接,通过双向交流,调节其成熟和发育能力,并可获得与体内成熟卵母细胞更为相似的基因表达谱[16]。本研究实验组中利用共培养皿上相互连通的培养孔建立了一个共培养体系,将剥离的颗粒细胞复合体置入以模拟体内的生长环境,使颗粒细胞复合体发挥旁分泌和自分泌作用,促进卵母细胞成熟和进一步发育。体外培养48 h后,与同期对照组相比,MⅠ-T组和GV-T组的卵母细胞总成熟率(分别为88.42%和65.00%)显著升高(P<0.01)。本研究进一步评估了成熟后卵母细胞的发育潜能,MⅠ期卵母细胞在含颗粒细胞复合体的培养液中培养24 h的成熟率为80.00%、正常受精率69.74%、受精率75.00%及优质胚胎率35.56%均显著高于对照组(P<0.05),且囊胚形成数也有所增加,表明颗粒细胞复合体在卵母细胞成熟中发挥着一定的作用。本研究中,MⅠ-T组的卵母细胞亦获得了较好的卵母细胞利用率,与之前报道的研究结果[4]相似。GV期卵母细胞培养24 h后,GV-T和GV-C两组间各指标比较均无显著性差异(P>0.05),GV期卵母细胞虽能发育成熟,但未能形成囊胚,添加颗粒细胞复合体的培养体系效果不够理想。推测其可能的原因有:(1)促排卵周期中大剂量促性腺激素的作用,使得GV期卵母细胞发育受到主导卵泡的影响;(2)本研究中的培养条件还不足以满足GV期卵母细胞胞质的成熟,可能与基础培养液、培养环境、培养时间等因素相关[17];(3)获取的GV期卵母细胞存在一些内在缺陷,在体内生长过程中受到了一定的抑制。
综上,IVM技术应用和发展了已有20余年,但受体外培养体系和胚胎发育潜能低等因素的影响,仍处于实验阶段,不能被广泛地应用于临床。本研究积极探索体外培养体系,通过体外构建含颗粒细胞复合体的共培养体系,提高了促排卵周期中不同来源未成熟卵母细胞的成熟率,改善了MⅠ期卵母细胞成熟后胚胎的发育潜能;而GV期卵母细胞成熟后的发育潜能尚不理想。本研究为我们后续的深入探索提供了方向,同时,我们也观察到对促排卵周期中获得的GV期未成熟卵母细胞可能需要在入选标准上做进一步研究,以提高IVM的效率和成果。

