HCG日血清雌激素水平对不同年龄段女性活产率的预测价值
董萌,邱佳慧,谭季春
(中国医科大学附属盛京医院生殖医学中心,沈阳 110072)
雌激素由卵巢颗粒细胞分泌,在促进卵母细胞成熟及子宫内膜种植过程中起着重要作用[1]。自Chenette等[2]在1990年第1次报道了雌激素水平对临床妊娠率的影响后,高雌激素水平对妊娠结局的影响始终争论不一。一些研究者认为雌激素水平对妊娠率有积极的影响[3-4],另一些研究者认为高雌激素水平可降低妊娠率[5-6],大部分研究者认为高雌激素对妊娠结局并没有影响[7-11]。不同的结论可能是因为研究方法的选取、患者纳入与排除标准、促排卵方案选择、移植胚胎发育天数、移植胚胎数以及雌激素分组标准不同造成的[11]。然而,雌激素水平是否可预测活产,尚缺乏高质量的研究。
很多因素影响体外受精-胚胎移植(IVF-ET)的成功率,如患者的年龄、优化的促排卵方案、胚胎质量及子宫内膜因素等。随着年龄的增长,卵母细胞及胚胎质量降低,非整倍体率增加[12]。年龄作为生育力评估的重要因素,可作为影响妊娠结局的独立因素[13],本研究根据HCG不同雌二醇(E2)水平将患者分为3组,同时又以不同的年龄段分为3个亚组,比较E2水平对活产率的影响,旨在探讨HCG日血清E2水平是否可预测活产率并分析影响活产率的相关因素。
资料与方法
一、研究对象与分组
1.研究对象:本文通过回顾性研究,选取2013年1月至2016年12月在中国医科大学附属盛京医院生殖中心行IVF/ICSI-ET助孕治疗的不育夫妇为研究对象,共4 200个周期。纳入标准:(1)第一次移植;(2)年龄<40岁。排除标准:(1)供卵移植患者;(2)供精移植患者;(3)患有影响胚胎着床的相关疾病:子宫内膜异位症、子宫纤维化、先天子宫畸形等;(4)患有影响妊娠过程的相关疾病:糖尿病、高血压、免疫系统疾病;(5)既往不良孕产史:胎儿生长受限、前置胎盘、胎盘早剥、先兆子痫;(6)胚胎植入前行遗传学诊断筛查;(7)患者临床与实验室观察指标数据不全或丢失;(8)失访患者。
2.分组:根据HCG日血清E2水平将患者分为3组,A组:E2≤9 175 pmol/L;B组:9 175 pmol/L
二、研究方法
1.促排卵方案:(1)长方案:在前一个周期的黄体中期开始每天使用短效促性腺激素释放激素激动剂(GnRH-a,达菲林,益普生,法国)0.05~0.1 mg降调节,达到降调节标准后,即子宫内膜厚度≤5 mm、双侧卵巢卵泡直径<10 mm、LH<5 U/L、E2<183.5 pmol/L,开始使用促性腺激素(Gn,果纳芬,默克雪兰诺,瑞士)促排卵。(2)短方案:于同次月经第2天开始给予GnRH-a 0.05 mg进行垂体降调节,于月经第3天开始使用Gn促排卵,同时检测卵泡生长情况以及雌激素水平。(3)拮抗剂方案:月经周期第2或第3天开始使用Gn,月经第8天给予拮抗剂(GnRH-ant,思则凯,默克雪兰诺,法国)0.25 mg,直至HCG注射日。(4)Gn方案:月经周期第2或第3天开始使用Gn,直至HCG注射日。(5)微刺激方案:月经第3~5天给予克罗米芬(高特,塞浦路斯)促排卵。
当主导卵泡中有1个直径达18 mm或3个达到17 mm时,肌肉注射HCG 5 000~10 000 U,36 h后经阴道超声下取卵。
2.IVF、胚胎体外培养及移植:本中心使用美国SAGE公司生产的Quinns系列培养液。收集到的卵母细胞放置于培养液(Quinn’s advantage fertilization)中培养4~6 h后进行体外人工授精,受精后16~18 h观察受精情况,将受精卵移入卵裂培养液(Quinn’s advantage cleavage medium)中,放置于37℃、5%CO2培养箱中再培养48 h,选择最好的1~3枚胚胎经超声引导下行宫腔内移植并将剩余胚胎冷冻保存。
3.优质胚胎评价标准:胚胎卵裂球数目第2天达到4个,第3天达到8个,胚胎卵裂球大小均匀,形状规则,透明带完整,胞质均匀清晰,没有颗粒现象,碎片在0~10%。
4.黄体支持及妊娠的诊断:移植后给予黄体酮注射液(浙江仙琚)80 mg每日肌肉注射,移植后14 d抽血检测血β-HCG,大于5 U者于移植后35 d行超声检查,发现孕囊和胎心搏动者确定为临床妊娠。
5.观察指标:所有患者的临床与实验室数据均来自中国医科大学附属盛京医院临床生殖医学数据库。本研究收集与分析的指标包括:患者年龄、体重指数(BMI)、不孕年限、Gn用量、基础FSH、HCG日E2水平、子宫内膜厚度、移植胚胎数、促排卵方案、受精方式、获卵数、受精数及优质胚胎数。
三、统计分析

结 果
一、A、B、C三组患者的一般资料分析
本研究共纳入4 200个IVF/ICSI治疗周期。其中A组1 467周期(A1组363周期,A2组668周期,A3组436周期),B组1 293周期(B1组439周期,B2组604周期,B3组250周期),C组1 440周期(C1组452周期,C2组673周期,C3组315周期)。A、B、C三组之间年龄、BMI、Gn用量、血清基础FSH、促排卵方案、受精方式、HCG日E2、获卵数、移植胚胎数、受精率及优质胚胎率比较均存在统计学差异(P<0.05);不孕年限、子宫内膜厚度比较无显著性差异(P>0.05)。
二、年龄<30岁3亚组患者一般资料、促排卵情况及妊娠结局比较
一般临床资料分析显示,A1组BMI显著高于B1、C1两组,HCG日E2、获卵数显著低于B1、C1两组;C1组Gn用量显著低于A1与B1组;促排卵方案比例比较,C1组短方案比例最高,A1组拮抗剂与微刺激方案比例显著高于B1、C1组;受精方式比较显示,A1组IVF受精方式比例显著高于C1组,C1组IVF+ICSI受精方式比例显著高于其余两组;A1组优质胚胎率显著高于B1、C1组(P<0.05)。3组患者的年龄、不孕年限、血清基础FSH、子宫内膜厚度、移植胚胎数、受精率比较均无显著性差异(P>0.05)(表1)。
统计结果显示,A1、B1、C1三组中,B1组的活产率、临床妊娠率及种植率显著高于其他两组(P<0.05);而生化妊娠率、胚胎停育率、流产率、异位妊娠发生率组间比较无显著性差异(P>0.05)(表2)。
三、30~<35岁3亚组患者一般资料、促排卵情况及妊娠结局比较
一般临床资料分析显示,A2组BMI、基础FSH显著高于B2、C2两组,C2组的HCG日E2、获卵数显著高于A2、B2两组,B2组Gn用量显著高于C2组(P<0.05);促排卵方案比较,B2组长方案比例显著高于A2组,A2组短方案比例显著低于其余两组,微刺激方案比例显著高于其余两组,C2组拮抗剂方案比例最低,显著低于其余两组(P<0.05);受精方式比较显示,C2组IVF+ICSI受精方式比例显著高于其余两组(P<0.05);A2组受精率、优质胚胎率显著高于B2、C2两组(P<0.05)。而3组之间年龄、不孕年限、子宫内膜厚度、移植胚胎数比较均无显著性差异(P>0.05)(表3)。
妊娠结局的统计结果显示:B2组活产率显著高于C2组(P<0.05);而临床妊娠率、生化妊娠率、胚胎停育率、流产率、异位妊娠发生率和种植率3组间无显著性差异(P>0.05)(表4)。

表1 年龄<30岁患者一般资料及促排卵情况比较[(-±s),n(%)]
注:与A1组比较,*P<0.05;与C1组比较,#P<0.05

表2 年龄<30岁患者妊娠结局比较(%)
注:与B1组比较,*P<0.05
四、35~<40岁3亚组患者一般资料、促排卵情况及妊娠结局比较
一般临床资料分析显示,A3组年龄显著高于C3组(P<0.05);A3组Gn用量、HCG日E2、移植胚胎数、获卵数显著低于B3、C3两组,基础FSH显著高于B3、C3两组(P<0.05);促排卵方案比较,C3组长方案比例显著高于其余两组,而Gn方案比例显著低于其余两组(P<0.05);A3组短方案比例显著低于其余两组,而微刺激方案比例显著高于其余两组,拮抗剂方案比例显著高于C3组(P<0.05);受精方式比较显示,C3组IVF+ICSI受精方式比例显著高于A3、B3两组;A3组受精率、优质胚胎率显著高于B3、C3两组(P<0.05);而3组之间BMI、不孕年限、内膜厚度等无显著性差异(P>0.05)(表5)。
A3、B3、C3三组之间临床妊娠、生化妊娠率,胎停、流产、异位妊娠发生率、种植率、活产率均无显著性差异(P>0.05)(表6)。

表3 30~<35岁患者一般资料及促排卵情况比较 [(-±s),n(%)]
注:与A2组比较,*P<0.05;与C2组比较,#P<0.05

表4 30~<35岁患者妊娠结局比较(%)
注:与B2组比较,*P<0.05

表5 35~<40岁患者一般资料及促排卵情况比较 [(-±s),n(%)]
注:与A3组比较,*P<0.05,与C3组比较,#P<0.05

表6 35~<40岁患者妊娠结局比较(%)
五、ROC曲线与逻辑回归分析模型评估E2水平与活产率相关性
年龄<30岁、30~<35岁及35~<40岁3亚组ROC曲线下面积分别为0.497(95%CI:0.465-0.529)、0.505(95%CI:0.475-0.535)及0.516(95%CI:0.470-0.561)。结果显示E2水平不能预测活产率,两者之前没有显著相关性。
患者年龄<30岁时,促排卵方案和优质胚胎率作为独立预测因素与活产率显著相关(表7)。当年龄30~<35岁时,促排卵方案和优质胚胎率作为独立预测因素与活产率显著相关(表8)。当年龄35~<40岁时,获卵数、移植胚胎数及优质胚胎率作为独立预测因素与活产率显著相关(表9)。进一步验证了HCG日雌激素水平与活产率没有显著相关性。
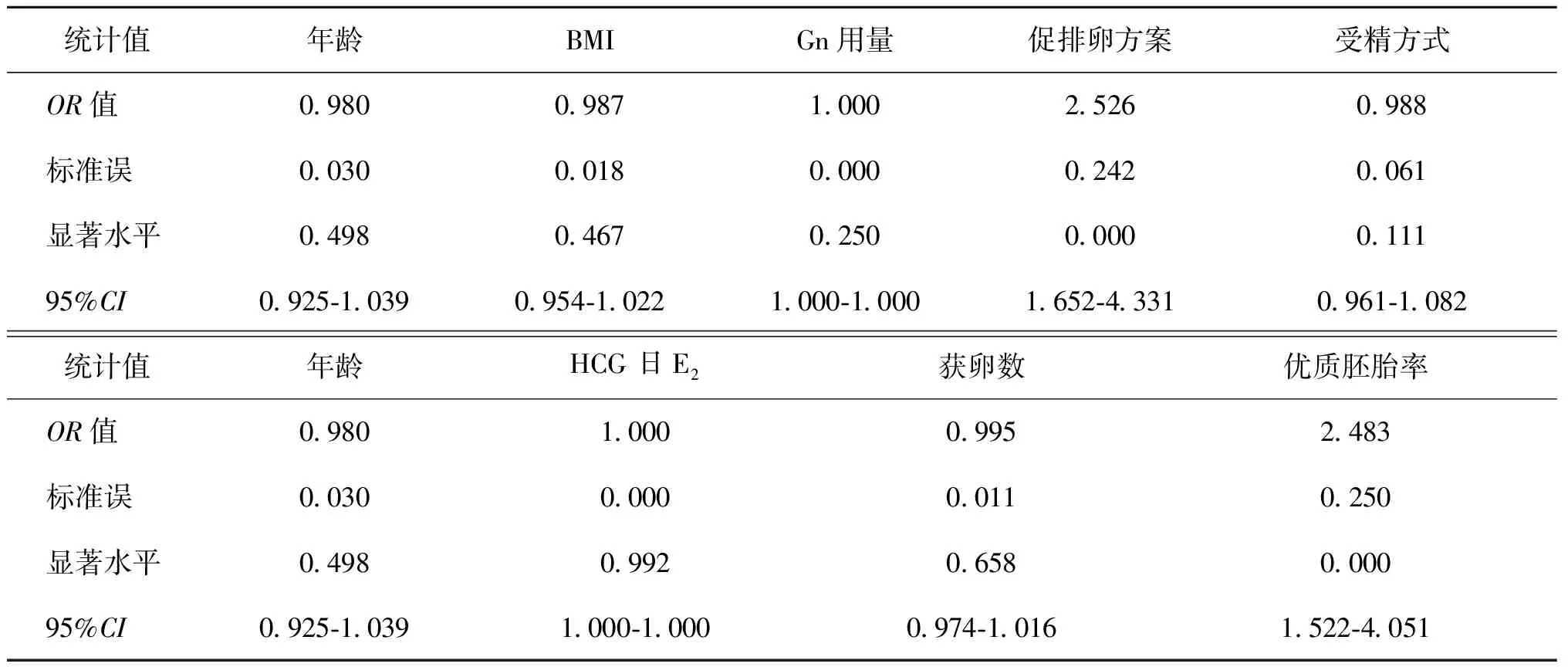
表7 年龄<30岁的Logistic回归模型

表8 30~<35岁的Logistic回归模型
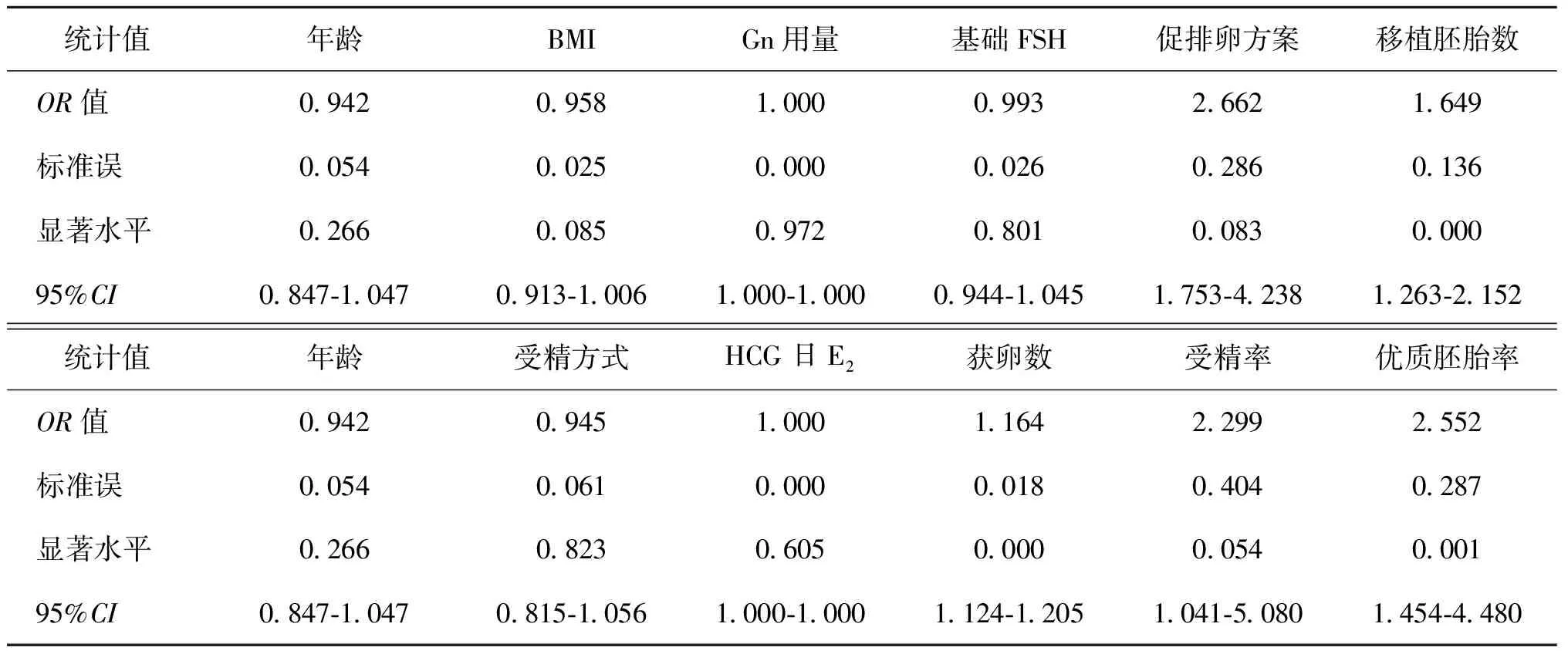
表9 35~<40岁的Logistic回归模型
讨 论
对血清雌激素水平的密切观察是评估促排卵临床反应性的主要指标[14],但HCG日雌激素水平对活产率预测价值仍不清楚。目前为止,并没有高质量的研究表明HCG日血清雌激素水平是否对活产率有明确的影响。本研究的目的是探讨血清雌激素水平是否可作为预测活产率的指标。
本研究共纳入了2013年1月至2016年12月在中国医科大学附属盛京医院生殖中心行IVF/ICSI治疗的不孕不育夫妇共4 200个周期,以保证有足够的样本量更加客观地阐释结果。在不同的研究中对于高雌激素临界值的定义并没有统一的标准,Imudia等[15]研究中,HCG日高雌激素临界值定义为12 662 pmol/L,Wu等[16]研究定义为19 124 pmol/L,Imudia等[17]研究定义为10 977 pmol/L,Pereira 等[18]研究定义为11 264 pmol/L,Wang等[19]研究定义为13 788 pmol/L。高雌激素临界值的不同定义有可能是因为选择的纳入标准、促排卵方案和试剂盒等的不同所造成的[19]。为使得结论更加客观,本研究中按照雌激素水平将患者平均分为3组:低雌激素组:E2≤9 175 pmol/L,中雌激素组:9 175 pmol/L
Steiner等[13]的研究报道女性生育力随着年龄增长显著降低,与30~31岁女性相比,34~35岁女性生育力降低14%,36~37岁女性降低19%,38~39岁女性降低30%,40~41岁女性降低53%,42~44岁女性降低59%。由于年龄是决定ART成功率的重要因素,因此,为了避免年龄造成的选择性偏倚,本研究将患者按照年龄分成了不同的亚组。
有研究发现,对于年龄小于38岁的女性,E2最佳范围是11 010~14 680 pmol/L,且研究结果显示HCG注射日E2水平与活产率并无相关性[20]。本研究发现当患者年龄小于35岁时,雌激素水平在9 175~16 515 pmol/L时,活产率最高,与以往的研究结果一致。Basir等[21]研究结果显示卵巢高反应患者活产率降低,认为卵巢高反应患者的雌激素水平过高,子宫内膜腺体和间质细胞之间发育不同步,内膜环境不利于胚胎着床,导致子宫内膜容受性下降,另外高反应患者子宫内膜血流的变化也会影响子宫内膜的容受性。本研究中年龄<30岁,E2>16 515 pmol/L组患者为卵巢高反应患者(平均获卵数达到15枚),其活产率明显低于同年龄段卵巢正常反应人群,这与Basir等[21]的研究结果一致。
为了进一步研究高雌激素是否对活产率有影响,ROC曲线和Logistic回归分析模型被用于评估雌激素水平是否可预测活产,结果显示两者之间并没有显著相关性。本研究也进一步证实了IVF中决定成功率关键因素为最优化的促排卵方案提供最优质的胚胎[1]。本研究发现,随着雌激素水平增加,优质胚胎比率降低,因此高雌激素可能影响胚胎质量从而造成活产率的降低。这与Zavy等[11]的研究结果一致,他们的研究认为决定活产的主要因素为胚胎质量、年龄和移植胚胎数目,调整胚胎质量后,高雌激素水平对于活产率并无影响。然而Kyrou等[10]研究认为在拮抗剂方案中,高雌激素并不影响妊娠结局,但是可提高胚胎质量,这也许是因为雌激素临界值及促排卵方案的不同造成的。
Arce等[22]研究也认为雌激素水平与活产率无显著相关性,卵泡中期HCG水平可作为阳性预测因素,而年龄和卵泡中期孕激素水平是阴性预测因素。本研究通过Logistic回归分析发现,当年龄小于35岁时,促排卵方案与优质胚胎率与活产率显著性相关;当年龄35~<40岁时,获卵数、移植胚胎数与优质胚胎率与活产率显著性相关。
综上所述,本研究结果提示,HCG日雌激素水平并不能预测活产率,优化的促排卵方案和优质胚胎率可作为影响妊娠结局的独立因素。

