三阳清解液乙状结肠滴注对内毒素诱导大鼠发热模型解热机制的研究
汤瑞莲,王晓燕
(郑州市中医院,河南 郑州 450007)
小儿外感发热是儿科常见病、多发病,属中医“感冒”范畴,小儿患病“传变迅速”,易入里化热,小儿“脾常不足”,感邪之后易乳食停滞,故小儿感冒以风热夹滞证多见,而小儿脏腑薄、藩篱疏,易于传变,往往太阳表证未解而病邪即入少阳半表半里,正邪交争,引动胆经郁热,上迫心神,横逆犯胃,而致小儿就诊时大多太阳、少阳、阳明三阳症并见。三阳清解液是河南省首届名中医王晓燕教授用于治疗小儿外感发热(风热夹滞型)的临床效验方,依据张仲景六经辨证理论,在柴葛解肌汤、大柴胡汤、白虎汤基础上衍化而来,临床使用二十余年,疗效确切[1-2]、不良反应小。本研究通过观察三阳清解液乙状结肠滴注对LPS诱导发热模型大鼠下丘脑cAMP、PGE2含量和血清IL-1β、TNF-α、PGE2的含量的影响,旨在探讨其可能的解热机制,为临床应用提供实验依据和理论指导。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
Wistar大鼠,级别:SPF级;雌雄各半;购自北京维通利华实验动物技术有限公司。
1.1.2 实验药物
三阳清解液组:葛根5 g,柴胡12 g,黄芩10 g,生石膏30 g,生栀子10 g,莪术6 g,生大黄4 g,甘草3 g,以上为1剂量,水煎、过滤和浓缩,制备浓缩成每毫升含生药80 g的水煎液,装瓶备用,根据实验需要调制所需浓度;由郑州市中医院制剂室提供;泰诺林混悬液(对乙酰氨基酚口服混悬液),规格:3.2 g/100 mL,上海强生制药有限公司生产,批号161223070。
1.1.3 实验试剂
脂多糖(LPS)(100 mg),购自索莱宝科技有限公司;氯化钠注射液(0.45 g,250 mL),河南太龙药业有限公司;大鼠环磷酸腺苷(cAMP)、前列腺素E2(PGE2)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)ELISA试剂盒,均购自深圳子科生物科技有限公司。
1.1.4 实验仪器
MC-347欧姆龙电子体温计,大连欧姆龙有限公司生产TDL80-2B离心机,SpectraMax190型酶标仪(美国热电),上海安亭科学仪器厂生产;HW-1000超级恒温水浴,成都泰盟软件有限公司生产;BT100-2J蠕动泵驱动器,保定兰格恒流泵有限公司生产。
1.1.5 致热源及发热模型制备
致热源制备:无菌条件下,用0.9%氯化钠溶液将脂多糖(LPS)配成20 mg/L注射液,备用。
发热模型制备:实验前12 h,禁食不禁水。灌肠给药后立即造模:空白组腹腔注射0.9%氯化钠注射液1 mL/kg,其余各组大鼠分别腹腔注射的LPS(20 μg/kg,1 mL/kg)建立大鼠发热模型。
1.2 方法
1.2.1 动物筛选、分组及用药
实验给药前,每天上下午定时(上午8∶30,下午4∶30开始)对大鼠进行适应性测量口腔温度1次,连续2 d,取两次体温的平均值记为基础体温。测量时保持时间、地点、环境条件的一致性,测量探头从大鼠口角插入口腔舌下并保证每次定位角度一致,动作轻柔防止体温应激性增高。体温超过正常范围或相邻两次体温差值大于0.5℃的动物剔除。选用基础体温合格的大鼠40只,随机分为4组,每组10只,雌雄各半。分别为①空白组:腹腔注射生理盐水1 mL/kg;②模型组:腹腔注射20 μg/kg LPS,1 mL/kg;③对乙酰氨基酚组:予对乙酰氨基酚口服混悬液,4 mL/kg灌胃给药;④三阳清解液组:腹腔注射20 μg/kg LPS,1 mL/kg;30 mL/kg的相应药物约按20滴/min的速度乙状结肠滴注给药。
1.2.2 乙状结肠滴注给药
为了更好地检验浙江省对外直接投资对出口贸易和进口贸易的不同影响,本文建立如下出口效应模型和进口效应模型:
将筛选好的各组大鼠用固定筒固定好,使其保持安静状态且臀部轻微向上抬起,灌肠给药前先轻轻挤出直肠内残留的粪便,将药瓶连接涂有石蜡的一次性滴注导管,将其轻缓插入肛门3 cm,以20~25滴/min的速度滴注给药,药物全部滴入后,导尿管停留片刻再轻缓退出,并使大鼠继续保持灌肠时的姿势,以避免灌肠药物流出影响药效。灌肠给药前12 h各组大鼠禁食不禁水,以减少粪便对药物的干扰。
1.2.3 标本制备
血标本制备:各组大鼠于给药后6 h将大鼠麻醉后,采用腹主动脉采血5 mL留取血标本,然后以3 000 r/min,离心15 min,分离血清,置于-80℃冰箱冷冻,待ELISA检测用。
下丘脑标本的制备:各组大鼠于腹主动脉采血后立即断头处死动物,沿矢状缝剪开皮肤,剥去两侧顶骨、颞骨和硬脑膜,迅速取出脑组织,根据解剖标志(视交叉、乳头体为前后界,左右下丘脑沟为侧界,深约4 mm),制备下丘脑组织块约4 mm×4 mm×4 mm。然后立即把一半下丘脑组织放入冻存管,置液氮中速冻后保存于-80℃冰箱,待ELISA检测用。
1.3 观测指标
1.3.1 体温
造模后1、2、3、4、5、6 h测量口温,计算各组大鼠在各测温点的升温值(△T=实测体温-基础体温),测量体温的同时,观察大鼠皮肤、毛色、肢体、精神状况、饮食、饮水、大小便、呼吸、体质量的变化情况。
1.3.2 下丘脑及血清指标
1.4 统计方法
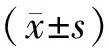
2 结果
2.1 给药6 h内各组大鼠体温变化趋势
如表1所示:模型组大鼠体温明显上升,与空白组对比存在显著性差异(P<0.05),体温呈典型的双峰热,在2 h、5 h有2个热峰,升温值达到1.43℃,且实验过程中观察到部分发热模型大鼠出现精神萎靡、竖毛、寒颤的症状,表明LPS发热大鼠模型造模成功,与报道[3-5]相符;与模型组比较,三阳清解液组和对乙酰氨基酚组体温下降明显(P<0.05);三阳清解液组与对乙酰氨基酚组在给药1、2 h退热效果比较,差异有统计学意义(P<0.05) ,而在给药4、5、6 h比较,差异无统计学意义(P>0.05) ,说明三阳清解液组可以显著降低发热大鼠的体温,且作用时间长,不易反弹。
2.2 给药后发热大鼠下丘脑cAMP、PGE2含量变化比较
如表2所示:造模给药6 h后,模型组大鼠下丘脑组织匀浆中cAMP、PGE2含量较空白组显著升高(P<0.01)。与模型组比较,对乙酰氨基酚组能够明显减低发热大鼠下丘脑组织匀浆中cAMP、PGE2含量(P<0.01),三阳清解液组对发热大鼠下丘脑组织匀浆中cAMP、PGE2的水平也有一定的抑制作用(P<0.05);与对乙酰氨基酚组比较,三阳清解液组下丘脑组织匀浆中cAMP含量,差异有统计意义(P<0.05),PGE2含量,无明显差异(P>0.05)。
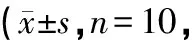
表1 各组大鼠给药后不同时间△T的变化比较℃)
注:与空白组比较,△P<0.01;与模型组比较,#P<0.05,##P<0.01;与对乙酰氨基酚组比较,☆P<0.05
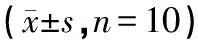
表2 各组大鼠下丘脑cAMP、PGE2含量变化比较
注:与空白组比较,△P<0.01;与模型组比较,#P<0.05,##P<0.01;与对乙酰氨基酚组比较,☆P<0.05
2.3 给药后各组大鼠血清中IL-1β、TNF-α、PGE2含量变化比较
如表3所示:造模给药6 h后,模型组动物血清中IL-1β、TNF-α、PGE2含量较空白组显著升高(P<0.01);与模型组比较,对乙酰氨基酚组及三阳清解液组能够明显减低发热大鼠血清中IL-1β、PGE2的含量(P<0.01),三阳清解液组对发热大鼠血清中TNF-α的水平也有一定的抑制作用(P<0.05);与对乙酰氨基酚组比较,三阳清解液组血清中TNF-α差异有统计意义(P<0.05),而IL-1β、PGE2无明显差异(P>0.05)。
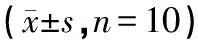
表3 各组大鼠血清中IL-1β、TNF-α及PGE2含量变化比较
注:与空白组比较,△P<0.01;与模型组比较,#P<0.05,##P<0.01;与对乙酰氨基酚组比较,☆P<0.05
3 讨论
发热是由于发热激活物刺激内生致热原细胞产生内生致热原,内生致热原通过中枢发热介质作用于体温调节中枢而使体温调定点上移而引起的调节性体温升高。PGE2、cAMP是目前公认的体温调节中枢发热介质[6-10],IL-1β和TNF-α是目前公认的可诱导发热的重要炎性递质[11-13],对乙酰氨基酚属非甾体抗炎药,其机理是抑制体内PGE2等的合成,阻止致热源引起的发热反应。LPS是目前公认的导致发热效应很强的外源性致热源之一,是革兰阴性细菌内毒素的活性成分,它能够刺激机体产生内生性致热原,引起强烈的炎症反应,从而使体温升高[14]。诸多研究[15-16]显示腹腔注射小剂量LPS(20 μg/kg)可成功诱导出大鼠发热模型。动物注射LPS后可引起下丘脑PGE2、cAMP含量升高,且与体温升高呈显著性正相关[17],IL-1β和TNF-α作为引起发热的重要内生致热源在LPS发热中起着重要作用[11-13]。本实验采用腹腔注射LPS建立大鼠发热模型,大鼠血清中的TNF-α均显著性升高,这与Liu等[18]的结果相一致,注射LPS剂量为20 μg/kg可引起典型的双峰热,与王雪峰等[11]报道一致。
三阳清解液方主要由葛根、柴胡、黄芩、生石膏、生栀子、莪术、生大黄、甘草等组成。方中葛根辛凉解肌入太阳;柴胡轻清升散,黄芩清泻相火,和解少阳;大黄荡涤阳明腑热;石膏清阳明气分之实热;栀子苦寒,能清三焦湿热;莪术活血化瘀、消积行气;全方共奏辛凉解表、和解少阳、清泻阳明之效。采用乙状结肠滴注的给药途径,有效解决了“小儿吃药怕苦、打针怕疼”的难题,大大提高了依从性;在研究前期我们发现三阳清解液乙状结肠滴注时反复测肛温会刺激大鼠肛门,致灌肠药物流出,为了不影响药物效果及体温测定,我们采用测口温的方法;同时采用恒温水浴保证药物在37.0℃左右,避免了温度过高、过低对大鼠造成不适;另外,采用恒流泵泵入的方法解决大鼠在灌肠过程中因为腹压过大等,造成滴注缓慢或不滴等问题,经过以上技术上的改良,保证了实验的合理性及可操作性;相关前期研究发现[1]三阳清解液乙状结肠滴注对LPS诱导的发热模型大鼠有良好的解热作用,且有较好的剂量依赖性,其解热效果可能与其抑制发热大鼠血清中IL-6、MIP-1的含量相关,本研究在此基础上调整实验设计方案,完善相关检测指标,以期通过观察三阳清解液对LPS诱导发热模型大鼠体温及下丘脑中发热介质和血清中致热因子含量的影响,探讨其可能的解热机制。
本研究发现LPS造模后大鼠呈典型的双峰热,模型组大鼠体温明显上升(P<0.05),提示造模成功;三阳清解液能明显降低发热大鼠体温,三阳清解液组与对乙酰氨基酚组在给药1、2 h退热效果比较,差异有统计学意义(P<0.05) ,而在给药4、5、6 h比较,差异无统计学意义(P>0.05) ,说明三阳清解液组可以显著降低发热大鼠的体温,且作用时间长,不易反弹;与空白组比较,模型组大鼠下丘脑cAMP、PGE2及血清IL-1β、TNF-α、PGE2含量显著升高(P<0.01);与模型组比较,对乙酰氨基酚及三阳清解液组大鼠下丘脑cAMP、PGE2及血清IL-1β、TNF-α、PGE2含量显著下降(P<0.05),其中三阳清解液组下丘脑PGE2及血清IL-1β、PGE2与对乙酰氨基酚组无显著差异(P>0.05)。
综上所述,三阳清解液对LPS诱导的发热大鼠模型有良好的解热作用,且作用稳定持久,其机制可能与通过下调大鼠下丘脑cAMP、PGE2水平,从而抑制血清IL-1β、TNF-α、PGE2的表达有关。

