胃间质瘤的临床病理特征及内镜下治疗评价
李素琴, 朱晓芸, 李 夏, 于红刚
湖北省人民医院消化内科,湖北 武汉 430060
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是最常见的胃肠道间叶源性肿瘤,起源于胃肠道神经丛中起搏细胞Cajal细胞的前体细胞,约占胃肠道间叶肿瘤的70%[1],占所有胃肠道恶性肿瘤的1%~2%[2],多见于胃(55.6%)及小肠(31.8%),少数见于结直肠(5%~6%)、阑尾、食管(0.7%)[2-5],罕见的间质瘤也可发生于网膜、肠系膜、膀胱、胆囊、胰腺、腹膜后腔、子宫。GIST确切病因尚未完全阐明,目前认为与基因改变相关,80%~95%存在c-kit及血小板衍生生长因子受体-α(PDGFRA)基因突变。间质瘤的确诊依靠病理组织学检查及免疫组织化学染色,典型的间质瘤有CD117和CD34的阳性表达。间质瘤具有潜在恶性,早期诊断和治疗尤为重要,过去多采取开腹及腹腔镜手术治疗,近年来,随着内镜技术的发展,且内镜下治疗具有“创伤小、费用少、并发症少”的优势,已代替外科手术成为间质瘤的主要治疗方式。现就我院胃间质瘤的治疗情况报道如下。
1 资料与方法
1.1一般资料收集2013年12月3日至2018年1月3日在我院行内镜下治疗且术后病理确诊为胃间质瘤的患者136例,已排除合并消化道其他肿瘤及有常规内镜治疗禁忌证者,患者术前均签署知情同意书。
1.2术前准备普通胃镜发现胃内隆起灶后,术前完善超声内镜了解病灶大小及浸润深度,行上腹部平扫(增强)CT了解瘤体腔内、腔外生长情况、有无转移等。术前三大常规、心电图、胸片、肝肾功能、凝血五项检查均在全身麻醉允许范围。如术前有服用抗血小板药物,需术前停服7 d,术前禁食8 h。
1.3手术方法所有患者在气管插管、全身麻醉下进行手术,术中监测患者生命体征及血氧饱和度,行内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)或内镜下全层切除术(endoscopic full-thickness resection,EFTR)治疗。
1.4术后处理术后标本连续切片,行全层病理检查及免疫组化。术后置入胃管行胃肠减压,禁食3 d,常规予以止血、抑酸、抗感染、营养支持治疗。观察患者有无腹痛、发热、黑便、呕吐及胃管内胃液颜色。3 d后逐渐由流质饮食过渡到半流质饮食。
1.5并发症定义(1)出血定义:术中出血:术中出现反复动脉出血,或血红蛋白下降>20 g/L或需进行输血治疗或出现血流动力学不稳定需外科止血等的情况;术后迟发性出血:术后24 h~30 d内发生的呕血、黑便、血便,或血红蛋白下降≥20 g/L,并需要内镜介入检查或止血的情况[6];(2)穿孔定义:术中穿孔:术中可见网膜及腹腔脏器,或术中微穿孔术后经CT或X光等检查证实存在腹腔游离气体;术后穿孔:术后出现穿孔表现并经内镜或外科手术证实存在穿孔;(3)感染定义:术后1~2 d体温高于38.5 ℃,且白细胞计数>10×109L-1,并排除其他原因引起的发热。
2 结果
2.1临床特征136例胃间质瘤患者中男44例,女92例,年龄(55.41±9.55)岁。发病年龄26~74岁,集中在41~60岁(57.4%)。62例患者无明显临床症状,74例患者表现为消化道症状,多为腹痛、腹胀(57例),少数为上腹不适、胸部不适、黑便、进食梗阻感、嗳气、反酸。136例患者共发现胃间质瘤138个,病变位于胃底91个,胃体28个,贲门7个,胃窦6个,胃底近贲门处3个,胃体胃底交界3个。肿瘤大小(1.48±1.36)cm(0.1~10.0 cm),直径≤1.0 cm 82个,1.1~2.0 cm 33个,2.1~5.0 cm 21个,5.1~10.0 cm 2个。
2.2内镜及影像学表现138个瘤体普通内镜下表现为圆形、半圆形、卵圆形、结节状的黏膜下隆起,表面光滑。136例患者中113例行超声胃镜检查,共检出瘤体114个,结果显示:起源于固有肌层107个,其中低回声101个,混合回声4个,低回声伴片状强回声1个,低回声伴片状高回声1个;起源于黏膜肌层4个,均为低回声;起源于黏膜下层3个,其中无回声1个,低回声1个,混合回声1个。136例患者中86例行上腹部平扫(增强)CT检查,结果显示:35例未发现异常,30例显示局部胃壁增厚,8例显示结节灶,8例显示肿块、团块影,5例显示异常密度灶。
2.3病理信息病理学检查结果显示:138个瘤体均为胃间质瘤,137个为梭形细胞型,其中2个部分细胞存在异型性;1个为混合细胞型(梭形细胞与上皮样细胞型混合存在)。135个核分裂象≤5/50 HPF,3个核分裂象>5/50 HPF且<5/10 HPF。CD117阳性表达率为92.8%(128/138),CD34阳性表达率为95.7%(132/138),DOG-1阳性表达率为92.8%(128/138),Ki-67阳性表达率为80.4%(111/138)。根据HIN危险度分级,极低危115个,低危21个,中危2个。
2.4内镜治疗及并发症情况34例(34个瘤体)行EFTR治疗,一次性完整切除率100%(34/34)。其中2例发生术中出血,经高频电凝钳及氩气处理后止血成功;1例发生术后穿孔及迟发性出血,于术后9 h出现呕吐自行拔除胃管并拒绝行胃肠减压,术后12 h出现术后迟发性出血及穿孔,转外科行胃穿孔修补术。
102例(104个瘤体)行ESD治疗,一次性完整切除率99.0%(103/104),其中10例发生术中穿孔,均经内镜下钛夹封闭或钛夹加尼龙绳行“荷包缝合”法闭合;1例发生术中出血,经高频电凝钳及氩气处理后止血成功。3例发生术后迟发性出血,其中2例经急诊胃镜行钛夹及高频电凝处理后止血成功,另1例为瘤体成分叶状且瘤体由胃窦通过幽门延伸至十二指肠球部行部分切除,术后6 d出现迟发性出血转入外科治疗。
其中2例瘤体直径5.1~10.0 cm的患者考虑外科治疗创伤大、费用高,强烈要求行内镜下治疗,经充分知情告知及签字后行内镜下治疗,内镜下治疗均未出现并发症。直径5.5 cm的瘤体分次完全取出,直径10 cm的瘤体分次取部分瘤体送检,最终仍有部分瘤体过大无法完全取出,手术第10天复查胃镜未见残余瘤体,考虑瘤体随大便排出体外。
同时检出2个间质瘤的2例患者未出现并发症。术后住院天数(7.32±2.10)d(4~20 d)。
两种不同内镜下治疗方式的治疗效果比较见表1,ESD组术后感染率、术中穿孔率、术中出血+穿孔率小于EFTR组(P<0.05),两组间患者年龄、肿瘤大小、完整切除率、术中出血率、术后迟发性出血率、术后出血+穿孔率、术后住院天数比较,差异无统计学意义(P>0.05)。
单因素分析显示:ESD治疗发生迟发性出血在不同病灶部位(P<0.001)及瘤体大小(P=0.003)方面差异有统计学意义(见表2)。多因素非条件Logistic回归分析显示:患者病灶大小、病灶部位差异无统计学意义(P>0.05)(见表3)。
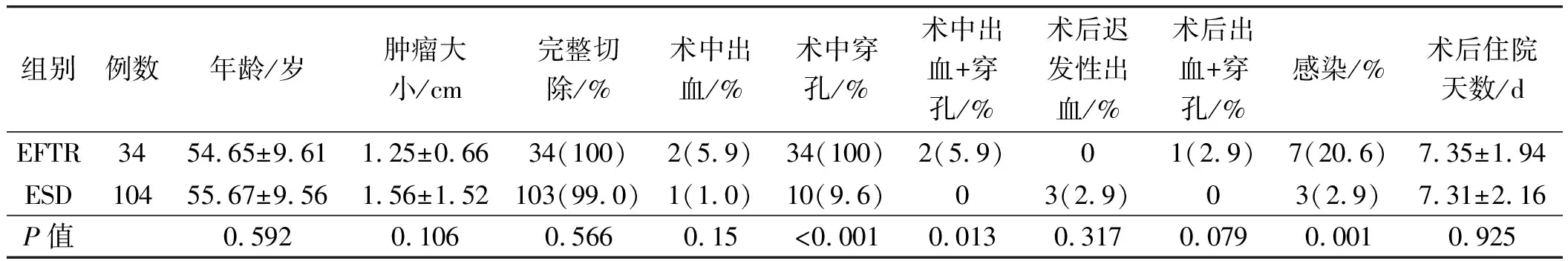
表1 136例患者(138个瘤体)不同内镜治疗方式的效果Tab 1 Effect of different endoscopic treatment methods in 136 patients (138 tumors)
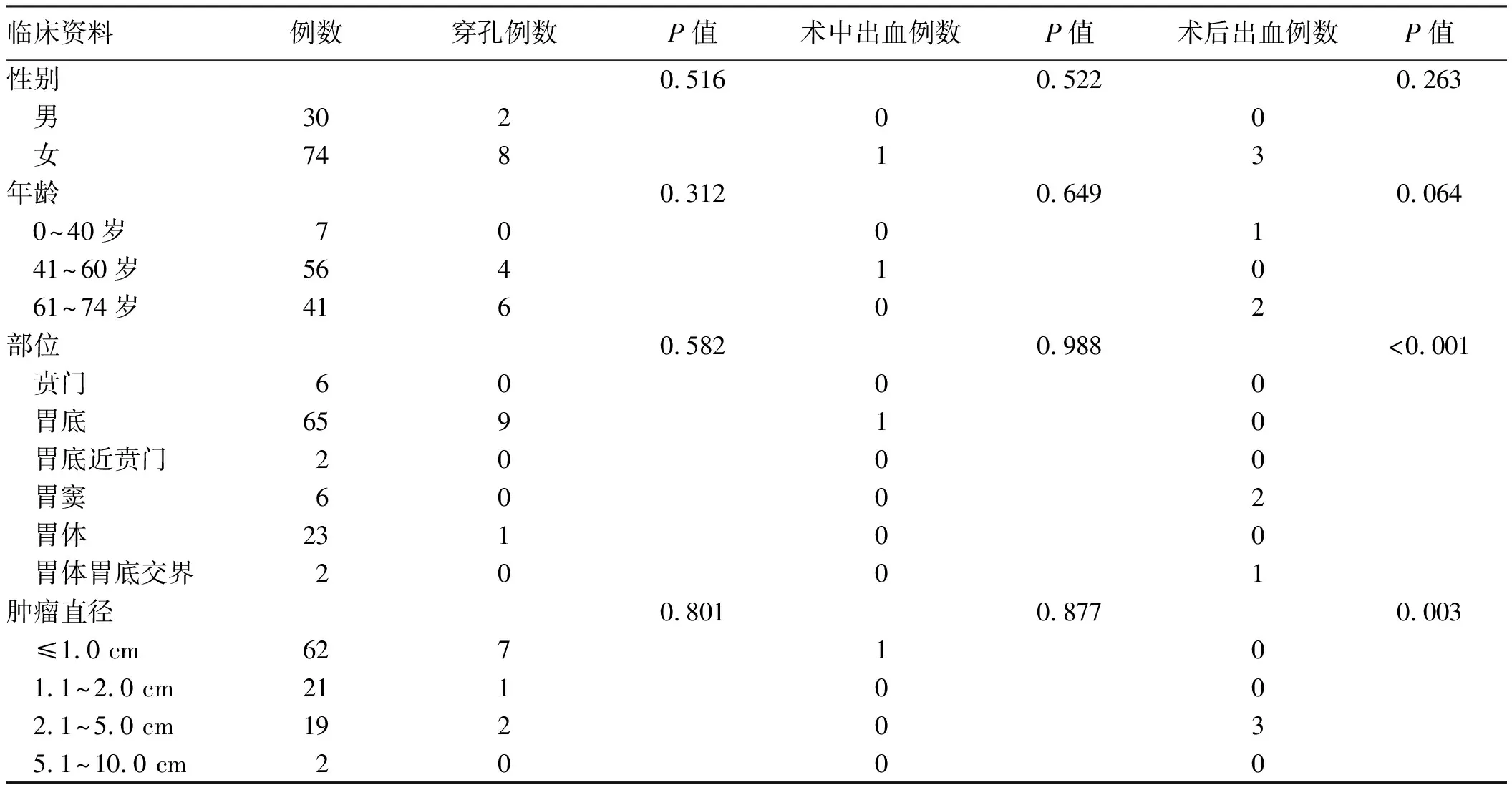
表2 104个瘤体行ESD治疗发生术中穿孔、术中出血、术后迟发性出血的单因素分析Tab 2 Univariate analysis of intraoperative perforation, intraoperative hemorrhage and postoperative delayed bleeding in 104 tumors after ESD
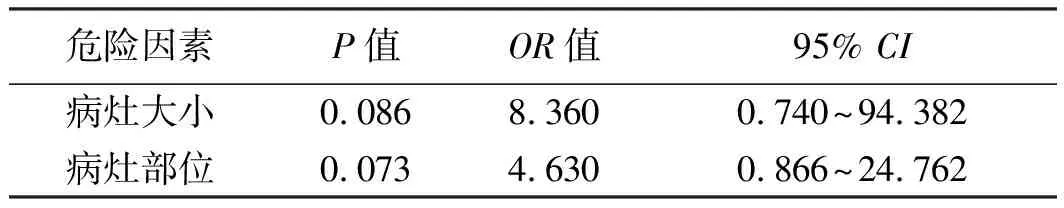
表3 104个瘤体行ESD发生术后迟发性出血的多因素非条件Logistic回归分析结果Tab 3 Multivariate unconditional Logistic regression analysis of 104 tumors of delayed hemorrhage after ESD
2.5随访136例患者中,115例参加内镜或电话随访,其中33例尚未复查胃镜,实际随访率60.3%,失访21例,随访时间(15.09±12.34)月(2~47月),其中1例胃底间质瘤行ESD治疗的患者术后随访12个月发现胃体间质瘤,再次行ESD治疗后随访4个月未见复查,余病例复查均未见病变复发,均获无病生存。
3 讨论
GIST是最常见的胃肠道间叶源性肿瘤,其发病与c-kit基因(80%~85%)、PDGFRA基因(5%~10%)突变有关,少数与V600E BRAF、SDH、NF1突变有关[7]。GIST临床表现不典型,多无明显症状,易漏诊。其确诊依靠病理学及免疫组化,CD117及CD34同时表达阳性对GIST诊断有重要意义,DOG-1是目前公认的GIST最敏感、最特异的标记物[8]。GIST在普通胃镜下表现为黏膜下隆起,超声胃镜下多表现为来源于黏膜肌层或固有肌层的低回声肿块,超声胃镜显示边界不规整、溃疡、强回声和异质性为GIST的不良因素。
本研究中GIST发病部位最多见于胃底,其次为胃体,与文献报道一致[9]。45.6%(62/136)的患者无明显临床症状,发病年龄(55.41±9.55)岁,因而对中老年人普及胃镜检查有助于GIST的早期诊断及治疗。
GIST的内镜下治疗方法有多种,根据瘤体的部位、大小、浸润深度及与周围组织的关系等可选择不同的术式,ESD对来源于黏膜肌层的肿瘤切除率高;EFTR对于起源于深层固有肌层与浆膜层粘连,凸向腔外生长的黏膜下肿瘤可完整切除;经黏膜下隧道内镜切除术(submucosal tunneling endoscopic resection,STER)主要适用于食管部的消化道黏膜下肿瘤(submucosal tumors,SMTs);内镜黏膜下挖除术(endoscopic submucosal enucleation,ESE)主要用于源于浅层固有肌层的SMTs;内镜黏膜下隧道剥离术(endoscopic submucosal tunnel dissection,ESTD)对食管部、贲门部、胃食管交界部黏膜下肿瘤的切除有优势[10]。内镜下治疗的并发症主要为出血、穿孔及感染,这些是限制内镜下治疗推广的主要因素。但术前患者严格的禁食水,术前、术后预防性抗生素应用及术后胃肠减压的应用可降低术后感染、出血及穿孔的发生率,多数出血、穿孔可在内镜下完成修补,极少需外科开腹手术修补。
本研究中,34例(34个瘤体)行EFTR治疗,完整切除率100%,瘤体多位于固有肌层深层,部分瘤体向腔外生长;102例(104个瘤体)行ESD治疗,一次完整切除率99.0%(103/104),两组完整切除率均高于文献报道[11-12]。本研究ESD组术后感染率、术中穿孔率、术中出血+穿孔率均小于EFTR组(P=0.001),两组间患者年龄、肿瘤大小、完整切除率、术中出血率、术后迟发性出血率、术后出血+穿孔率、住院天数比较,差异无统计学意义(P>0.05),两组疗效相当。我院胃间质瘤应用内镜下治疗取得了较好的临床疗效,可基本一次性完整切除瘤体,患者发生出血、穿孔的概率较低。
内镜下治疗出血及穿孔影响患者恢复及预后,因而对内镜下治疗并发症发生的危险因素分析很重要。本研究对胃间质瘤行ESD治疗发生术中穿孔、术中出血、术后迟发性出血的单因素分析显示:ESD治疗发生迟发性出血在不同病灶部位(P<0.001)及瘤体大小(P=0.003)方面差异有统计学意义,在患者不同性别、年龄方面差异无统计学意义(P>0.05),对位于胃底胃体交界处、直径为2~5 cm的瘤体易出现ESD术后迟发性出血。胃底胃体交界处易发生术后迟发性出血可能与胃中上1/3的胃壁比下2/3薄及黏膜下动脉直径更大有关[13]。有文献报道,瘤体直径>40 mm是ESD术后迟发性出血的独立危险因素[14],年龄>80岁是术后迟发性出血的高危险因素[15]。本研究ESD术后迟发性出血与年龄无相关性,可能与未纳入年龄>80岁的患者有关。
本研究82例患者参加内镜随访,随访时间(15.09±12.34)个月,失访率15.4%,失访患者不明确病情复查情况,存在失访偏倚。目前文献报道多为样本量较小的短期随访,未来需要多中心随机对照研究明确GIST内镜下治疗的远期疗效。
综上所述,内镜下治疗胃间质瘤能够取得较好的临床效果,且安全、有效、微创,并发症发生率较低。但内镜下治疗也存在一定的出血、穿孔及感染等风险。因此,应严格把握适应证,术前充分评估出现并发症的风险,术中做好创面处理 ,术后密切观察病情变化,尽量减少并发症的发生。本研究认为,内镜下治疗胃间质瘤值得临床推广。

