上下肢深静脉血栓形成危险因素对比的病例对照研究*
张美霞,程乔,胡雪慧,闫沛
(空军军医大学第一附属医院(西京医院)护理部,陕西西安,710032)
上肢深静脉血栓(upper-extremity deep vein thrombosis,UEDVT)是指发生在桡、尺、臂、腋、锁骨下、颈内或头臂静脉内的血栓[1],占所有深静脉血栓(deep vein thrombosis,DVT)形成病例的 4%~10%[2]。UEDVT根据发病原因的不同可以分为原发性和继发性,原发性UEDVT多为良性自限性疾病,但其更多的是一种继发性疾病,如:上肢血管受损、上腔静脉综合症、静脉瓣膜功能不全,肿瘤等,占 UEDVT 的 2/3[3-4]。近年来,随着静脉置管、起搏器植入等侵入性操作的发展,使UEDVT的发生率呈逐年上升趋势。下肢深静脉血栓 (lowerextremity deep vein thrombosis,LEDVT)主要是指发生在髂、股、腘等下肢静脉的血栓,目前人们常说的DVT也主要是指LEDVT[5],由于其发生率较高,因此受到临床医护人员的广泛关注,现有的国内外研究也主要针对其开展,而对于UEDVT的研究却较少,且主要集中在导管相关的DVT方面,临床医护人员对于非导管相关的UEDVT认识较浅。据文献报道[6],与 LEDVT 患者相比,UEDVT 患者更易发生肺栓塞、DVT的复发和栓塞后综合征,具有更高的致死和致残率,并且国外研究还发现[7],两者在危险因素、病理生理学、临床路径均存在着较大的差异,国内在这方面的研究还较为欠缺。因此,为了进一步探索两者之间的关系,采用病例对照研究方法比较UEDVT与LEDVT患者血栓形成风险因素及其异同,为临床医护人员开展针对性的干预策略提供循证依据,现报道如下。
1 对象与方法
1.1 研究对象
采用病例对照研究方法,选取本院2007年10月—2017年1月所有非静脉导管相关UEDVT为标准,按照1:1:1的原则,以年龄和性别为匹配条件,分别选取LEDVT患者以及非DVT患者各82例。病例组纳入标准与排除标准,①纳入标准:有症状或无症状的UEDVT和LEDVT患者,年龄在15岁以上。UEDVT是指发生在颈静脉、头臂静脉、锁骨下静脉、腋窝静脉以及远端臂静脉、尺静脉和桡静脉这些上肢深静脉内的血栓[8]。LEDVT是指发生在髂-股-腘等近端静脉的血栓以及发生在小腿深静脉的血栓[9]。两者均经多普勒超声、计算机断层扫描、MRI或静脉造影等各种成像检查确认。②排除标准:同时患有UEDVT和LEDVT患者,静脉导管相关的UEDVT患者;病历资料不全的患者。研究经过伦理委员会审批和同意。对照组纳入标准与排除标准:选取同时期住院的非DVT患者作为对照组。根据UEDVT患者的不同特征选取年龄差异不超过±5岁,同性别的LEDVT患者和非DVT患者进行对比。
1.2 研究方法
1.2.1 调查工具 通过查阅文献以及相关指南[2,10-13]设计人口学调查表,其包括性别、年龄、科室、基础疾病4项;危险因素变量17个,见表1;实验室检查8项,见表4,通过咨询血管外科教授2名,对调查表进行进一步完善修订而成。
1.2.2 调查方法 与医院的信息化中心协调,从医院DVT预警管理系统中调取UEDVT患者的ID号,然后由两名研究生对病历进行严格的筛选和数据收集,最终共查阅相关病历402份,排除所有导管相关UEDVT患者,最终共筛检出非导管相关UEDVT患者82例,同时收集LEDVT和非DVT患者相关资料,分别比较UEDVT患者与非DVT患者,LEDVT患者与非DTV患者,得出两组患者不同的危险因素,再将单因素分析中有意义的因素纳入多因素分析,分析两组患者不同的独立危险因素。
1.3 样本量估计
由于目前尚缺乏关于非静脉导管相关UEDVT发生率的权威文献数据报道,因此本研究样本量估计,按照多因素回归分析对样本的要求,以研究变量UEDVT样本量n是方程中自变量m的5~10倍[14]。根据本研究纳入单因素的数量,假设有10个初始变量进入回归方程,样本应为50~100例。本研究选取的3组患者例数均为82例,符合样本量要求。
1.4 统计学分析方法
数据采用Epidata3.0录入,并进行双人核对,采用SPSS19.0进行统计学分析,正态分布的计量资料以(± S)描述,组间比较采用 t检验,计数资料采用例与百分率(%)进行描述,组间比较采用χ2检验或Fisher确切概率法进行,单因素分析中有统计学意义的变量采用全进入法进行Logistic多因素回归分析,P<0.05差异为有统计学意义。
2 结果
2.1 一般人口学资料
UEDVT、LEDVT、非 DVT 3 组患者中,每组分别有男63例,女19例;UEDVT患者年龄45~75岁,平均(59.56±14.93)岁;LEDVT 患者年龄 42~73岁,平均(57.20±15.20)岁;非 DVT 患者年龄 40~72岁,平均(55.34±16.31)岁,组间比较,差异无统计学意义(均P>0.05),3组患者基础疾病分布情况见表1。

表1 UEDVT和LEDVT患者血栓危险因素的单因素分析 n/%
2.2 UEDVT和LEDVT患者危险因素的单因素分析
UEDVT和LEDVT患者危险因素的单因素分析见表1。由表1可见,UEDVT患者与非DVT患者相比,在手术史、VTE家族史、化疗史、乳腺癌、肺癌、肝癌、感染和起搏器植入各变量比较,差异具有统计学意义(均P<0.05);LEDVT患者与非DVT患者相比,在吸烟史、手术史、创伤史、VTE家族史、糖尿病和脊髓损伤各变量比较,差异具有统计学意义(均 P<0.05)。
2.3 UEDVT患者危险因素的二元Logistic回归分析
以患者是否发生UEDVT作为因变量 (非DVT=0,UEDVT=1),以 UEDVT 单因素分析中有统计学意义的变量作为自变量 (手术史、VTE家族史、化疗史、乳腺癌、肺癌、肝癌、感染和起搏器植入)纳入Logistic回归分析中,各变量赋值分别为无=0,有=1。UEDVT患者危险因素的二元Logistic回归分析见表2。由表2可见,手术史、VTE家族史、肿瘤(乳腺癌、肺癌)、感染、起搏器植入进入了回归模型(均P<0.05),而且均为风险因素。
2.4 LEDVT患者危险因素的二元Logistic回归分析
以患者是否发生LEDVT作为因变量 (非DVT=0,UEDVT=1),以 LEDVT单因素分析中有统计学意义的变量作为自变量(吸烟史、手术史、创伤史、VTE家族史、糖尿病和脊髓损伤)纳入Logistic回归分析中,各变量赋值分别为无=0,有=1。LEDVT患者危险因素的二元Logistic回归分析见表3。由表3可见,手术史、VTE家族史、创伤史、脊髓损伤、糖尿病进入了回归模型(均P<0.05),而且均为风险因素。
2.5 UEDVT和LEDVT患者实验室各项指标比较
UEDVT和LEDVT患者实验室各项指标比较见表4。由表4可见,在实验室检查方面,UEDVT和LEDVT在抗凝血酶、蛋白C和蛋白S、抗磷脂抗体变量比较,差异具有统计学意义(均P<0.05)。
3 讨论
3.1 本研究的意义
本研究通过病例对照研究方法了解非静脉导管相关的UEDVT和LEDVT患者之间危险因素的异同,发现UEDVT相关危险因素与LEDVT相关危险因素有所不同。由于上肢和下肢深静脉存在着一定的解剖差异,因此两者在危险因素、发生机制、临床特征、基础疾病、治疗策略等方面存在许多不同,但是目前临床上医护人员对于非导管相关的UEDVT认识和预防不足。据研究报道[15],目前只有20%的UEDVT患者接受了药物预防。UEDVT患者虽然发生率远低于LEDVT患者,但是UEDVT的复发率和致死率较高,因此明确UEDVT和LEDVT风险因素的区别是非常重要的,它可以为临床建立风险评估工具和模型提供更好的参考。

表2 UEDVT患者危险因素的二元Logistic回归分析 (n=82)
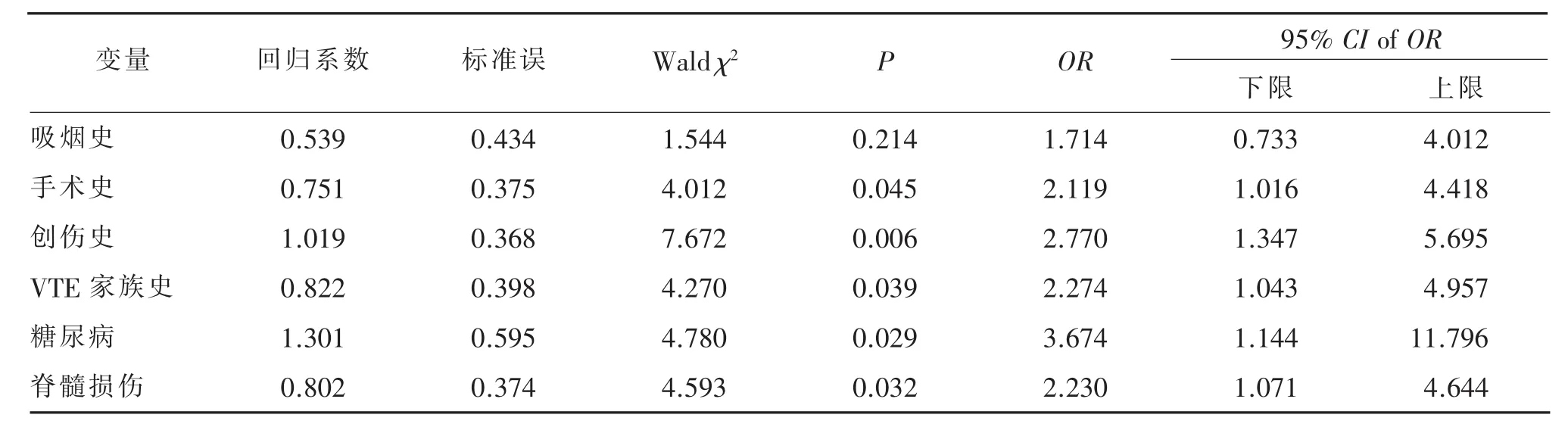
表3 LEDVT患者危险因素的二元Logistic回归分析 (n=82)
3.2 UEDVT的危险因素分析
3.2.1 肿瘤(肺癌、乳腺癌) 已有研究证实[16],肿瘤是UEDVT发生的第二大独立危险因素,高达49%的UEDVT患者患有肿瘤,与非肿瘤患者相比,血栓风险增加18倍。一项对肿瘤患者的研究发现,在患者入院1周后UEDVT发生增加,并且发现肺癌和淋巴癌是UEDVT发生的主要癌症类型[17]。最近有研究甚至发现,UEDVT可以作为一部分患者发生肿瘤的一种标志,对于一些不明原因的原发性UEDVT患者,建议进行肿瘤筛查[18-19]。在本研究中,主要发生的肿瘤类型为乳腺癌和肺癌患者。随着乳腺癌的发生发展,肿瘤通常会浸润腋窝淋巴结,压迫上肢腋静脉,造成血液瘀滞,从而形成血栓[20];再加上乳腺癌术中麻醉造成患者肌肉松弛,血流缓慢,对肿瘤组织的切除和大量腋窝淋巴结清扫,使上肢的活动受限,均增加了患者UEDVT发生的风险。部分肺癌也会对患者上肢深静脉造成一定的压迫,如肺尖部的肿瘤,会对上腔静脉造成一定压迫。除此之外,肺癌常发生淋巴转移,转移至颈部或锁骨上以及腋窝淋巴结,形成肿块,压迫上肢静脉。除了直接的压迫外,肿瘤和DVT发生之间的关系是多方面的,肿瘤可导致患者长期卧床,血液瘀滞,也会改变血液成分的表达和活性,如促凝因子包括凝血级联蛋白、组织因子,血小板和白细胞增多,使血液形成高凝状态。从另一个角度来讲,肿瘤也是一种炎症反应,它会导致促炎因子,如白介素6、白介素8、白介素10的表达增加,这些炎症因子促进了粘附因子在内皮细胞和单核细胞上的粘附导致血栓形成[21],肿瘤的这些生物学改变、抗凝系统的激活和炎症共同导致了UEVDT的形成。由此可见,对于上肢非导管相关的DVT来说,一方面与肿瘤产生的直接性压迫相关;另一方面与肿瘤产生的全身性生物学改变相关,而乳腺癌和肺癌成为UEDVT的危险因素,可能还是与结构上的直接压迫相关。
3.2.2 起搏器(除颤器)植入 植入心脏起搏器和除颤器会造成静脉管腔阻塞,增加UEDVT的发生,并且有研究发现[22],不论是植入除颤器还是起搏器,两者发生UEDVT的风险相似。本研究中纳入的14例患者中起搏器植入患者9例,除颤器植入患者5例,其中有1例起搏器植入的患者曾发生囊袋感染。心脏本身的病理改变,导致其血流动力学发生异常,起搏器的植入一方面会损伤血管内皮细胞,导致凝血因子的激活和炎症反应;另一方面,起搏器的电极通过静脉送入心脏,不仅会导致近端静脉管腔狭窄和阻塞,还会导致穿刺处远心端的周围静脉扩张,使血流速度减慢,血液瘀滞,使UEDVT的发生风险进一步增加[23]。研究对起搏器植入患者进行B超的随访监测发现,在前6个月,患者的局部静脉管腔不完全阻塞;第1年发生DVT的可能性大约为23%,在44个月的随访中发现,患者UEDVT的发生率为32.7%[22]。另外,还有研究报道[24],囊袋感染作为起搏器植入术后常见的并发症,也是患者发生UEDVT的重要因素。
3.2.3 感染 感染是UEDVT的独立危险因素,主要是由于感染会增加全身的炎症反应,激活机体促炎因子和促凝因子的释放,增加患者血液粘滞度[25]。在本研究中,UEDVT 的 12 例患者中,其中发生上肢局部感染的有7例,全身性感染有5例。感染通过内皮损伤、组织因子诱导的促凝血通路激活,促进血栓形成下调内源性抗凝通路,抑制了纤溶系统的活性;另外,还与中性粒细胞的活化和释放P-选择素,促进血小板的活化、粘附和聚集相关。已有研究结果证实[26],急性感染是静脉血栓栓塞的诱因,在一项以人群为基础的病例对照研究发现,无论卫生保健情况如何,感染会使健康人群的静脉血栓栓塞风险增加4.2倍,使住院相关感染患者的血栓风险增加12.5倍。丹麦的一项以人群为基础的研究中,呼吸道、尿道和腹腔内感染的静脉血栓栓塞风险分别增加4.9倍、1.7倍和2.4倍[27],对其他的风险因素进行调整后,在同一研究中,败血症使DVT的发生率增加了3.6倍。由此可见,感染可使静脉血栓栓塞症的发生风险增加,而且在这些研究中均包括UEDVT和LEDVT的患者,但是本研究中,只发现其是UEDVT的危险因素,可能是由于样本量的限制和选择偏移、混杂所造成,因此还不能得出非常确切的结论。
3.3 LEDVT的危险因素分析
3.3.1 创伤 DVT是目前公认的创伤患者的重要并发症,据研究报道[28],创伤患者中 LEDVT的发生率高达3%~65%,是创伤患者损伤后第1天内发生死亡的主要原因之一。创伤患者DVT的发生主要与创伤的类型、血管的损伤和长期卧床相关。脊髓损伤后,不仅会影响患者的神经功能,使患者长期卧床,而且下肢的肌张力下降,失去了肌肉泵的功能,导致静脉血液在下肢的瘀滞,因此脊髓损伤成为了LEDVT栓患者特有的也是非常重要的危险因素。
3.3.2 糖尿病 糖尿病是LEDVT发生的危险因素,一方面与高血糖产生的全身性损伤相关;另一方面与糖尿病引起的周围大血管病变相关。台湾的一项以人群为基础的研究发现[29],以正常人群为对照,II型糖尿病患者的DVT发生风险会增加1~2倍。主要原因是高血糖会损伤血管内皮细胞,并发大血管病变,糖尿病患者比正常人更容易产生动脉粥样硬化,而且发展迅速,从而导致冠心病、脑血管意外和下肢坏疽等。据报道[30],在过去患有周围血管疾病的患者中,有20%发现合并有糖尿病,而在糖尿病的患者中发现有间歇性跛行、肌肉和皮肤萎缩以及下肢坏疽等症状者也比正常人要高。而这些周围血管疾病也更多地发生在下肢,增加了LEDVT发生的风险。
3.4 UEDVT和LEDVT相同的危险因素分析
3.4.1 手术史 研究表明[31],手术干预是患者发生UEDVT的第三大危险因素。JUNG-AH等[32]研究显示,27%UEDVT 患者有手术史;MINO[33]等研究显示,53.8%有手术史患者术后发生 UEDVT,LEDVT发生率为35.9%。这主要与大的外科手术:术前禁饮食、胃肠减压使机体血容量不足,血液黏滞度增高;术中患者输注大量低温、高渗液体易损伤血管内膜;术后卧床导致静脉血流滞缓,以上多个因素效应的累积使手术成为DVT形成的高危因素。对于不同基础疾病的DVT患者,发现手术均是其发生DVT的风险因素,因为手术不仅是一种应激,也是一种创伤,会从各个方面对患者全身的血凝状态产生影响,导致血栓的高发。
3.4.2 VTE家族史 VTE家族史与患者的原发性高凝状态密切相关,受家族遗传基因的影响,本研究显示,UEDVT患者遗传性抗凝血因子缺乏比例高于LEDVT的患者,这种原发性的高凝状态不仅会增加UEDVT的风险,也会增加LEDVT的风险。研究发现[34],抗凝血酶基因的缺陷、蛋白C和蛋白S的缺乏是亚洲人群常见的三个遗传基因变异,其中影响最大的是抗凝血酶缺乏,且此病多以显性遗传为主,发病率也较高,可使患者DVT的发生风险增加20倍;而蛋白C的缺乏是一种常染色体阴性遗传疾病,占DVT的2%~8%;蛋白S作为凝血级联反应中蛋白C的辅助因子,其缺陷在DVT患者中的检出高达7%。
3.5 先天遗传性因子缺乏
据文献报道[35],UEDVT患者中抗凝血异常的发生率是8%~61%,这些遗传性或获得性凝血性疾病是UEDVT发生的一个非常重要的危险因素。本研究由于是回顾性的研究,所以没有收集到完整的关于非DVT患者抗凝血异常的相关数据,因此只进行了UEDVT和LEDVT患者相关数据的对比,发现UEDVT和LEDVT患者在抗凝血酶III、蛋白C或蛋白S的表达方面存在差异(均P<0.01),UEDVT患者缺乏比例高于LEDVT患者。目前,已有研究发现,抗凝血酶缺乏在(忽略性别和种族的限制)普通人群中的发生率是1/5000至1/500,抗凝血酶III缺乏与血栓形成的高风险相关,使患者发生血栓的风险增加3~7倍,大约有60%的患者会发生自发性的静脉血栓栓塞症[36],并且常累及下肢,但也会发生在一些不常见的部位。本研究中抗凝血酶缺乏患者UEDVT的发生大多累及的是上肢头静脉,可能主要的原因是由于临床医务人员对于UEDVT的认识不足,临床上的大多数措施也主要是针对LEDVT患者进行的,而忽略了高危的UEDVT患者。蛋白C和蛋白S均为一种维生素K依赖性酶原,其两者发挥协同作用,主要作用是活化后灭活凝血因子,抑制血液凝固[36]。一项印度的研究[37],115 例UEDVT 患者与797例对照组患者进行对比,发现蛋白C或蛋白S缺乏的患者UEDVT发生率与正常患者相比增加了5~6倍,并且发现先天性抗凝血酶缺乏的患者原发性UEDVT的发生风险也明显高于正常人群,与本研究的结论基本一致。
抗磷脂抗体包括狼疮抗凝物、抗心磷脂抗体、抗磷脂酸抗体和抗磷脂酰丝氨酸等,这些抗体通过与各种磷脂-蛋白复合物结合,干扰各种依赖磷脂的凝血和抗凝因子而发挥作用,导致反复的弥漫性动静脉血栓形成、习惯性流产和血小板减少,临床称为抗磷脂综合征,属于一种获得性自身免疫性血栓性疾病,其基本病理改变为血管内血栓形成,并导致相应脏器和系统的功能异常。据报道[38],LEDVT是抗磷脂抗体综合症患者最常见的首发症状,约占患者总数的30%,UEDVT患者也常见,但是尚没有关于两者之间发生率比较的研究。本研究中UEDVT患者中的抗磷脂抗体阳性患者多于LEDVT患者(P<0.05)。可能主要是由于这些自身免疫性疾病患者,需要长期反复住院,进行上肢反复穿刺输注大量刺激性药物有关,以及这些患者往往在晚期需要进行动静脉造瘘等,使上肢深静脉内膜受损严重,易发生血栓;另一方面也可能是由于本研究样本量的限制,造成的选择偏移。
4 结论
综上所述,本研究发现UEDVT和LEDVT形成原因和危险因素存在着一定的差异,但也有相同之处。UEDVT发生与肿瘤、起搏器植入、感染相关,并与一些先天性的遗传因子缺乏相关;UEDVT多与创伤、糖尿病等相关;手术史与VTE家族史是两者相同的风险因素。该研究可增强临床医护人员对于DVT患者的全面认识,弥补目前临床上对高风险UEDVT患者预防不足的现状,为其采取有针对性预防措施提供循证依据。本研究不足之处在于受时间和人力的限制,只进行了单中心的研究,希望下一步可以进行多中心大样本的研究,为DVT预防以及预警系统建立提供借鉴和依据。

