关于肢体缺血再灌注损伤评价指标的研究进展
张俊辉,郑志鹏,何成龙,宋炎成,杨艳红
( 1.广东药科大学附属第一医院/临床医学院,广东 广州 510080; 2.南方医科大学临床医学院,广东 广州 510515)
在缺血基础上恢复血流后组织损伤反而加重,甚至发生不可逆性损伤的现象称为缺血-再灌注损伤(ischemia-reperfusion injury,IRI)。相关研究认为缺血再灌注损伤主要是因为过量的自由基攻击这部分重新获得血液供应的组织细胞以及在细胞内钙超载和白细胞共同作用下所造成的损伤[1],因此这种损伤发生的主要因素并不是缺血本身。创伤性休克、外科手术、器官移植、烧伤、冻伤和血栓等血液循环障碍时,都会出现缺血后再灌注损伤。在车祸或自然灾害中,有不少人因为卡压而造成肢体缺血,错误的救治常引起缺血再灌注损伤。本文从肢体缺血损伤后的组织形态学、神经电生理以及生化指标的改变方面进行归纳总结,为评估缺血再灌注损伤的严重程度提供参考指标,对后续研究具有重要的参考价值[2]。
1 组织形态学的评估指标
肢体缺血后,其组织形态改变是非常明显的,通过在相应仪器的辅助观察,对比组织损伤前后的变化,可直观判断缺血组织的损伤程度[3]。现阶段公认的肢体缺血-再灌注损伤导致的组织学依据包括:(1)肢体缺血再灌注损伤发生后,刺激机体产生各种炎症反应,肢体的骨骼肌和肢体的周围神经在组织形态上有较为明显的改变;(2)肢体缺血再灌注损伤发生后,肢体骨骼肌主要组织学改变表现为水肿,其次是肌细胞间可见炎性细胞和凋亡损伤的肌纤维;(3)肢体缺血再灌注损伤的肌肉周围毛细血管因为炎症介质介导,微循环发生改变,血管内皮细胞以及血管内的血细胞也会有组织学上相应的变化[4],上述指标是在缺血-再灌注损伤的相关研究中常用的形态学评价指标[5-6]。
1.1 观察肌纤维结构
骨骼肌纤维在光镜下为长柱形的多核细胞,肌膜的外面有基膜紧密贴附。一条肌纤维内可含有几十个甚至几百个细胞核,位于肌浆的周边即肌膜下方。细胞核呈扁椭圆形,异染色质较少,染色较浅。肌浆内含许多与细胞长轴平行排列的肌原纤维,在骨骼肌纤维的横切面上,肌原纤维呈点状,聚集为许多小区。在缺血-再灌注损伤的骨骼肌中,肌纤维前后的结构发生较大变化,有明显的形态差异[7]。王崇文等[4]研究发现,与对照组相比,用止血带结扎4 h后再灌注6 h的兔子肌纤维水肿明显,肌间隙宽度、肌横纹结构、血管扩张程度和中性粒细胞的数量都有显著的改变。可见对于观察缺血-再灌注损伤严重程度的指标中,骨骼肌组织学的明显改变、严重程度区分也是可以明确的,可作为一种可靠的评价缺血再灌注损伤的直观指标[8]。
1.2 观察神经组织结构
在肢体的周围神经中有部分较为粗壮、可含几条至数十条的神经纤维束,而包裹在神经表面的致密结缔组织是神经外膜,神经外膜的结缔组织会延伸到神经纤维束间,神经纤维束表面有几层扁平的上皮样细胞,形成神经束膜。在缺血-再灌注损伤的动物模型中,观察神经缺血前后的水肿程度和神经正常结构的改变可以作为缺血再灌注损伤评价的直观指标,但是在一些动物模型中,需要保留一些较粗的神经干作为后续相关研究所用,比如需要继续研究患肢的运动功能时,切除神经组织观察横断面就比较难实现[9]。如果无需进行后续神经研究,切除相对应的神经节段进行神经组织结构的观察,仍可以作为一个组织学上评价缺血再灌注损伤的有效指标[10]。
1.3 观察血细胞形态及血管内皮改变
肢体在经历缺血再灌注损伤后,会产生一系列的炎症反应和细胞组织形态学的改变,血液中会出现大量的炎症因子和一些小分子物质,在这一系列免疫反应中,血细胞可能会受到炎症因子或小分子物质的破坏,从而使血细胞形态发生相应的改变,例如肢体在缺血情况下,红细胞在变形能力上会发生一定的变化,可以通过测定红细胞的弹性或者观察红细胞的形态变化判断缺血再灌注的损伤程度[11-12]。除红细胞的改变以外,缺血-再灌注损伤时,被激活的白细胞会释放大量自由基和溶酶体酶,进一步促进细胞损伤,同时,细胞内钙离子超载,组织中水分、钙离子、钠离子和氯离子等经破损的细胞膜进入细胞内,致使细胞明显肿胀,还可出现核染色质边集、线粒体增大、吞饮小泡减少、应力纤维分散不成束、梗死灶内的小动静脉和毛细血管内皮细胞发生变性断裂和分离等[5-6,13-14]。因此在缺血再灌注的组织形态学指标上,可以观察血管内皮细胞和血细胞的改变,对损伤严重程度也有一定的评判价值。
2 神经电生理评估指标
神经电生理(electrophysiology method) 是用电生理仪器、微电极、电压钳(voltage clamp)及膜片钳(patch clamp)等技术记录或测定整体动物或离体器官组织、神经和细胞离子通道等的膜电位改变、传导速度和离子通道活动的方法。肌电图(electromyogrphy,EMG)和神经传导速度(nerve conduction velocity,NCV)测定是神经系统的重要神经电生理检查,两者经常联合使用,主要用于周围神经、神经肌肉接头和肌肉病变的诊断。
早在1979年,有关使用气囊止血带后肢体出现异常EMG的结果就被Weigarden等[15]和Saunders等[16]报道,Krebs等[17]也提出异常EMG可在缺血后6个月内持续存在,并与行膝关节切开术的患者术后膝关节功能下降、恢复期延长等相关。因此,EMG的监测对肢体应用止血带后变化情况的敏感性强,持续时间长,且与肢体的功能密切相关,通常被作为监测肢体神经肌肉功能的观察指标。在以往的实验研究中,肢体神经肌肉功能的监测一般使用神经电位,虽较简易,却难以对肢体运动的功能做出精确的评定[18]。近年来的实验研究中,研究人员常以诱发电位的潜伏期(latency)、运动神经传导速度(motor nerve conduction velocity,MNCV)以及动作电位波幅(amplitude,Amp)的变化作为缺血再灌注损伤的评估指标[4,19-20],具有良好的实际操作性和精确的评价效果。
2.1 潜伏期(latency)
诱发电位(evoked poteintias,EP)是神经系统感受外来或内在刺激时产生的生物电活动,是一种对刺激特定规律的响应。诱发电位信号中的潜伏期是指由受到外部刺激时开始到某个预选定的EP峰之间的时间间隔。潜伏期及其变化(延迟)提示了神经系统的传导及延迟,也间接反映了神经系统的状态及变化[21]。因此,检测潜伏期及其变化,对于诊断和评估缺血再灌注损伤的程度具有十分重要的意义。
2.2 运动神经传导速度(MNCV)
MNCV属于神经传导速度(nerve conduction velocity,NCV)检查中的一种常用检查项目,主要用于评定运动神经的传导功能,也可以反映神经肌肉接头的功能,因此常作为缺血再灌注损伤的评估指标[22]。
2.3 动作电位波幅(amplitude,Amp)
在电生理的测量中,Amp虽然能反映肌肉受神经支配的程度,但很多因素都能影响到波幅的变化,其记录电极亦需反复调试才能得到满意的波形,因此常需要结合诱发电位的潜伏期、MNCV的监测结果来综合评价缺血再灌注损伤的程度[23]。
3 生化指标
肢体在经历缺血-再灌注损伤后,由于骨骼肌受到损伤,测量肢体缺血再灌注损伤的相关生化指标包括一些炎症因子、相关酶学和一些特殊物质作为客观的指标来评估缺血再灌注损伤的组织损伤程度是很有价值的[4,24-26]。某些生化指标与缺血再灌注损伤严重程度之间存在量效关系,通过观察这些生化指标的数值变化,间接判断损伤程度,可以为从事相关研究的科研工作者和临床医生提供稳定可靠的参考。
3.1 血清中CPK、AST、ALT指标测定
孙任任等[27]关于肝脏缺血再灌注损伤的研究发现,大鼠肝脏在缺血再灌注后,肝组织损害较严重,组织结构不清,肝细胞索、肝窦分界不明显,大多数肝细胞肿胀,细胞质疏松化,有的呈气泡样变,如果只依靠组织观察,不易做出客观评价,借助生化手段测量血清肌酸磷酸激酶(creatine phosphokinase,CPK)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST) 及乳酸脱氢酶(lactate dehydrogenase,LDH)水平,能够对缺血再灌注损伤进行较为客观的评价。CPK是磷酸肌酸与二磷酸腺苷(adenosine diphosphate,ADP)之间可逆反应的一种氧化酶。CPK在细胞中与三磷酸腺苷(adenosine triphosphate,ATP)的再生相关,能够维持细胞内的ATP在一定的生理水平浓度上。动物的生活运动,时刻需要骨骼肌的帮助,骨骼肌需要大量的ATP维持其功能,因此正常骨骼肌细胞内会含有较多的CPK[28],当缺血再灌注损伤发生时,细胞会造成损伤,导致细胞质内的CPK释放到血清中,因此CPK可以作为判断缺血再灌注损伤的一个生化指标,且其血清含量越高,损伤越严重。AST和ALT主要存在于肝脏、心脏和骨骼肌中。AST主要存在于细胞线粒体内,当细胞发生严重坏死或破坏时,才能引起AST在血清中浓度偏高。因此发生肢体缺血再灌损伤后,骨骼肌细胞中的细胞膜结构破坏,细胞内的酶大量进入血液内,此时,血清中 CPK、AST、ALT的含量会发生变化,测量这些指标可以大致反映再灌注后骨骼肌的损伤程度,含量越高说明损伤的细胞越多,损伤越严重。但是这些指标也存有一定的缺陷,例如这些酶同样存在于心肌、肝脏等组织,且在心肌、肝脏中的含量更高,因此用于判断骨骼肌的损伤程度特异性相对较差[29]。
3.2 血清中MDA、SOD指标测定
丙二醛(malondialdehyde,MDA)是脂质过氧化的主要代谢产物。由于MDA是由体内代谢过程中形成的自由基引起脂质进行过氧化作用代谢而产生的,故其测得值的高低可在一定程度上反映脂质过氧化的程度,从而间接地反映机体细胞受氧自由基攻击的严重程度。目前MDA含量的测定方法主要有紫外-可见分光光度法、荧光光谱法、高效液相色谱法(HPLC)、气相色谱-质谱法(GC-MS)、酶联免疫吸附法(ELISA)及新型光谱检测法等。MDA含量降低越明显,表示肢体缺血再灌注损伤的程度越严重[30]。同时,在肢体存在缺血再灌注损伤时,其组织中氧自由基的生成也会增多。而氧自由基会对组织细胞中的膜磷脂、蛋白质和核酸等生物分子造成相应的损伤,此时,机体将触发相应的自我保护机制。超氧化物歧化酶(superoxide Dismutase,SOD)是一种含有金属元素的活性蛋白酶,作为一种氧自由基的重要清除剂,在机体清除氧自由基的自我保护机制中起到主要的作用,从而起到保护骨骼肌组织的作用,故精确地测定血中SOD 含量的变化,可以比较客观地反映肢体骨骼肌缺血再灌注的损伤程度,SOD含量越低,说明该组织损伤的程度越严重[1,31-33]。
3.3 炎症因子测定
炎症因子是参与肢体缺血再灌注损伤的一个重要因素。在肢体发生缺血再灌注后,细胞会释放一氧化氮(nitric oxide,NO)、肿瘤坏死因子α(tumor necrosis factor α,TNFα)、白细胞介素-1及白细胞介素-6(interleukins,IL-1、IL-6)等炎症因子,对受损的细胞组织产生二次损伤。TNF-α是肿瘤坏死因子超家族的著名成员,也是最先发现的对于细胞死亡有重要影响的因子。Gao等[34]的研究中提到,TNF-α在心肌缺血再灌注损伤的相关研究中,降低TNF-α的水平能够提高脂联素(adiponectin,APN)的含量,以达到保护缺血损伤再灌注的效果。Hou等[35]的研究也证明了TNF-α在缺血再灌注损伤中的重要性,在TNF-α基因敲除小鼠中,从肾功能、组织学检查和缺血再灌注损伤致死后的总生存率等方面评价肾脏缺血再灌注损伤,都提示TNF-α基因敲除小鼠更具有生存的优势。López-Neblina等[36]的研究表明,在人类中,IL-10主要由单核细胞产生,而在未受外界刺激时,体内IL-10在组织中的表达量很少,体内IL-10的表达能够抑制多种炎性细胞因子的合成,并可以起到预防和限制炎症和避免不适免疫反应的作用,是一种保护因子。从Zhou等[37]在肝脏缺血再灌注损伤的相关研究中得知,肝细胞中有中性粒细胞浸润、炎症介质的释放和氧自由基的形成,而这些是导致肝损伤的重要因素。其中IL-1是炎症的重要启动因子,在多个系统的缺血再灌注损伤中起重要作用。在其他研究中则普遍把缺血再灌注当作是一种强力的应激刺激,导致促炎症细胞因子的活化,黏附分子的表达及中性粒细胞浸润、细胞因子大量产生[37-40]。因此测定炎症因子的水平,包括IL-1、IL-6、TNF-α等炎症指标对于评价缺血再灌注损伤的程度也是非常可靠的。表1归纳总结了常见的缺血再灌注损伤评估指标。
表1 缺血再灌注损伤评估指标
Table1Evaluation indexes of limb ischemia-reperfusion injury
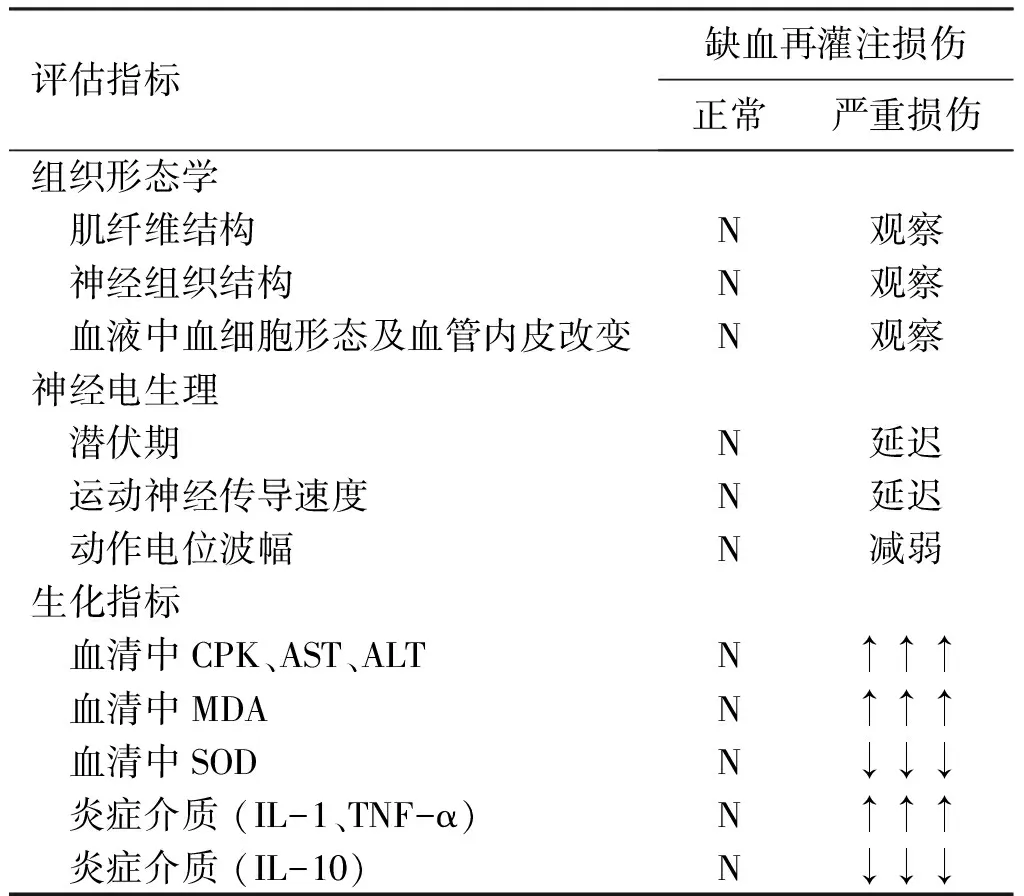
评估指标缺血再灌注损伤正常严重损伤组织形态学 肌纤维结构N观察 神经组织结构N观察 血液中血细胞形态及血管内皮改变N观察神经电生理 潜伏期N延迟 运动神经传导速度N延迟 动作电位波幅N减弱生化指标 血清中CPK、AST、ALT N↑↑↑ 血清中MDA N↑↑↑ 血清中SOD N↓↓↓ 炎症介质 (IL-1、TNF-α)N↑↑↑ 炎症介质 (IL-10)N↓↓↓
注:N为正常值,观察表示通过观察得出结论,↑↑↑越高越严重;↓↓↓越低越严重
4 结论与展望
随着缺血再灌注损伤机制研究的进展,从细胞到分子,从分子到基因,会有更多的测量指标出现,以适应研究的不断深入。但是现阶段对于缺血再灌注的损伤研究大都还只局限于动物实验,在临床的研究和使用仍然十分欠缺。动物和人体之间还是有一定的差别,因此需要更多、更快速简洁、伤害更小的测定方法去评定肢体缺血再灌注损伤的程度,为以后相应的治疗器械和治疗方法提供一个可靠、安全和有效的评定方式。

