印度黄檀化学成分分离及结构鉴定
李然,徐长琼,祁龙凯,李静,黎春辉,蔡聪,叶耀祥,林励
(1.岳阳市中医医院,湖南 岳阳 414000; 2.广州中医药大学中药学院,广东 广州 510006; 3.广东省湛江南药试验场,广东 遂溪 524338; 4.广东中檀实业有限公司,广东 台山 529200; 5.汕头大学医学院,广东 汕头 515041)
降香来源于降香檀,具有理气、活血化瘀、止痛止血的功效[1]。但降香檀资源因过度开采已面临濒危[2-3],而人工栽培需要10年才初步结香,30年才能成材,无法满足市场需求。
印度黄檀DalbergiasissooRoxb.为豆科黄檀属(Dalbergia) 落叶半落叶大乔木,原产于印度、尼泊尔、巴基斯坦、孟加拉国、巴西、马达加斯加等国[4]。印度黄檀为中药降香原植物降香檀D.odorifera同属植物,其心材曾进口作为降香药材使用,即《本草纲目》木部·降真香所载“俗呼舶上来者为番降”中的番降,具有化瘀止血、理气止痛之功效[5]。该植物生长迅速,种植5年生就能形成心材,10~15年基本成材[6],有望缓解降香檀资源紧张的局势。
印度黄檀心材主要含挥发油和黄酮类成分[7-8],具有舒张血管、降血压、降血脂、抗凝血、抗肿瘤、抗氧化、抗感染镇痛及抑制破骨细胞功能下降等药理活性[9-12]。黄酮类成分中黄檀素(黄檀内酯)具有抗肿瘤、抗菌、抗氧化[13]等生物活性,对离体兔心有显著增加冠脉流量、减慢心率、轻度增加心跳幅度的作用[14],对兔血浆有微弱的抗凝作用[15];4-甲氧基黄檀醌则表现出显著的抗感染活性及抗骨肉瘤作用[16-17]。
化学成分是植物药安全、有效、质量评价的物质基础。迄今为止未见专门对印度黄檀心材主要化学成分研究的报道。本课题对国内引种印度黄檀的乙醇提取液进行萃取,得到石油醚、三氯甲烷、乙酸乙酯和正丁醇部位,对石油醚部位、三氯甲烷部位、乙酸乙酯部位运用柱层析法、萃取法、溶剂法、结晶法等进行分离提纯,得到化合物单体。通过波谱数据分析,并参考各类文献资料,对化合物的结构进行鉴定。为印度黄檀质量标准的建立及资源开发提供科学依据。
1 仪器、材料与试药
1.1 仪器
DRX-500型核磁共振仪(瑞士Bruker公司);E2695型高效液相色谱仪(2998检测器,Empower3软件,美国Waters公司);Waters Symmetry ODS C18色谱柱(4.6 mm×250 mm,5 μm);HPLC-QQQ-MS/MS高效液相串联质谱仪(Agilent公司,6410A);Agilent HPLC 1290 系统;Agilent ZORBAX SB-C18色谱柱(1.8 μm,2.1 mm× 100 mm);BP 211D型电子分析天平(十万分之一,瑞士Sartorious公司);XS 225A型电子分析天平(万分之一,瑞士Precisa公司);Milli-Q Reference超纯水系统(德国默克密理博公司); WHF-203B 暗箱式三用紫外分析仪(上海精科实业有限公司);柱层析硅胶(80~100目,青岛海洋化工厂分厂,批号:0100634);反相硅胶C18(25~40 μm,Merk公司);GF254薄层层析硅胶预制板(青岛海洋化工厂);博世GHO 10-82电刨[博世电动工具(中国)有限公司];TC-15恒温电热套(1 500 W,海宁市新华医疗器械厂);KQ500型超声波清洗器(功率500 W,频率40 kHz,昆山超声仪器有限公司);EYELA N-1000旋转蒸发仪(日本EYELA公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市英峪予华仪器厂);DHG-9053A型电热恒温鼓风干燥箱(功率600 W,上海精宏实验设备有限公司);圆底烧瓶(10 L,广州蓝方化玻仪器有限公司)。
1.2 材料与试药
实验药材印度黄檀于2014年12月采自广东省湛江市遂溪南药试验场,树龄40年,经广州中医药大学中药学院实验中心林励研究员鉴定为豆科植物印度黄檀(DalbergiasissooRoxb.)的心材。标本保存于广州中医药大学中药学院实验中心。
乙醇(EtOH)、环己烷(CYH)、乙酸乙酯(EtOAc)、乙酸(HAc)、甲醇(MeOH)、石油醚(PE)、三氯甲烷(CHCl3)、正丁醇(n-BuOH)等均为西陇化工有限公司分析纯产品。提取用乙醇为工业级,甲醇(默克)、乙腈(默克)、H3PO4为色谱纯,超纯水为自制。
TLC显色剂:10%(体积分数,下同)H2SO4乙醇溶液、1%(质量浓度,下同)AlCl3乙醇液、碘蒸气等。
2 实验方法
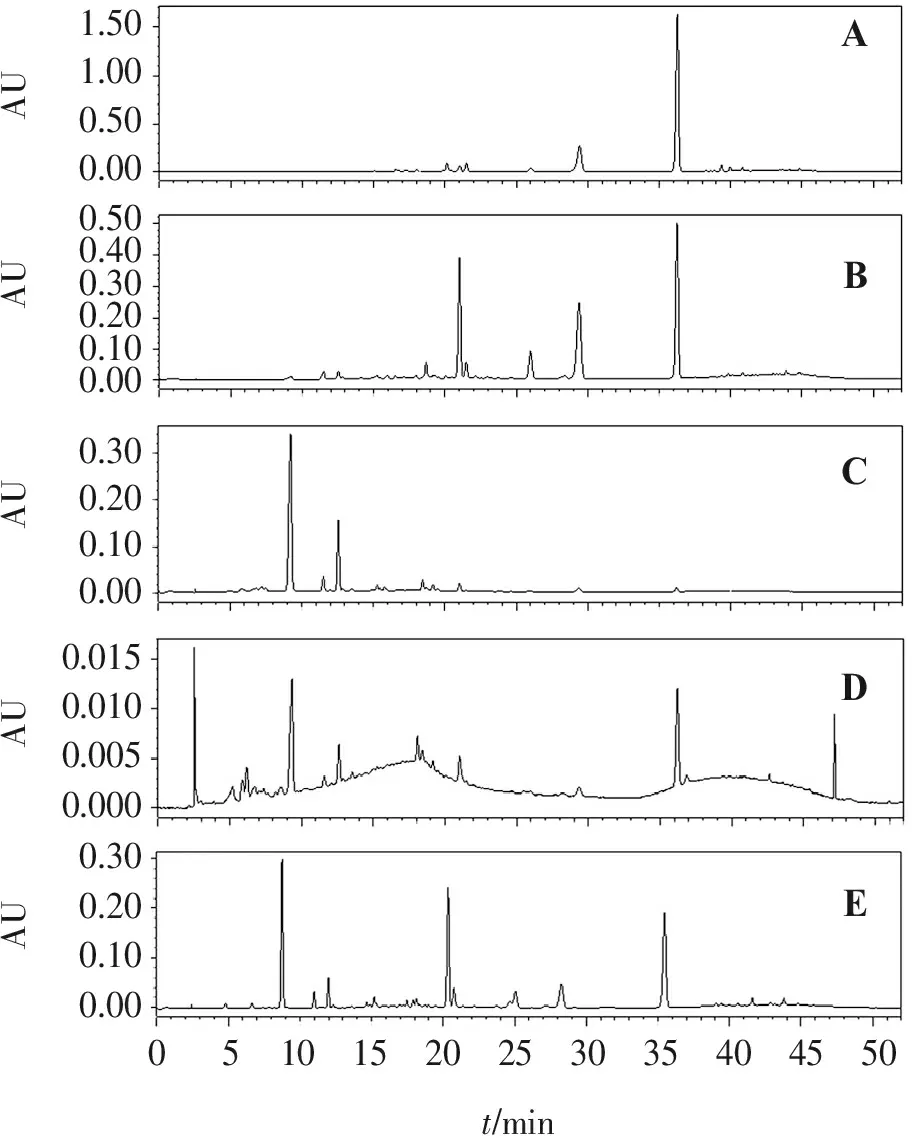
取印度黄檀心材1 000 g,刨成薄片后粉碎并过2号筛,提取溶剂为85%(体积分数,下同)乙醇,料液比为1∶4,加热回流提取3次,每次120 min。趁热滤过,合并滤液,放置12 h,取上清液,减压浓缩成稀浸膏状。依次用石油醚、三氯甲烷、乙酸乙酯、正丁醇萃取上述所得稀浸膏,萃取液与稀浸膏的比例为2∶1。分别减压回收各萃取液溶剂,得各提取部位浸膏,待用。分别得到石油醚(油状)、三氯甲烷(稠浸膏)、乙酸乙酯(稠浸膏)、正丁醇(稠浸膏)部位18.20、46.20、47.80、35.30 g,使用TLC和HPLC法分析印度黄檀醇提液及各部位化学成分,见图1。可见正丁醇部位中各成分质量分数较低,主要化学成分集中在石油醚部位、三氯甲烷部位和乙酸乙酯部位,故重点对石油醚、三氯甲烷、乙酸乙酯部位进行成分分离。
2.1 HPLC检测条件
色谱柱为Waters Symmetry ODS C18(4.6 mm×250 mm,5 μm);流动相为甲醇-0.2%(体积分数,下同)H3PO4水溶液,梯度洗脱,程序见表1;流速为1 mL/min;柱温为30 ℃;进样量为10 μL;检测波长:0~15 min为280 nm,15~22 min为260 nm,22~27 min为350 nm,27~30 min为260 nm,30~52 min为293 nm。印度黄檀不同提取部位及醇提液的HPLC色谱图见图1。

表1 梯度洗脱条件Table 1 Gradient elution conditions
1.501.000.500.00AU0.500.400.300.200.100.00AU0.300.200.100.000.0150.0100.0050.0000.300.200.100.00AUAUAU10152025303540455005t/minABCDE
A.石油醚部位; B.三氯甲烷部位; C.乙酸乙酯部位; D.正丁醇部位; E.印度黄檀醇提液。
图1印度黄檀不同提取部位及醇提液的HPLC色谱图
Figure1HPLC chromatograms of different extraction parts and alcohol extract ofDalbergiasissooRoxb.
2.2 色谱柱填装
2.2.1 硅胶柱 取80~100目硅胶适量,干法装柱,用真空泵抽气0.5 h,使装填物致密,将拌样后的硅胶均匀加入层析柱中备用,上端覆盖少许石英砂,最上端加1团脱脂棉以免加液时冲起装填物。
2.2.2 C18反相硅胶柱 取反相硅胶适量,干法装柱,上端塞1团棉花,以免加液时冲起硅胶。先用甲醇冲洗2~3个柱体积,再用10%(体积分数,下同)甲醇-水系统平衡反相硅胶柱,待用。
2.3 石油醚部位成分分离
2.3.1 梯度洗脱初步分离 将石油醚部位浸膏用少量乙酸乙酯溶解后加入一定量硅胶(80~100目)拌样,挥干溶剂,充分研磨,以硅胶柱进行柱层析,依次用环己烷-乙酸乙酯(体积比100∶0~100∶10)进行梯度洗脱,每份收集洗脱液约100 mL,共收集48份,经TLC 检识,合并相同组分。
2.3.2 收集、检识、合并及纯化 分别用不同展开剂展开所收集到的流分,用1% AlCl3溶液显色,相同组分合并,减压浓缩。将第18~38流分合并,用少量甲醇溶解,并用环己烷萃取,取上层环己烷层,减压回收溶剂,得黄色油状物,为化合物Ⅰ。使用HPLC法检测并用峰面积归一化法计算,其质量分数大于98.00%。
2.4 三氯甲烷部位成分分离
取甲醇溶解三氯甲烷部位稠浸膏(46.2 g),加入1.5倍量硅胶(80~100目)拌样,研磨均匀,水浴挥至无醇味,上样。依次用环己烷-乙酸乙酯(体积比100∶0~0∶100)进行梯度洗脱,每份收集约100 mL,共收集252份。经TLC检视,相同流分合并。结果:第 47~77 流分合并,减压浓缩,析出黄色针状晶体,用无水乙醇洗涤后重结晶,得化合物Ⅱ;第119~165 流分合并,减压浓缩,冷藏放置浓缩液,析出无色透明晶体,经环己烷-乙酸乙酯体系重结晶,得化合物Ⅲ;第178~212 流分合并,减压浓缩,用少量乙酸乙酯溶解后加入环己烷至稍浑浊,放置析出米黄色粉末,得化合物Ⅳ。
2.5 乙酸乙酯部位成分分离
2.5.1 硅胶柱色谱初步分离 取甲醇溶解乙酸乙酯部位浸膏(47.8 g),用1.5倍硅胶(80~100目)拌样,研磨均匀,水浴锅上挥至无醇味,上样。用环己烷-乙酸乙酯(体积比100∶0~0∶100)进行梯度洗脱,每份收集约100 mL,共收集145份,经TLC检视,相同流分合并。合并第 21~35流分,减压回收溶剂,待用;合并第 64~144流分,减压回收溶剂,待用。
2.5.2 C18反相硅胶柱色谱分离 用少许甲醇溶解收集到的21~35、64~144流分,加入1.5倍量C18反相硅胶拌样,水浴挥至无醇味,上样。依次用甲醇-水(体积比10∶90~100∶0)进行梯度洗脱,经TLC展开剂展开各流分,1%AlCl3显色,在254、365 nm紫外光下检视,相同组分合并,浓缩,放置析晶。结果:第21~35流分经C18柱后的第13~23流分进行合并,放置挥发溶剂,析出白色粉末,甲醇重结晶,得到化合物Ⅶ;第64~144 流分经C18反相硅胶柱后的第12~22流分进行合并,放置24 h,析出棕色沉淀,三氯甲烷-甲醇(1∶1)重结晶后得到化合物Ⅴ;第64~144流分经C18反相硅胶柱后第26~34流分合并,放置24 h,析出浅棕色沉淀,用乙酸乙酯重结晶后得到浅棕色粉末状化合物Ⅵ。
3 结构鉴定
化合物Ⅰ:棕黄色油状物,易溶于石油醚、三氯甲烷;易被氧化,被氧化后颜色加深,宜避光密封保存;最大吸收波长为293.2 nm;经HPLC检测并用峰面积归一化法计算得其质量分数为98.00%;EI-MSm/z,分子离子峰293.3[M+Na]+;核磁数据归属:1H NMR(CDCl3,500 MHz)δ:6.61(1H,s,H-3),6.95(1H,s,H-6),5.28(1H,br.d,J=6.6 Hz,H-7),6.43(1H,ddd,J=17.1,10.2,6.6 Hz,H-8),5.09(1H,dt,J=17.1,1.6 Hz,H-9a),5.34(1H,dt,J=10.2,1.6 Hz,H-9b),7.35-7.41(4H,m,H-2′,H-3′,H-5′,H-6′),7.29(1H,br.t,J=6.7 Hz,H-4′),3.80(3H,s,2-OCH3),3.87(3H,s,4-OCH3),5.77(1H,br.s,OH)。13C NMR(CDCl3,125 MHz)δ(124.1(C-1),150.2(C-2),97.2(C-3),145.0(C-4),139.1 (C-5),115.2(C-6),46.7(C-7),140.3(C-8),115.6 (C-9),143.0(C-1′),127.8(C-2′,C-6′),128.3(C-3′,C-5′),125.7(C-4′),55.7(2-OCH3),56.5(4-OCH3)。经与文献[18]对照,化合物Ⅰ与dalbergiphenol的波谱数据一致,故鉴定为dalbergiphenol,化学名:2,4-二甲氧基-5-[(s)-1苯基-2-丙烯基]苯酚。
化合物Ⅱ:黄色针状结晶,易溶于三氯甲烷、乙酸乙酯,微溶于甲醇;易被氧化,宜避光密封保存;最大吸收波长为262.3 nm;经HPLC检测并用峰面积归一化法计算得其质量分数大于96.00%;mp:115~117 ℃; TLC检测中,显色前在254、365 nm紫外光下检视无荧光,经1% AlCl3溶液显色后在365 nm紫外光下检视显黄色荧光,可见光下显黄色;EI-MSm/z,分子离子峰255.1[M+H]+;核磁数据归属:1H NMR(CDCl3,500 MHz)δ:5.92(1H,s,H-3),6.49(1H,d,J=1.2 Hz,H-6),4.93(1H,br.d,J=6.7 Hz,H-7),6.10(1H,ddd,J=17.2,10.3,6.7 Hz,H-8),5.00(1H,dt,J=17.2,1.3 Hz,H-9a),5.28(1H,dt,J=10.3,1.3 Hz,H-9b),7.19(2H,br.d,J=7.4 Hz,H-2′,H-6′),7.32(2H,br.t,J=7.4 Hz,H-3′,H-5′),7.24(1H,br.t,J=7.4Hz,H-4′),3.81(3H,s,4-OCH3)。13C NMR(CDCl3,125 MHz)δ:151.0(C-1),186.3(C-2),107.9(C-3)158.4(C-4),182.4(C-5),131.6(C-6),47.0(C-7),137.2(C-8),118.2(C-9),139.3(C-1′),128.5(C-2′,C-6′),128.7(C-3′,C-5′),127.2(C-4′),56.3(4-OCH3)。经对比,波谱数据与参考文献[19]中化合物5的波谱数据一致,故判定化合物Ⅱ为4-甲氧基黄檀醌(4-methoxydalbergione)。
化合物Ⅲ:无色透明针状结晶,易溶于乙酸乙酯、甲醇等有机溶剂;最大吸收波长为236.3、350.5 nm; TLC检测中,用1% AlCl3乙醇溶液显色后在365 nm紫外光下为天蓝色荧光,提示该化合物为黄酮类化合物。EI-MSm/z,分子离子峰587.1[2M+Na]+;核磁数据归属:1H NMR(CDCl3,500 MHz)δ:6.24 (1H,s,H-3),6.91(1H,s,H-5),6.86(1H,s,H-8),7.43-7.56(5H,m,H-2′,H-3′,H-4′,H-5′,H-6′),3.75(3H,s,6-OCH3),3.96(3H,s,7-OCH3)。13C NMR(CDCl3,125 MHz)δ:161.4(C-2),112.3(C-3),155.6(C-4),111.3(C-4a),107.3 (C-5),146.0(C-6),152.8(C-7),100.2(C-8),150.1(C-8a),135.7(C-1′),128.2(C-2′,C-6′),128.9(C-3′,C-5′),129.6(C-4′),56.3(6-OCH3),56.4(7-OCH3)。化合物Ⅲ的波谱数据与参考文献[20]中化合物O-methyldalbergin的数据一致,故鉴定为黄檀素甲醚(O-methyldalbergin)。
化合物Ⅳ:米黄色颗粒状结晶,易溶于乙酸乙酯、甲醇等有机溶剂;最大吸收波长为260.0、354.1 nm;mp:210~212 ℃; TLC检测中,用1% AlCl3乙醇溶液显色后在365 nm紫外光检视下为蓝绿色荧光,提示该化合物为黄酮类化合物。EI-MSm/z,分子离子峰559.3[2M+Na]+;核磁数据归属:1H NMR(CDCl3,500 MHz)δ:6.25(1H,s,H-3),6.99(1H,s,H-5),6.90(1H,s,H-8),7.40-7.52(5H,m,H-2′,H-3′,H-4′,H-5′,H-6′),3.99(3H,s,7-OCH3),5.61(1H,s,6-OH)。13C NMR(CDCl3,125 MHz)δ:161.5(C-2),112.5(C-3),155.7(C-4),112.3(C-4a),110.5(C-5),142.4(C-6),150.0(C-7),99.6(C-8),149.3(C-8a),135.6(C-1′),128.3(C-2′,C-6′),128.8(C-3′,C-5′),129.5(C-4′),56.4(7-OCH3)。经与文献[20]核对,鉴定化合物Ⅳ为黄檀素(dalbergin)。
化合物Ⅴ:棕色结晶,易溶于甲醇;最大吸收波长为237.5、277.8、344.5 nm。EI-MSm/z,分子离子峰323.3[M+Na]+;核磁数据归属:1H NMR(CD3OD,500 MHz)δ:5.29(1H,dd,J=13.3,2.9 Hz,H-2),2.99(1H,dd,J= 17.0,13.3 Hz,H-3ax),2.66 (1H,dd,J=17.0,2.9 Hz,H-3),7.18(1H,s,H-5),6.57(1H,s,H-8),6.93(1H,d,J=1.8 Hz,H-2′),6.78(1H,d,J=8.1 Hz,H-5′),6.80(1H,dd,J=8.1,1.8 Hz,H-6′),3.89(3H,s,7-OCH3)。13C NMR(CD3OD,125 MHz)δ:81.3(C-2),45.0(C-3),193.8(C-4),111.1(C-5),142.8(C-6),157.2(C-7),101.2(C-8),159.2(C-9),114.6(C-10),132.2(C-1′),114.7(C-2′),146.7(C-3′),146.4(C-4′),116.2(C-5′),119.2(C-6′),56.7(7-OCH3)。经与文献[21-22]对照,化合物Ⅴ与3,4,6-trihydroxy-7-methoxyflavanone的波谱数据一致,故鉴定为3,4,6-三羟基-7-甲氧基环烷酮(3,4,6-trihydroxy-7-methoxyflavanone)。
化合物Ⅵ:棕黄色颗粒状结晶;紫外最大吸收波长为238.7、280.1、345.7 nm。mp 212~215 ℃,易溶于乙醇,甲醇;EI-MSm/z,分子离子峰310.3[M+Na]+;核磁数据归属:1H NMR(CD3OD,500 MHz)δ:5.23(1H,dd,J=13.3,2.9 Hz,H-2),2.95(1H,dd,J=17.0,13.3 Hz,H-3ax),2.63(1H,dd,J=17.0,2.9 Hz,H-3eq),7.17(1H,s,H-5),6.38(1H,s,H-8),6.91(1H,br.S,H-2′),6.76(1H,d,J=8.1 Hz,H-5′),6.78(1H,br.D,J= 8.1 Hz,H-6′)。13C NMR(CD3OD,125 MHz)δ:81.1(C-2),45.0(C-3),193.8(C-4),111.4(C-5),142.1(C-6),156.0(C-7),104.2(C-8),159.3(C-9),114.0(C-10),132.2(C-1′),114.6(C-2′),146.7(C-3′),146.4(C-4′),116.2(C-5′),119.2(C-6′)。经与文献[21]对照,化合物Ⅵ与plathymenin的波谱数据一致,故鉴定为黄苏木素(plathymenin)。
化合物Ⅶ:黄白色粉末,易溶于三氯甲烷;经HPLC检测并用峰面积归一化法计算得其质量分数大于98.00%;mp:216~218 ℃; TLC检测中,用1% AlCl3乙醇溶液显色后在254、365 nm紫外光下检视,均显亮黄色荧光。EI-MSm/z,分子离子峰284[M+H]+;核磁数据归属:1H-NMR(400 MHz,DMSO-d6):δ12.92(1H,s,5-OH),10.87(1H,s,7-OH),8.35(1H,s,2-H);δ7.5(2H,dd,J=2.75,8.93 Hz,H-2′,6′),7.0(2H,dd,J=2.99,8.96 Hz,H-3′,5);δ6.39(1H,d,J=2.14 Hz,H-8),6.23(1H,d,J=2.14 Hz,H-6);δ3.79(3H,s,4′-OCH3)。13C NMR(400 MHz,DMSO-d6):δ180.5(C-4),164.28(C-7),161.95(C-5),159.12(C-4′),157.55(C-9),154.18(C-2),130.10(C-2′),130.10(C-6′),122.89(C-3),121.92(C-1′),113.66(C-3′),113,66(C-5′),104.43(C-10),98.98(C-6),93.66(C-8),55.12(4′-OCH3)。经鉴定,该物质为鹰嘴豆芽素A(biochanin A)。
以上化合物的分子结构式见表1,混合对照品、醇提物溶液的HPLC色谱图见图2。
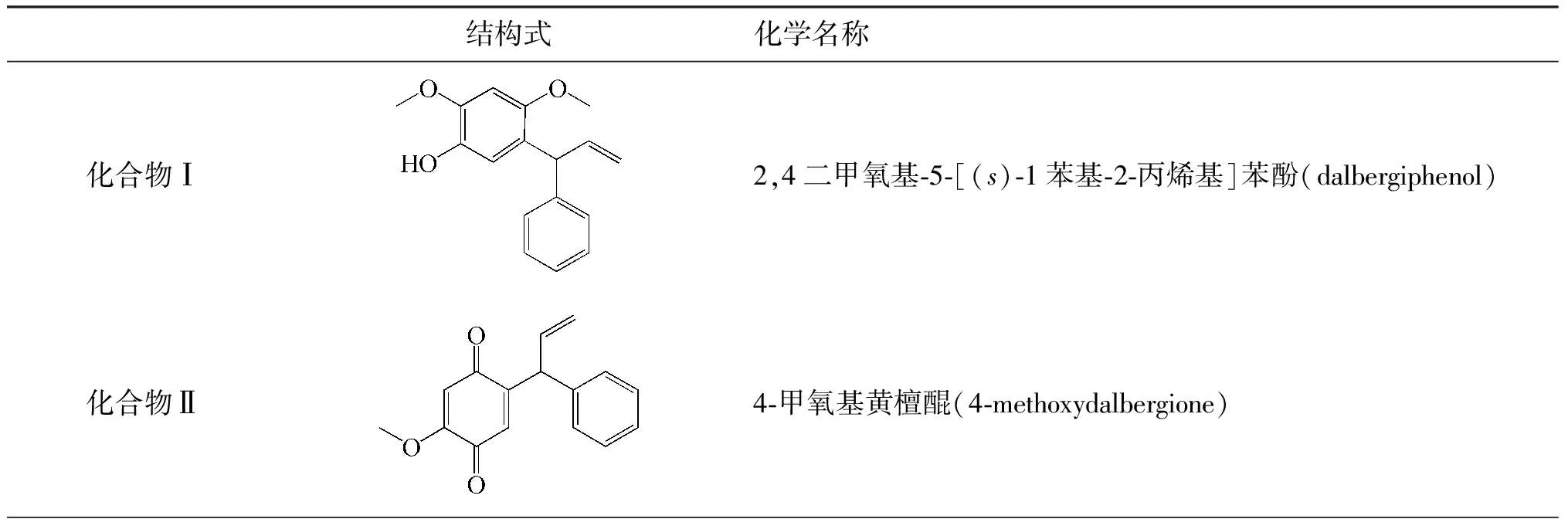
表2 印度黄檀的化学成分Table 2 Chemical constituents of Dalbergia sissoo Roxb.
表2 (续)

0.800.600.400.200.000.150.100.050.00AUAU10152025303540455005t/minBA7654321123456
1. 2,4二甲氧基-5-[(s)-1苯基-2-丙烯基]苯酚; 2 .4-甲氧基黄檀醌; 3.黄檀素甲醚; 4.黄檀素; 5. 3,4,6-三羟基-7-甲氧基环烷酮; 6.黄苏木素; 7.鹰嘴豆芽素A。
图2印度黄檀主要化学成分混合对照品溶液(A)、印度黄檀醇提液(B)的HPLC色谱图
Figure2HPLC chromatograms of monomers mixed solution (A) and alcohol extract ofDalbergiasissooRoxb.(B)
4 结论
通过硅胶柱、C18反相硅胶柱2种柱色谱方法,结合萃取法、溶剂法、重结晶法等对印度黄檀醇提物石油醚、三氯甲烷、乙酸乙酯萃取部位进行分离提纯。运用质谱、核磁等波谱数据,并参考文献资料,对化合物的结构进行鉴定。从石油醚部位分离得到化合物Ⅰ,鉴定为2,4-二甲氧基-5-[(s)-1-苯基-2-丙烯基]苯酚(dalbergiphenol)。三氯甲烷部位分离得到化合物Ⅱ、Ⅲ、Ⅳ,分别鉴定为4-甲氧基黄檀醌(4-methoxydalbergione)、黄檀素甲醚(O-methyldalbergin)和黄檀素(dalbergin),并使用HPLC峰面积归一法测定质量分数[23]。乙酸乙酯部位分离纯化得到化合物Ⅴ、Ⅵ和Ⅶ,分别鉴定为3,4,6-三羟基-7-甲氧基环烷酮(3,4,6-trihydroxy-7-methoxyflavanone)、黄苏木素(plathymenin)和鹰嘴豆芽素A (biochanin A)。通过HPLC峰面积归一化法计算,2,4-二甲氧基-5-[(s)-1-苯基-2-丙烯基]苯酚、4-甲氧基黄檀醌、黄檀素甲醚、黄檀素、黄苏木素等5种成分的质量分数占总成分的90%以上,为印度黄檀乙醇提取物中的主要成分。经分析发现7种化合物均为黄酮类化合物,其中有2种为新黄酮结构,2种具有查尔酮结构,2种有二氢黄酮类母体结构,1种有异黄酮类结构。黄酮类化合物具有多种生物活性,后期研究将对提取分离的单体化合物进行生物活性研究,为印度黄檀的资源开发利用提供更充分、科学、可靠的研究基础和依据。

