基于CT征象的Logistic回归模型预测纯磨玻璃样肺腺癌恶性浸润程度的临床研究
邱太春 尹柯 汝晓双 沈晶 陈影影 伍建林
随着高分辨率CT应用以及低剂量CT对肺癌的筛查增加,肺磨玻璃结节(ground glass nodule,GGN)的检出率越来越多,GGN定义为在高分辨率CT上局部肺组织呈模糊的轻度密度增高影,但是不影响其中的支气管血管束的显示[1],根据有无实性成分可分为纯磨玻璃结节(pure ground glass nodule,pGGN)和伴有实性成分的混合磨玻璃结节(mixed ground glass nodule,mGGN)[2]。对于pGGN的定性诊断是放射科医生面临的巨大挑战,pGGN通常是良性的,但也可以是腺癌,特别是原位腺癌或微浸润腺癌(minimally invasive adenocarcinoma,MIA)[3]。文献报道[4-6]CT征象可以评估pGGN的病理亚型。目前全球世界对于pGGN的管理策略还没有达到共识。pGGN的管理方法主要采取以下两种,一是合适的治疗方式,另一种是随访。有研究[7,8]显示局限性肺切除能够用于浸润前病变[不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)和原位腺癌(adenocarcinoma in situ,AIS),但浸润性腺癌(invasive adenocarcinoma,IA)]不推荐局限性切除。浸润性肺腺癌(invasive pulmonary adenocarcinoma,IPA)可表现为跳跃式纵隔内淋巴结转移,而肺门没有转移,浸润性肺腺癌组淋巴结清除的范围较浸润前病变的范围广[9]。因此,为了减少对pGGN的过度治疗与干预,需要一个模型来预测pGGN的病理类型(浸润前病变和浸润性肺腺癌),帮助临床合理管理pGGN。
资料与方法
1.临床资料
收集大连大学附属中山医院、大连市中心医院2013年1月~2018年4月的pGGN患者(共253个病灶)的临床资料及CT图像。入选标准:(1)病灶大小≤30 mm;(2)肺纯磨玻璃结节;(3)所有患者术前做胸部CT并且被手术病理证实为AAH、AIS、MIA或者IA。在模型建立组中,病理结果显示浸润前病变组52例,其中AAH 11例,AIS 41例;浸润性腺癌组中MIA 49例,IA 43例。在模型验证组中,病理结果显示浸润前病变组44例,其中AAH 7例,AIS 37例;浸润性肺腺癌组中MIA 22例,IA 40例。
2.检查方法
模型建立组中的数据扫描是采用Siemens Somatom Definition双源CT、Somatom Definition AS 64层CT,扫描参数:管电压100~120 kV,病灶位置处管电流200~280 mA,扫描层厚5 mm,重组为薄层1 mm图像;模型验证组中的数据扫描是采用美国GE Discovery HD 750、GE Light Speed VCT,扫描参数:100~120 kV,病灶位置处管电流200~300 mA,扫描层厚5 mm,重组为薄层≤1 mm。在吸气末进行肺部CT扫描,扫描范围自胸廓入口至肋膈角(包括全肺组织)。图像分析采用肺窗(窗宽1200 HU,窗位-600 HU)。所有的患者均在PACS工作站上进行病灶CT征象的测量。
3.图像分析
本研究所纳入的全是pGGN,分析的每个pGGN的CT征象包括以下:(1)病灶的大小;(2)平均CT值;(3)病灶边缘;(4)形状;(5)胸膜凹陷征;(6)空气支气管征:病灶内无异常空气支气管征、异常空气支气管征(图1a);(7)血管与病灶之间的关系分为3型:血管Ⅰ型,血管未进入病灶内或穿过病灶并没有细小分支;血管Ⅱ型,完整的血管穿过并有细小分支血管;血管Ⅲ型,血管扩张、扭曲或者盘旋相对于在相同图像的其他血管(图1b~d);(8)病灶内空气样密度影(空泡/空腔)。所有CT征象的分析由两名从事胸部影像诊断医师进行双盲观察,独立评估CT征象并达成统一。
在PACS系统上,每个病灶同时从轴位、冠状位以及矢状位观察。在轴位上,测量病灶大小(大小的定义为最长径和它正交最长短径的平均值)、平均CT值(最大横截面积并避免大的血管、支气管和空泡/空腔,用椭圆形、圆形ROI尽可能大的在病灶内部测量平均CT值)、观察病灶边缘是否光滑。空气支气管征、血管分型以及空气样密度影是通过轴位、冠状位和矢状位上观察。病灶内空气支气管征被定义为在结节内有分支结构的空气密度影,在纯磨玻璃结节中异常空气支气管是指支气管管腔扩张或走行扭曲。空气样密度影表现为小类圆形或圆形空气密度影(空泡/空腔)。如果两个观察者病灶的大小相差超过2 mm,平均密度CT值大于50 HU,将重新观察并达成一致。
4.病理分型
依据2011年国际多学科肺腺癌分类(IASLC/ATS/ERS分类),将病变分为浸润前病变组(包括AAH和AIS)和浸润性肺腺癌组(包括MIA和ICA)。
5.统计学方法
采用SPAA 20.0统计软 件,P<0.05被为有统计学差异,计量资料以±s表示。用独立样本t检验来分析病灶的大小(mm),平均CT值(HU)计量资料;用ROC曲线评估病灶大小和CT值鉴别浸润性肺腺癌的最佳临界点。用四格表检验和Fisher确切检验分析病灶边缘、形状、胸膜凹陷征、空气支气管征、血管类型和空泡或空腔计数资料。在Logistic回归中,将单因素分析中P<0.05的变量作为输入变量,采用逐步向后方法,建立Logistic回归预测模型。ROC曲线检验模型的诊断符合率。

表1 模型建立组与验证组患者的临床和CT影像特征
结 果
在模型建立组中,两组在病灶大小(11.5+5.1 mm比7.3+1.8 mm)、平均CT值(-569+97 HU比-622+98 HU)差异有统计学意义(P:0.000,0.001),浸润性肺腺癌组往往表现多边形/不规则形,边缘非光滑,异常空气支气管征,血管Ⅲ型(表1)。ROC曲线显示大小大于等于9.0 mm和CT值大于等于-624 HU是诊断为浸润性肺腺癌最佳临界点,将大小连续变量转化为分类变量(≥9.0 mm或<9.0 mm),将平均CT值转化为分类变量(≥-624 HU或<-624 HU)。二元Logistic回归分析显示区别浸润性肺腺癌和浸润前病灶的独立危险因素是病灶大小(P=0.000;95%CI为0.019,0.231;OR为0.066)和平均CT值(P=0.000;95%CI为0.039,0.374;OR为0.121)(表2)。Logistic回归等式构建的风险预测模型。
(1)P=ex/(1+ex)
(2)X=4.238+(-2.719×大 小)+(-2.110×CT值)+(-1.078×空气支气管征)+(-0.912×血管Ⅰ型)+(0.562×血管Ⅱ型)。
在公式中,当大小≥9.0 mm时,为0,否则为1;当CT值≥-624 HU时,为0,否则为1;异常空气支气管征时,为0,否则为1;当血管与病灶之间的关系是血管Ⅲ时,血管Ⅱ为0,血管Ⅰ为0;是血管Ⅱ时,血管Ⅱ为1,血管Ⅰ为0;是血管Ⅰ时,血管Ⅱ为0,血管Ⅰ为1;Logistic回归模型案例如图1e~f。在模型建立组中,Logistic回归预测模型ROC曲线下的面积为0.882(95%CI:0.829~0.935),敏感度79.3%,特异度82.7%(图2)。
在模型验证组中,经过组间数据106例pGGN验证,Logistic回归模型ROC曲线下的面积为0.868(95%CI:0.800~0.936),敏感度75.8%,特异度84.1%(图3)。

表2 模型建立组中二元logistic回归分析结果

图1 a)胸部CT显示病灶内异常空气支气管征(远端支气管较近端支气管扩张);b)血管Ⅰ型(血管未进入病灶或完整并没有分支小血管穿行病灶);c)血管Ⅱ型(病灶内穿行完整血管影并有小分支)、d)血管Ⅲ型(血管走行扭曲);e)右肺上叶后段见一类圆形纯磨玻璃影,大小约9.9 mm,平均CT值约-600 HU,其内见异常空气支气管征、血管Ⅱ型,经过Logistic回归模型P=e4.238+(-2.719×大 小)+(-2.110×CT)+(-1.078×空气支气管征)+(-0.912×血管Ⅰ型)+(0.562×血管Ⅱ型)/(1+e4.238+(-2.719×大小)+(-2.110×CT)+(-1.078×空气支气管征)+(-0.912×血管Ⅰ型)+(0.562×血管Ⅱ型)),大小为0,CT值为0,异常空气支气管为0,血管Ⅰ型为0,血管Ⅱ型为1;P=0.9918>0.5,为浸润性肺腺癌;f)术后病理结果为浸润性腺癌,贴壁+腺泡型(HE×40)
讨 论
1.CT征象鉴别浸润前病变和浸润性腺癌
本研究结果发现浸润性肺腺癌通常病灶更大,CT值更高,形状为多角/不规则形,边缘非光滑,许多研究[10-12]显示CT征象可以用来评估根据IASLC/ATS/ERS新分类肺腺癌的组织类型。本研究在鉴别浸润前病灶和浸润性肺腺癌,空泡或空腔、胸膜凹陷征没有统计学意义;在模型建立组和验证组中,空泡或空腔影通常出现在浸润性肺腺癌。Ichinose等[13]研究报道具有胸膜凹陷征的纯磨玻璃结节通常表现为浸润性肺癌。然而,Liu[14]和Lee等[4]报道胸膜凹陷征和空泡/空腔影在区分纯磨玻璃结节的浸润前和浸润性腺癌中没有统计学差异。与杨越清等[15]空气支气管征分型一致,将空气支气管征分成2型(异常空气支气管征和非异常空气支气管征),异常空气支气管征对病变的浸润性有一定预测价值。Lim等[16]报道空气支气管通常更常见于浸润性腺癌。支气管改变主要因肿瘤细胞沿着肺泡壁伏壁生长,继而侵犯支气管管壁走形僵硬、扭曲,同时刺激病变内部促纤维化反应使支气管被牵拉扩张[17-19]。根据Wang等[6]的研究,笔者将血管与病灶的关系分成3型,纯磨玻璃结节中出现血管Ⅱ和Ⅲ型,提示有更高的恶性可能。研究结果显示血管Ⅲ型通常表现在浸润性肺腺癌中。AAH由Ⅱ型肺泡上皮细胞或Clara细胞转变而来,其多沿肺泡壁及呼吸性细支气管管壁分布,属于轻度或中度不典型增生。因此,血管Ⅱ型更常见于AAH。肿瘤细胞的代谢比正常组织更快,需要更多的血供[20]。
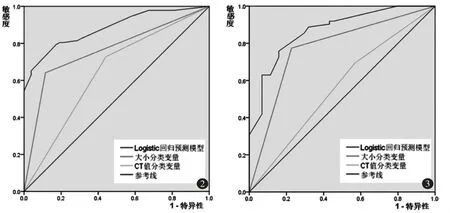
图2 在模型建立组中,区分纯磨玻璃结节浸润性肺腺癌的Logistic回归模型、独立危险因素的病灶大小与平均CT值的ROC曲线下面积分别为0.882(95%CI为0.829~0.935)、0.763(95%CI为0.68~0.843)、0.643(95%CI为0.547~0.739)图3在模型验证组中,区分纯磨玻璃结 节浸润性肺腺癌的Logistic回归模型、独立危险因素的病灶大小与平均CT值的ROC曲线下面积分别为0.868(95%CI为0.800~0.936)、0.773(95%CI为0.680~0.867)、0.563(95%CI为0.451~0.674)
2.预测模型诊断纯磨玻璃IPA的临床价值
CT征象是鉴别pGGN肺腺癌恶性浸润程度的基础,如何进一步提高CT检测与病理诊断的符合率,提高诊断准确性,仍是影像科医生奋斗的目标。本研究Logistic回归模型,大小小于9 mm(OR=0.066)、平均CT值小于-624 HU(OR=0.121)是预测IPA独立危险CT征象,在日常诊断工作中根据其权重大小以及结合其他CT征象来诊断pGGN肺腺癌恶性浸润程度具有更高的准确性,在模型建立组与模型验证组中,其ROC曲线下面积分别为0.882、0.868。Takashi等[21]有相似的研究结果,发现肿瘤的大小(≥11 mm)和CT值(≥-680 HU)是预测pGGN浸润性肺腺癌的预测因素,结合大小和CT值其敏感度和特异度分别为91.7%,71.4%,ROC曲线下的面积为0.82。但至今,少有研究报道预测模型来评估pGGN病理亚型。She等[22]应用诺谟统计 图 模型来鉴别浸润性腺癌与浸润前病变,其诊断符合率94%,主要观察指标包括病灶大小,形状,边缘,平均CT值和胸膜凹陷征。现已有研究者应用Logistic回归分析建立了肺良恶性结节[23],pGGN浸润性腺癌[24],临床分期ICA型肺癌中淋巴结转移[25]等预测模型。
总之,本研究建立的Logistic回归模型虽然数学公式复杂,但有较高的预测符合率。若一个pGGN包含了诊断模型中以下2个影像学征象:病灶大小大于等于9.0 mm和病灶CT值大于等于-624 HU,临床及放射科医师应该怀疑其为浸润性肺腺癌,采取合适的治疗方案;若pGGN小于9.0 mm,并且没有血管Ⅲ型和异常空气支气管征,可以建议随访观察。相信本研究对临床医生在管理pGGN上有一定的帮助。
研究局限性:(1)研究仅包括手术切除并病理证实的pGGN。因此,样本倾向更大,更具侵袭性的pGGN。(2)样本不是多中心研究,并仅收集患者CT影像数据,未纳入实验室检查等指标。(3)本研究的CT征象评估是两观察者统一的结果,没有分析每个观察者的评估结果。
综上,对于纯磨玻璃结节,病灶大小大于等于9.0 mm和平均CT值大于-624 HU是评估IPA的独立危险因素;Logistic回归模型能够高效能地预测IPA。

