SLC37A4基因突变致严重高甘油三酯血症的婴儿糖原累积病Ib型1例并文献复习
游承燕 符跃强
1 病例资料
女,8月,因“少食2月,发热1周”就诊。患儿生后配方奶喂养,入院前2月吃奶量下降,每天350~480 mL,伴反应欠佳,有少哭、少动,无发热、咳嗽,入院前1周出现反复发热,最高体温38.8℃,无惊厥及皮疹,予口服退热药或物理降温体温可暂降至正常。入院前2 d吃奶量较前下降,每天150~250 mL,反应低下,哭声弱,至重庆医科大学附属儿童医院(我院)急诊科就诊,以重度营养不良收治入院。
个人史和家族史:患儿系G1P1,足月顺产,出生体重3 600 g,否认出生时抢救和窒息史。母孕早期患“感冒”,口服药物治疗(具体用药不详)。否认家族性遗传病史,父母非近亲婚配。
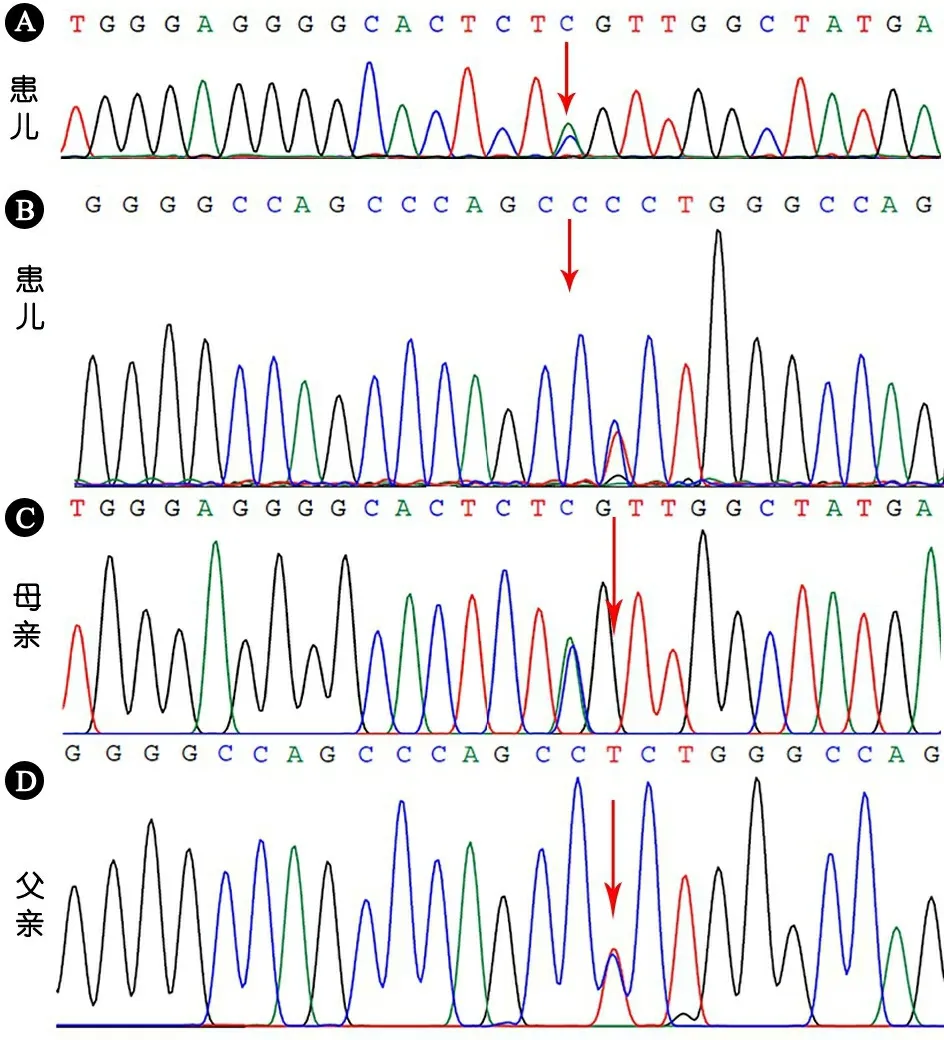
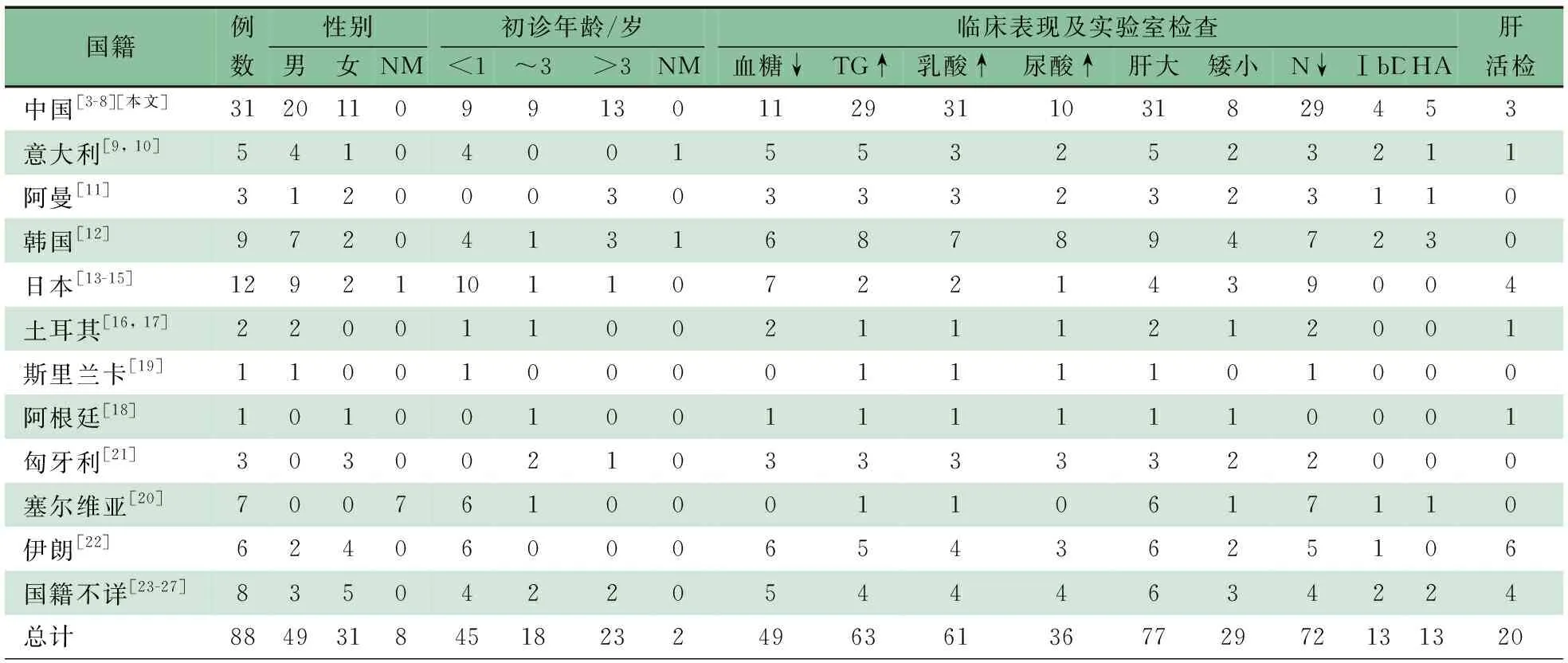
体格检查:体温36.2℃,呼吸46·min-1,氧饱和度95%,体重5 000 g( 实验室检查:血气分析pH 7.02,PaCO213 mmHg,BE -27.6 mmol·L-1,血糖 0.3 mmol·L-1,乳酸11.10 mmol·L-1,提示代谢性酸中毒、低血糖、高乳酸血症。ALT 24.6 U·L-1,AST 64 U·L-1,谷氨酰转肽酶115.8 U·L-1。入院时采集静脉血外观提示乳糜血,总胆固醇17.8(参考值:2.7~5.5) mmol·L-1,甘油三酯80(参考值:0.3~1.8) mmol·L-1,高密度脂蛋白0.59(参考值:0.91~2.04) mmol·L-1。 影像学检查:腹部超声检查提示,肝脏肿大,其内结构未见明显异常;双肾测值增大,实质回声增强,皮髓质分界不清,双肾盂稍分离;胆囊壁稍增厚。 诊疗经过:患儿入院后出现难以纠正的反复低血糖、严重低钾血症、血脂异常(表1),分别于住院第2和4 d予血浆置换降脂治疗,即予生理盐水3 000 mL+肝素1.5万U,生理盐水 500 mL预冲管路后,在枸橼酸局部抗凝下输注新鲜冷冻血浆400 mL,置换出乳白色血浆(图1),患儿无血液净化相关并发症。两次血浆置换治疗后血脂水平明显降低(表1),入院第3和4 d血乳酸值分别为5.7和4.9 mmol·L-1(参考值:0.7~2.1 mmol·L-1),血尿酸85.5~368.5(参考值:140~390)μmol·L-1。考虑遗传代谢性疾病,糖原累积病(GSD)Ⅰ型不能排除。予鼻胃管泵入脱脂奶、同时添加玉米生淀粉等治疗,患儿生命体征平稳,血脂水平明显下降,家长要求出院。 随访:出院后3月电话随访,患儿无神萎、惊厥、反复发热,稍多汗,予脱脂奶粉(每次240 mL,每3 h一次)和玉米生淀粉喂养。玉米生淀粉喂养1个月后家长自行停用,继续予脱脂奶粉和米糊喂养。1岁时复查血常规示中性粒细胞数0.40×109·L-1,甘油三酯14.7 mmol·L-1,总胆固醇6.5 mmol·L-1,血糖3.07 mmol·L-1。2岁1月时仅能独坐数分钟,不能扶站、走,不能说短句,因奶量进行性下降死亡。 表1 患儿血生化水平变化 注 1):当天血浆置换后进行的检测 图1血浆置换显示重度乳糜血 在取得患儿父母知情同意后,抽取患儿及其父母外周静脉血2 mL,使用Solpure Blood DNA Kit试剂盒(Magen公司)提取基因组DNA,取1 μg基因组DNA样本经Q800R超声破碎仪处理后得到约350 bp的DNA片段,制备测序文库,使用特异性捕获探针,对遗传性高脂血症相关的76个已知致病基因的目标区域(包括全部外显子及上下游各10 bp内含子)进行杂交捕获,富集目的基因片段,使用Illumina Nextseq 500高通量测序仪进行基因测序(广州嘉检医学检测有限公司)。测序数据评估合格后通过bcl2fastq软件进行生物信息学分析,与参考序列(Human GRCh37/hg19)进行匹配,生成变异列表,包括错义、无义、同义、移码、整码、剪切等。通过数据质量控制、变异频率和变异分类的筛选,以及变异与疾病的关系,锁定可能的致病突变。结果显示,患儿存在SLC37A4基因(GeneBank: NM_001164277)的复合杂合突变,其中10号外显子发现1个杂合无义突变c.1063G>T (p.E355*)(图2A),4号外显子存在1个杂合错义突变c.343G>A (p.G115R)(图2B)。c.1063G>T (p.E355*)变异的致病性已有文献报道[1, 2],与GSD Ⅰb型相关,验证结果显示该变异来源于患儿母亲(图2C)。c.343G>A(p.G115R)变异导致第115氨基酸由甘氨酸变异为精氨酸,该变异已在GSD Ⅰb型相关病例中报道[3, 4],应用PolyPhen和Varcards预测软件预测均为有可能致病,验证结果显示该变异来源于父亲(图2D)。先证者父母均为表型正常的杂合携带者。上述变异均不属于多态性变化,在参考人群基因数据库(ExAC和gnomad)中均无报道。 图2患儿及其父母SLC37A4基因测序 注 A:患儿c.1063G>T(p.E355*)杂合变异;B:患儿c.343G>A(p.G115R)杂合变异;C:患儿母亲c.1063G>T(p.E355*)杂合变异;D:c.343G>A(p.G115R)杂合变异 以“((Glycogen storage disease type Ⅰb) AND gene mutation) OR SLC37A4 ”为检索式在PubMed数据库检索;以“糖原累积病Ⅰb型”“SLC37A4”为关键词在万方数据库和中国知网检索;检索时间均为建库至2020年1月。共185篇英文文献,11篇中文文献,报道GSD Ⅰb患者224例。排除综述、动物实验、临床信息及基因突变序列不详或重复报道病例,纳入25篇文献(英文21篇,中文4篇),对其中87例临床信息完善的患儿[3-27]进行汇总分析,与本文合并后并88例患儿,详细信息见表2。 88例患儿中,男49例(55.7%),女31例,性别不详8例。婴儿期起病45例(51.1%),~3岁起病18例(20.5%),3岁以上起病23例(26.1%),起病年龄不详2例。77例肝肿大(87.5%),72例中性粒细胞减少(81.8%),63例高甘油三酯血症(71.6%),61例高乳酸血症(69.3%),49例低血糖(55.7%)。合并症包括高尿酸血症36例(40.9%),矮小29例(33.0%),炎症性肠病13例(14.8%)和肝腺瘤13例(14.8%)。行肝穿刺活检20例(22.7%)。 表3显示,对其中报告了基因检测结果的患者的突变位点进行汇总,共报道了92个突变位点[1-31],包括错义突变、框架移位突变、缺失突变、插入突变、无义突变(表3)。中国人种已报道的突变位点17个,其中c.572C>T(p.Pro191leu)最常见(15/57,26.3%),且仅在中国人种中被检出,有可能为中国人种特异性突变。 表2 88例GSD Ⅰb型患儿临床信息汇总(n) 注 NM:未提及;TG:血甘油三酯;N:中性粒细胞数;IBD:炎症性肠病;HA:肝腺瘤 GSD是一组先天性糖原代谢障碍疾病,根据所缺乏酶的种类不同和受影响的组织不同,分为12种类型。GSD I型由葡萄糖-6-磷酸酶系统功能障碍引起,患病率约为1/100 000,是一种常染色体隐性遗传病,是所有肝受累的GSD中最严重的一型[32]。葡萄糖-6-磷酸酶复合物系统位于内质网膜上,催化糖原分解和糖异生的终末反应。葡萄糖-6-磷酸酶缺乏导致GSD Ia型,约占GSD I型的80%以上;患儿出现严重空腹低血糖,继发性高乳酸血症、高尿酸血症;葡萄糖-6-磷酸转运体蛋白缺乏导致GSD Ⅰb型。由于葡萄糖产生不足,分解途径受阻,葡萄糖-6-磷酸通过糖酵解途径生成丙酮酸增多,从而生成过量的乙酰辅酶A,脂质合成增多,导致高甘油三酯血症和高胆固醇血症[33]。在GSD Ⅰ型患儿中,高甘油三酯血症、高胆固醇血症在Ⅰa型发生率更高、更严重,目前关于血脂严重增高的GSD Ⅰb型患儿的报道较少见。此外,部分GSD Ⅰb型患儿还表现为中性粒细胞减少或功能缺陷,导致反复发生的细菌感染[27]。 表3 SLC374Z基因突变位点汇总 SLC37A4基因突变导致葡萄糖-6-磷酸转移酶缺乏,导致GSD Ⅰb。目前研究报道,在GSD患儿中已检出SLC37A4基因超过110个独立的突变。本研究中SLC37A4基因的两个变异[c.1063G>T(p.E355*)和c.343G>A (p.G115R)]已在4例GSD Ⅰb型患儿中报道过[1-4],男3例,女1例;1例患儿临床信息不详,另3例均有中性粒细胞减少,2例表现为肝肿大、反复感染、高甘油三酯血症、高乳酸血症,1例行肝脏穿刺活检光镜及电镜检查。本文患儿有典型的空腹低血糖、肝肿大、高甘油三酯血症、高乳酸血症等临床表现,结合患儿基因检测结果,诊断为GSD Ⅰb型,因患儿家属要求出院,未行肝脏穿刺活检。有学者认为,对临床疑似GSD患儿行基因检测可明确诊断、避免肝活检[10]。从表2可见,在基因检测已明确诊断的情况下,GSD Ⅰb型患儿行肝脏穿刺活检的比例仅22.7%。 在2019年美国血浆置换协会更新的第八版血浆置换指南中[34],血浆置换可应用于包括家族性高胆固醇血症、高甘油三酯性胰腺炎(适应证包括重症、预防复发)、高脂蛋白血症(适应证包括进行性、动脉粥样硬化、心血管疾病)在内的多种疾病,可快速有效降低血脂水平。目前采用血浆置换治疗GSD I型所致高甘油三酯血症的报道罕见,国外仅见1例报道[35],国内尚未见报道。饮食限制、降脂药物等传统方法降血脂需要数天至数周,而血浆置换可在2~3 h显著降低各种病因导致的高甘油三酯水平。国外报道1例16岁严重高甘油三酯血症的GSD Ia型男性患儿,入院时血甘油三酯浓度为91.8 mmol·L-1,经血浆置换治疗6次后降至5 mmol·L-1,临床症状明显好转。本文患儿入院时全身状态差,呈乳糜血,总胆固醇17.8 mmol·L-1,甘油三酯80.0 mmol·L-1,行血浆置换治疗2次后,血甘油三酯和血胆固醇水平明显下降。 血浆置换治疗费用高,风险大,一般仅在血脂严重升高或合并严重并发症时使用。2002年欧洲GSD Ⅰ型管理指南[36]建议,通过多餐、连续夜间胃滴喂、喂食玉米生淀粉等饮食疗法预防低血糖发作,并尽可能抑制继发性代谢失代偿,如高乳酸血症、高尿酸血症和高脂血症等。即使采用适当的饮食治疗,一些患者的血甘油三酯和胆固醇水平可能仍高于正常值。为降低胆石症和胰腺炎的风险,在经过适当的饮食治疗后血甘油三酯浓度仍>10 mmol·L-1时,可使用降甘油三酯药物如烟酸、贝特类;胆固醇浓度持续升高(>8~10 mmol·L-1)时,可使用他汀类药物。据文献报道,中链甘油也可以降低低龄儿童血甘油三酯含量[37]。 由于玉米生淀粉能缓慢、稳定释放葡萄糖并吸收,相较其他碳水化合物,更能维持稳定的血糖水平。自20世纪80年代早期,玉米生淀粉饮食便用于治疗GSD I型引起的顽固性低血糖。本文患儿在行血浆置换治疗后,给予玉米生淀粉和脱脂奶粉进行饮食治疗以维持血糖、降低血脂水平。出院后3月复查,虽然患儿血脂仍较正常偏高,但未再发生严重代谢危象。本文患儿出院后3月随访血常规发现中性粒细胞减少,但无反复腹泻、口周及肛周皮肤感染等。 综上所述,GSD Ⅰb型患儿表现为严重高甘油三酯血症、难以纠正的反复低血糖、高乳酸血症和肝脏肿大等。基因检查能明确诊断,并分析病变基因的来源。当此类患儿表现为重度持续性高甘油三酯血症、危及生命时,可进行血浆置换治疗以快速有效降低血甘油三酯水平。此外,需给予脱脂奶粉、玉米生淀粉喂养以维持血糖正常水平、降低血脂。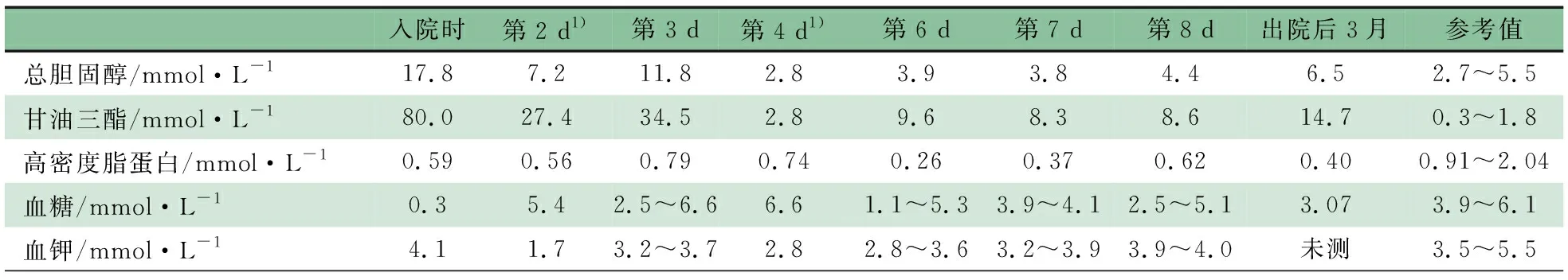

2 基因检测
3 文献复习
4 讨论