溶瘤病毒在肿瘤治疗中的研究进展
黄慧雅,陆荫英,谢 震
溶瘤病毒是指能通过不同的调控机制在肿瘤细胞内复制进而裂解肿瘤细胞,但不影响正常细胞生长状况的一类病毒。其在肿瘤细胞裂解的过程中会释放肿瘤特异性抗原,进而激活机体特异性免疫反应。所以溶瘤病毒可以通过直接裂解和免疫作用两种方式杀伤肿瘤细胞。溶瘤病毒在临床上的应用最早可以追溯到19世纪末,一名患有白血病的42岁女子在一次疑似感染流感病毒后肿瘤忽然痊愈。1912年意大利医生报道了一个晚期的宫颈癌患者在注射狂犬病疫苗后病情明显缓解的案例。溶瘤病毒临床研究和治疗在20世纪50年代和70年代出现过短暂的热潮,但由于溶瘤病毒易于被人体免疫系统清除而导致疗效不能持续的缺点,之后经历了一段研究低迷期。至20世纪90年代,重组病毒基因组改造技术逐渐成熟,大大提高了溶瘤病毒在肿瘤治疗方面的效果、特异性和安全性,一批抗肿瘤溶瘤病毒药物陆续成功上市。2015年,美国FDA批准安进公司的溶瘤单纯疱疹病毒talimogene laherparepvec(T-VEC)用于治疗黑色素瘤。同年12月T-VEC又获得欧盟批准用于治疗未转移至骨骼、脑部、肺部或其他脏器的不可切除的Ⅲb、Ⅲc、ⅣM1a期黑色素瘤。T-VEC的成功极大地推动了溶瘤病毒在肿瘤治疗领域的研发。本篇总结了溶瘤病毒在肿瘤治疗领域的最新研究进展,对溶瘤病毒种类变化、结构改进、参与肿瘤免疫治疗的机制以及临床应用现状及未来发展等方面进行了详细介绍,深入探讨了合成生物学对优化溶瘤病毒治疗技术平台的开发潜能。
1 溶瘤病毒的种类及研发现状
目前应用于肿瘤临床治疗的溶瘤病毒种类很多,大致可以分为两大类:一类是非基因编辑病毒,多为天然存在未经基因编辑的病毒;另一类是经过基因编辑改造,能够特异性地在肿瘤细胞中包装复制的病毒(表1)。
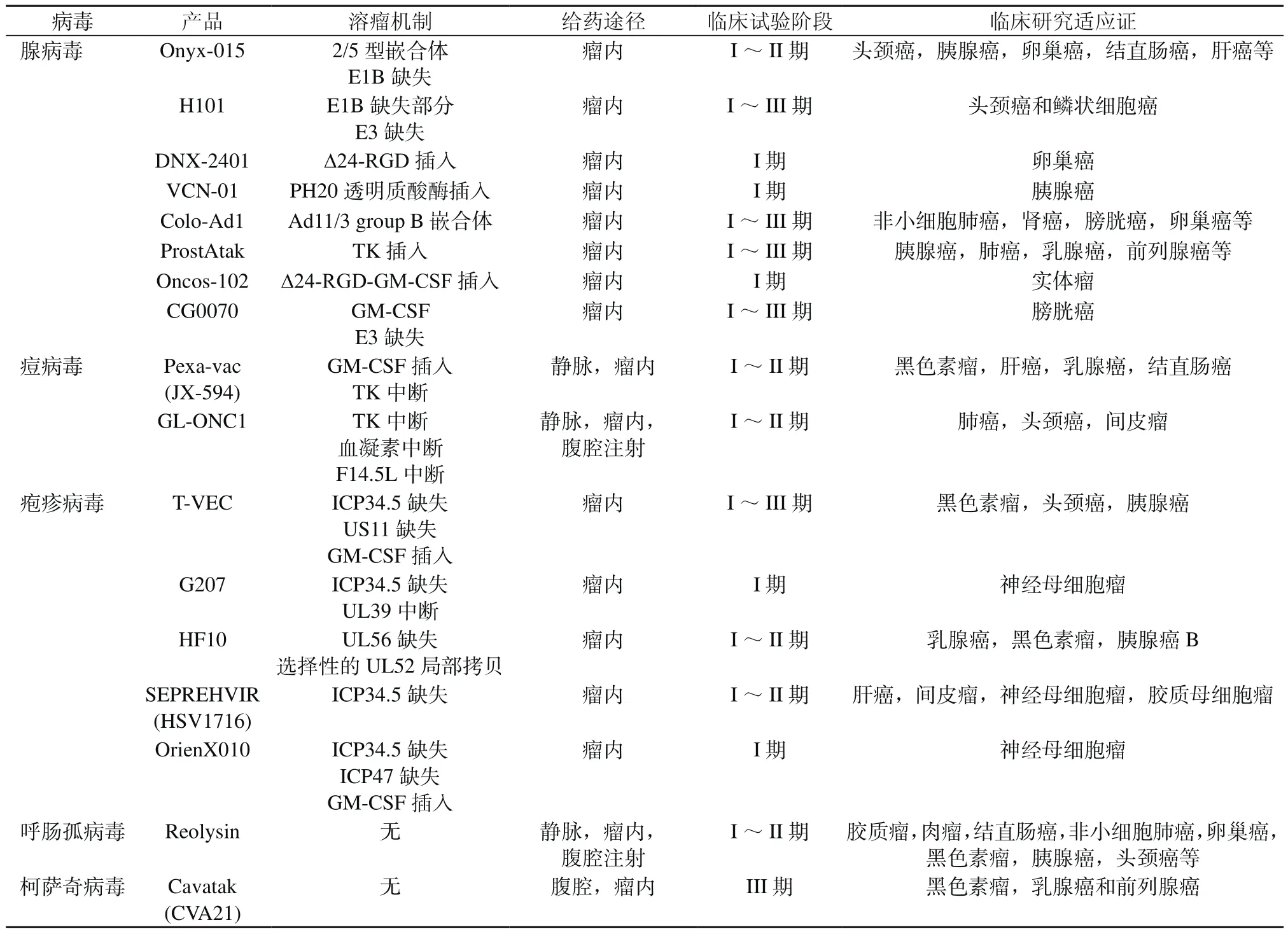
表1 溶瘤病毒抗肿瘤治疗药物信息汇总Table 1 Information summary of oncolytic viruses anti-tumor drug
1.1 非基因编辑型溶瘤病毒 非基因编辑病毒主要以M1病毒、呼肠孤病毒、新城疫病毒为代表[1]。M1病毒在动物实验中对多种肿瘤有治疗效果。通过尾静脉将M1病毒注射到小鼠模型中,发现其颗粒主要集中在肿瘤组织,能有效抑制肿瘤生长。并且与抗癌药物含缬酪肽蛋白抑制剂联用可显著增强M1病毒的抗肿瘤活性,增幅高达3600倍[2]。
呼肠孤病毒可以特异地在Ras信号通路激活的肿瘤细胞中包装复制,且不影响人体正常细胞[3],已被用于多种肿瘤的治疗。多个临床Ⅰ期和Ⅱ期的试验结果显示,呼肠孤病毒可以有效控制肿瘤细胞生长,并且在II期临床试验中几乎未观察到3~4级不良反应,患者出现最多的不良反应为发热(约86%),还有部分患者表现出寒颤、肌痛、疼痛、疲劳和恶心等症状[4-8]。2017年,一项利用Reolysin治疗晚期转移性乳腺癌患者的临床II期研究数据表明,在与紫杉醇联用治疗的患者中,总生存期从10.4个月延长到17.4个月,Reolysin获得美国FDA快速通道批准用于转移性乳腺癌联合治疗。作为一款可以通过静脉注射的溶瘤病毒治疗药物,Reolysin的临床应用对溶瘤病毒抗肿瘤药物的研发具有里程碑式的意义。
新城疫病毒是感染禽类神经系统和呼吸系统的病毒,可特异性的在哺乳动物的肿瘤细胞内复制,同时产生抗肿瘤细胞因子而促进肿瘤细胞坏死。目前已经应用于临床试验研究的代表性药物,主要有PV701和NDV-HUJ[9-10]。肿瘤细胞由于缺乏干扰素介导的抗病毒反应,无法像正常细胞一样清除病毒颗粒,而PV701可以特异性地在肿瘤细胞中复制进而裂解肿瘤细胞。2002年在一项静脉注射PV701治疗79例实体瘤患者的Ⅰ期临床试验中发现,患者在第一次给药后出现的流感样症状随着后续治疗的延续,不良反应次数和反应程度均降低。在较高剂量水平时疗效显著,无进展生存时间为4~31个月。治疗11个月后通过电子显微镜观察1例患者的肿瘤组织,发现了PV701颗粒从肿瘤细胞膜释放的证据;同时通过组织学检查观测到肿瘤组织中有明显的T淋巴细胞、浆细胞浸润[11]。在对11例恶性神经性肉芽肿患者使用NDV-HUJ株治疗的临床试验中,有1例患者在3个月内病情得到完全缓解,其余患者均未出现恶化现象,也没有严重的不良反应发生,在患者的尿、血液、唾液以及肿瘤切片上均能检测到该病毒[9]。Schirrmacher等[12]开发了一种双特异性抗CD28融合蛋白(bsHN-CD28),并将之与疫苗ATV-NDV连接。这种病毒修饰的自体肿瘤细胞疫苗在结肠癌患者肝转移切除后的Ⅰ期治疗中显示出治疗效果。在对14例晚期结直肠癌患者进行了以bsHN-CD 28为载体的ATV-NDV疫苗治疗后无严重不良反应记录。所有患者在5次治疗中至少有1次表现出抗肿瘤的T细胞免疫反应。
1.2 基因编辑型溶瘤病毒 临床试验网站(www.clinicaltrials.gov)的统计数据显示腺病毒、单纯疱疹病毒(herpes simplex virus,HSV)、痘病毒等可通过基因改造而广泛应用于溶瘤病毒的抗肿瘤治疗。
腺病毒作为溶瘤病毒药物具有十分显著的优势:①易于制备和纯化产生较高的病毒滴度,最高可达到1010~1012pfu;②基因组长度为36 kb,易于进行基因改造;③腺病毒DNA不会整合到感染的细胞基因组中,安全性比较高;④可以感染除血细胞外的多数哺乳动物细胞。但腺病毒自身免疫原性比较高,人体内存在腺病毒的中和抗体,溶瘤腺病毒只能通过瘤内注射方式治疗肿瘤,限制了其在临床上的应用。
目前溶瘤腺病毒主要有以下几种调控方式:①删除E1A CR2区或E1B55K基因,通过互补肿瘤细胞的P53基因表达缺陷,调控腺病毒在肿瘤细胞中特异表达[13];②利用肿瘤特异性启动子调控E1A基因在肿瘤细胞中特异表达[14-16];③通过基因编辑改造腺病毒衣壳蛋白结构,特异性识别肿瘤细胞表面受体实现对肿瘤细胞的特异性感染[17]。1987年Barker等[18]构建基因重组溶瘤腺病毒ONYX-015(d11520),并且通过瘤内注射的方式尝试治疗头颈癌、胰腺癌和再发性肉芽肿瘤等,临床试验中患者表现出感冒样症状和局部注射疼痛,但没有发现严重的不良反应。在头颈癌的临床试验中,注射部位在注射后10 d内可检测到腺病毒DNA,但并未在周围组织中观测到病毒增殖。单用ONYX-015(d11520)治疗客观缓解率并不理想(<20%),而联用顺铂等化疗药物后客观缓解率提高到63%[19-20]。安柯瑞是在中国获批上市的人5型基因重组腺病毒,结构类似于ONYX-015(d11520),主要用于头颈癌的治疗[21]。CG7060和CG7870利用前列腺特异性抗原(prostate specific antigen,PSA)启动子调控腺病毒E1A基因在前列腺癌细胞中特异性表达。在局部再发性前列腺癌的I期临床试验中,未发现受试者有严重的不良反应。联用多西他赛,36%的患者PSA水平下降,27%的患者6个月内观测到无肿瘤进展,但之后的研究并没有提供更好的结果[22]。由于腺病毒复制速度有限,并且人体内存在大量腺病毒中和抗体,单独依赖腺病毒的溶瘤作用治疗肿瘤效果十分有限。大量研究尝试通过利用溶瘤腺病毒表达免疫效应因子来提高抗癌效果,部分研究在小鼠实验水平已经取得了不错的进展,目前处于临床试验的不同阶段[23-25]。但由于目前溶瘤腺病毒的主要调控机制仍然以单一机制为主,在临床可以观测到病毒在正常组织泄露的现象。因此如何实现溶瘤腺病毒在临床水平的严谨控制仍然是一个值得研究的重大课题。
2015年美国FDA批准T-VEC用于黑色素瘤的治疗。T-VEC去除了HSV-1型的感染细胞蛋白(infected cell protein,ICP)34.5和ICP47,并可在肿瘤细胞内特异表达集落刺激因子(granulocytemacrophage colony-stimulating factor,GM-CSF),进而特异性杀伤肿瘤细胞。HSV-1作为溶瘤病毒有以下几个特征:①可以感染包括血细胞在内的大多数细胞;②不需要很高的感染复数就可以有效杀死肿瘤细胞;③基因组长152 kb,可携带较大片段外源基因[26]。HSV-1的ICP34.5可以与宿主的蛋白磷酸酶1结合,解除蛋白激酶R(protein kinase R,PKR)的抗病毒作用。在正常细胞中,缺失ICP34.5的HSV-1不能阻止磷酸化PKR的抗病毒作用,无法复制;而在肿瘤细胞中由于PKR含量低,病毒仍可复制[27]。除了去除ICP34.5因子,T-VEC还删除了ICP47基因。ICP47特异结合与抗原加工相关的转运蛋白,使外源肽无法与主要组织相容性复合物(major histocompability complex,MHC)I类分子结合,因此去除HSV-1的ICP47后,可以提高宿主免疫反应,增强对肿瘤的杀伤作用。另外,T-VEC还表达了GM-CSF,吸引树突状细胞(dendritic cell,DC)提高机体的抗肿瘤免疫反应[28]。除T-VEC外,处于不同阶段临床试验的多种溶瘤HSV被广泛应用于肿瘤治疗中,如恶性脑胶质肿瘤、乳腺癌、大肠癌、直肠癌、前列腺癌、头颈癌、膀胱癌、胃癌、卵巢癌、肝癌及恶性黑色素瘤等[29-32]。
JX-594(也称为Pexa-Vec)是由托马斯杰斐逊大学的Edmund Lattime博士实验室构建的溶瘤痘病毒,由SillaJen公司进一步开发,随后在黑色素瘤患者中进行临床研究[33]。由于缺失胸苷激酶基因,JX-594可以在高水平表达胸苷激酶如具有RAS或P53基因突变的癌细胞中表达复制,但不会对正常细胞产生影响。同时,JX-594可在肿瘤细胞中表达GM-CSF,引发机体抗肿瘤免疫反应。
在一项针对转移性黑色素瘤的临床试验中,7例瘤内注射JX-594病毒的患者中未被观察到严重的不良反应。2号和6号患者因为肿瘤过大未响应病毒治疗。另外5例(71%)肿瘤出现明显反应,其中1、4、5号患者的病毒注射部位肿瘤和远端肿瘤都有响应;3号通过联合外科手术切除肿瘤后完全治愈;7号患者完全响应,注射部位肿瘤和远端肿瘤完全消失。所有患者的肿瘤组织中都可以检测到GM-CSF表达,T细胞和B细胞浸润。3号患者7个月后仍能在肿瘤组织中检测出病毒[33]。Cripe等[34]在5例儿科患者中进行了多达3个肿瘤部位的一次性注射JX594(每千克肿瘤重量对应106~107pfu的病毒)的临床试验,入组患者的年龄为4~21岁,他们的癌症诊断包括神经母细胞瘤,肝细胞癌和尤文肉瘤等,所有患者毒性反应均≤3级,最常见的不良反应是鼻窦发热和窦性心动过速;高剂量组共3例患者,均出现无症状的1级治疗相关皮肤脓疱,并在3~4周内消退,1例患者的影像学检测数据证实了病毒抗肿瘤生物活性:磁共振成像显示注射病毒后肿瘤组织出现坏死变化,以及在首次注射病毒后第22 d正电子发射断层扫描的标准摄取值下降。这项研究证实JX594通过肿瘤内给药对儿科患者的安全性,并且可以在该患者群体中展开进一步研究。截至2018年6月JX594已有多项单独或联合治疗临床试验在肝细胞癌、实体瘤、肾癌和结直肠癌的治疗试验中进行。
2 溶瘤病毒高效参与肿瘤免疫治疗
有效的免疫治疗依赖于肿瘤微环境中的免疫反应,主要涉及以下几个方面:①高密度的肿瘤浸润细胞(tumor-in filtrating lymphocytes,TIL)可以保证较强的肿瘤免疫杀伤作用;②浸润淋巴细胞有效识别肿瘤特异性抗原;③解除肿瘤微环境中对肿瘤免疫治疗的抑制作用[35-37]。肿瘤细胞、免疫细胞和基质细胞组成了复杂的肿瘤微环境,主要包括以下几个区域:有丰富TIL浸润的免疫浸润区,完全没有免疫细胞浸润的免疫荒芜区和有部分免疫细胞浸润的免疫排斥区。将TIL高效募集到肿瘤微环境,同时阻断免疫抑制途径是保证免疫治疗效果的关键因素。
溶瘤病毒可以参与肿瘤免疫治疗的多个阶段(图1),有效招募淋巴细胞在肿瘤微环境富集:①直接裂解肿瘤细胞,进而释放肿瘤特异性抗原和免疫相关因子,诱发机体产生系统的抗肿瘤免疫反应;②表达外源治疗基因,吸引淋巴细胞在肿瘤微环境中的募集;③通过交叉提呈感染肿瘤细胞作为新抗原疫苗原位源,促使机体产生特异的抗肿瘤免疫反应,进而杀伤远端未受感染的肿瘤细胞[38]。

图1 溶瘤病毒参与肿瘤细胞杀伤的途径Figure 1 Oncolytic viruses affect multiple key steps in cancer immunity therapy
2.1 溶瘤病毒参与肿瘤免疫反应的途径 溶瘤病毒通过参与多种肿瘤进展相关机制、介导机体抗肿瘤免疫过程,发挥抗肿瘤活性。首先,溶瘤病毒可通过溶瘤作用直接杀死肿瘤细胞,导致可溶性肿瘤相关抗原释放,这些分子募集并激活抗原呈递细胞,如BATF3+DC。BATF3+DC吞噬可溶性肿瘤抗原并迁移至区域性淋巴结,进而引发针对肿瘤的适应性T细胞应答[39]。其次,病毒介导的干扰素和趋化因子表达释放导致抗原加工和表达因子水平增加如MHC I类分子的表达,同时加强肿瘤特异性浸润CD8+T细胞的募集,这些细胞毒性T淋巴细胞(cytotoxicity T lymphocytes,CTLs)识别并杀死肿瘤细胞,远端位点的肿瘤细胞也是CTLs的靶标[40]。同时干扰素的反调节作用可以增加免疫检查点的表达如程序性细胞死亡配体1,细胞毒性T淋巴细胞相关抗原4(cytotoxic T-lymphocyte-associated protein 4,CTLA4)和半乳凝集素9,使得肿瘤经过溶瘤病毒治疗后更容易响应免疫检查点阻断药物的治疗[41]。
2.2 溶瘤病毒治疗引发肿瘤微环境免疫反应 正常细胞具有比较完整的抗病毒机制,其可以通过环装GMP-AMP合成酶-干扰素基因刺激因子系统或者其他因子如PKR,NLRP3,干扰素-γ诱导蛋白16和寡腺苷酸合成酶等识别DNA病毒;通过维甲酸诱导基因,黑色素瘤分化相关蛋白5,Toll样受体3和7识别RNA病毒;这些识别因子可以促进干扰素-I表达介导病毒清除,增强 MHC I类分子表达和募集固有淋巴细胞。导致溶瘤病毒很难在正常细胞中复制包装。而肿瘤细胞中则普遍缺失抗病毒功能,因此溶瘤病毒可以在肿瘤细胞中顺利的复制包装[42-43]。另外,肿瘤细胞更容易受到病毒溶瘤作用的影响,从而导致局部释放病毒来源的病原体相关分子模式、细胞衍生的损伤相关分子模式以及干扰素-I,以诱导抗原递呈增加, MHC I类分子表达,BATF3+DC细胞募集,先天淋巴细胞和肿瘤特异性T淋巴细胞浸润等抗病毒免疫反应,而这些反应都是通过溶瘤病毒裂解肿瘤细胞释放的病毒及肿瘤特异性抗原的递呈引起的。所以溶瘤病毒具有增强新抗原递呈和肿瘤特异性T淋巴细胞浸润的双重抗肿瘤免疫效应[44]。
3 溶瘤病毒联合靶向药物增效肿瘤治疗
溶瘤病毒在肿瘤治疗过程中的多功能特性使其具有与其他药物联用增效的巨大潜力。与化学治疗药物顺铂、5 -氟尿嘧啶和ONYX–015联用,客观缓解率可达65%,相较于单独使用ONYX-015的15%的反应率有了显著提高[20]。在一项三阴性乳腺癌的临床前研究模型中,溶瘤马拉巴病毒可以提高难治性肿瘤对免疫检查点抑制剂的敏感性[45]。T-VEC(瘤内注射)与CTLA4抗体ipilimumab(静脉注射)联用治疗晚期黑色素瘤的客观缓解率为50%,其中44%患者的有效率持续6个月以上,并且没有观察到剂量限制性毒性。另外在一项针对黑色素瘤患者的I期临床研究中,对21例患者联合应用T-VEC和PD1 单克隆抗体 pembrolizumab治疗的结果显示,患者的客观缓解率为62%,完全缓解率为33%。另外,在联合ipilimumab与T-VEC的一项Ib期临床试验中,19例患者均未发现剂量限制性毒性,但3~4级不良反应的发生率为26.3%,其中15.8%为T-VEC相关,21.1%为ipilimumab相关,客观缓解率为50%,44%的患者有超过6个月的持续响应,18个月无进展生存率为50%,18个月总生存率为67%。T-VEC与ipilimumab联合用药具有较好的安全性,治疗效果明显优于T-VEC或ipilimumab的单药治疗[46]。另外,部分研究已经表明溶瘤病毒与放射性疗法和细胞治疗联合也可以提高治疗效果[47-51]。
尽管有溶瘤病毒的联合治疗方案已经表现出了良好的临床应用前景,但治疗细节还需要大量的研究进行探索,比如不同疗法组合方式、剂量选择、顺序选择以及时间选择等。同时不同溶瘤病毒免疫联用疗法适用患者的选择标准以及疗法评价时间点的确定都有待深入研究。
4 总结与展望
溶瘤病毒种类多、调控手段多样、可以作为载体表达不同功能的外源基因,这些是溶瘤病毒治疗肿瘤的优势。另外,溶瘤病毒可以整合到肿瘤免疫治疗的多个环节,募集肿瘤浸润淋巴细胞以及增强肿瘤新抗原递呈引起的肿瘤特异性免疫反应等特性为溶瘤病毒联用其他疗法奠定了基础。大量的临床研究结果已经显示了溶瘤病毒疗法尤其溶瘤病毒联用疗法在肿瘤治疗领域良好的应用前景。
但溶瘤病毒疗法仍然存在着很多须要解决的问题,这些问题是未来溶瘤病毒大规模应用要面对的挑战。首先从病毒选择和调控机制角度来讲,现有的溶瘤病毒的调控机制较为单一,无法精准识别肿瘤细胞,由此造成的脱靶效应所引起的不良反应会严重影响肿瘤的治疗效果。合成生物学以工程化的设计理念,构建标准化的元器件和模块,搭建逻辑线路,改造天然存在的生命体如细菌、真菌和细胞等,实现特殊的生理功能[52]。人们利用合成生物学手段对生命系统进行编辑,可以实现对生命系统的精准调控。利用合成生物学手段设计构建系统的分子开关,调控溶瘤病毒在肿瘤细胞中的复制,通过多水平、多输入信号的应用提高溶瘤病毒安全性的最优路径。其次,溶瘤病毒、肿瘤细胞微环境和免疫系统共同构成的复杂系统对溶瘤病毒疗法的疗效起着决定性作用。通过生物信息学手段分析治疗过程中三者的相互关系,确定溶瘤病毒的有效剂量和给药方式可以保证肿瘤治疗的效果。此外,在联用其他药物方面,最佳的病毒、联用方法药物剂量的选择,以及治疗顺序与时间等都须要进一步地研究。再者,环境、饮食和宿主自生肠道微生物菌群等如何参与影响溶瘤病毒治疗过程也是一个值得深入探讨的科学问题。总之,溶瘤病毒的多样性、可编辑性和多效性使它成为优化联合免疫治疗的理想平台。

