rAAV9-NGF基因转染糖尿病大鼠对心脏损伤的保护作用
易剑敏,岳 维,高 盼,张伟男
(山西医科大学 1. 麻醉系、2. 第二医院麻醉科, 山西 太原 030001)
相关资料显示,大约50%的糖尿病患者伴发明显的糖尿病周围神经病变(diabetic peripheral neuropathy,DPN),出现症状早,且病情隐匿不易发现。DPN易累及心脏感觉神经,引起神经纤维的变性,从而导致神经纤维进行性缺失和再生[1]。神经生长因子(nerve growth factor ,NGF)是神经营养因子家族中重要的一员,通过作用于高亲和力酪氨酸激酶A(tyrosine kinase A,TrkA)受体和低亲和力p75受体(75 kd neurotrophin receptor, p75NTR),调控中枢及周围神经的生长、发育及再生[2]。糖尿病心脏感觉神经病变可引起NGF表达下调,使受NGF调控的基因表达产物降钙素基因相关肽(calcitonin gene-related peptide, CGRP)大幅度减少,从而导致心脏感觉神经病变、心肌细胞凋亡和心功能不全[3]。CGRP分布于心血管组织中,具有舒血管作用,保护心肌细胞和内皮细胞,调节心功能[4]。重组腺相关病毒(recombinant adeno-associated virus,rAAV)具有安全性好、免疫源性低、转染时间长等特点,其中rAAV9有较好的心脏亲和力,能够稳定地转染到大鼠的心肌组织[5-6]。已有实验证明,外源性补充NGF可以营养正常的神经纤维,促进损伤神经纤维的修复再生,改善糖尿病导致的心脏神经病变,减少心肌细胞的凋亡,提高心功能[7]。课题组前期研究表明,糖尿病可使NGF表达减少。由此设想能否通过心肌转染技术,使NGF在大鼠心肌组织中过表达,本研究探讨能否通过心肌点注射的方法,利用rAAV9-NGF基因转染糖尿病大鼠的心脏,上调NGF的表达,由此产生对糖尿病大鼠心脏损伤的保护作用。
1 材料与方法
1.1实验动物健康♂SD大鼠32只,体质量200~250 g,7~8周龄,由中国人民解放军军事医学科学院实验动物中心提供,实验动物许可证:SCXK(京)2014-0013)。大鼠按随机数字表法分为4组(n=8):对照组(control组)、糖尿病手术组(D+P组)、糖尿病手术对照组(D+V组)、糖尿病转染组(D+NGF组)。实验操作程序经山西医科大学动物伦理委员会批准,并按实验动物使用的3R原则给予人道关怀。
1.2试剂与仪器rAAV9-NGF-GFP(滴度1.2×1015vg·L-1)、rAAV9-GFP(滴度1.6×1015vg·L-1),均购自上海汉恒生物科技有限公司;链脲佐菌素(streptozotin,STZ,美国Sigma公司);大鼠NGF ELISA试剂盒、大鼠CGRP ELISA试剂盒(上海西唐生物科技有限公司);NGF抗体(美国Santa Cruz Biotechnology公司);蛋白基因产物9.5(protein gene product 9.5,PGP9.5)抗体(美国Novus公司);CGRP抗体(美国Cell Signaling Technology公司);Alexa Fluor 594羊抗小鼠荧光二抗(美国Invitrogen公司)。小动物生命指标检测仪(四川仪器厂);Leica CM-1850恒冷切片机(德国Leica公司);BX-51型荧光显微镜(日本TKO光学仪器株式会社);Novapath酶标仪(美国Bio-Rad公司)。
1.3方法
1.3.11型糖尿病模型的制备 大鼠适应1周后,D+P组、D+V组、D+NGF组大鼠禁食24 h,继以腹腔注射STZ(50 mg·kg-1)。连续测量之后7 d的空腹血糖,以7次血糖值均>16.7 mmol·L-1为1型糖尿病造模成功。
1.3.2测定大鼠甩尾反射潜伏期 STZ注射前1 d及以后每周,使用小动物甩尾仪红外光源(光照强度40 mW·cm-2,最大刺激时间30 s)对准大鼠尾尖端进行照射,记录热痛刺激逃避性甩尾反射潜伏期。
1.3.3病毒转染 大鼠糖尿病成模后第4周,以质量分数为7%的水合氯醛(300 mg·kg-1)腹腔注射麻醉后,测血糖、体质量,经口直视下气管插管,连接呼吸机,并控制呼吸(潮气量=10 ml·kg-1,通气频率=70次每分钟,吸呼比= 1 ∶2)。将大鼠仰卧位固定于手术台,在胸骨体偏左侧1 cm处备皮消毒,暴露上皮组织,钝性分离胸壁组织直至肋骨,用血管钳从心尖搏动最强处进入胸腔并扩张,使心尖部暴露于视野。参考并已改良的实验方法[8],选取心尖部为注射区域,网格状选取5个注射点(点间隔约1 mm,深度1~2 mm),以前端针头被90°掰弯的胰岛素注射针,注射磷酸缓冲盐浓液(phosphate buffer saline,PBS)或滴度为0.8×1015vg·L-1的rAAV9-GFP、rAAV9-NGF-GFP各100 μL(每注射点20 μL),逐层关胸。术后连续3 d肌肉注射庆大霉素1万单位以预防感染。
1.3.4心功能指标的监测 转染后第5周(糖尿病造模后9周),大鼠以质量分数为25%的乌拉坦(5 ml·kg-1)腹腔麻醉,测血糖、体质量。连接小动物生命指标检测仪,监测大鼠心电图,分离大鼠右侧颈动脉,置动脉导管监测左心室收缩压(left ventricular systolic pressure, LVSP)、左心室舒张末压(left ventricular end-diastolic pressure, LVEDP)、心率(heart rate, HR)、左心室内压最大上升速率(+dp/dtmax)、左心室内压最大下降速率(-dp/dtmax)等指标。
1.3.5心肌组织NGF、CGRP含量测定 取左心室处心肌组织,在液氮条件下研磨至粉末状,按10 ml·g-1加入蛋白裂解液,冰盒裂解1 h(每10 min混匀1次)后,4 ℃、15 000×g离心30 min,取上清,严格按照说明书步骤,采用ELISA试剂盒测定样本NGF、CGRP含量。
1.3.6免疫荧光法测NGF、CGRP及神经纤维的表达 造模后第7周和第9周,取大鼠心脏,质量分数为4%的多聚甲醛固定,浓度梯度的蔗糖脱水,OCT包埋,最后冰冻切片机切片(厚度10 μm)。切片室温平衡30min,放入0.1%的Triton-100(用PBS 1 ∶1 000稀释)中,4 ℃冰箱内孵育10 min,后以PBS洗5 min×3次;滴加5%牛血清蛋白(BSA)封闭,室温孵育2 h;滴加以5% BSA稀释的一抗NGF(1 ∶200)、PGP9.5(1 ∶300)、CGRP(1 ∶500),4 ℃冰箱孵育过夜;将切片从冰箱取出,室温平衡10 min,以PBS洗5 min×3次;滴加5% BSA稀释的荧光标记的二抗(1 ∶1 000),室温避光孵育2 h,以PBS洗5 min×3次;甘油封片;荧光显微镜下观察。

2 结果
2.1大鼠生存状况D+P组、D+V组、D+NGF组均有1只大鼠死亡,大鼠死亡率组间差异无统计学意义(P>0.05)。
2.2大鼠甩尾反射潜伏期如Fig 1所示,与对照组相比,第4周后,其余3组的大鼠甩尾潜伏期均明显延长(P<0.05)。
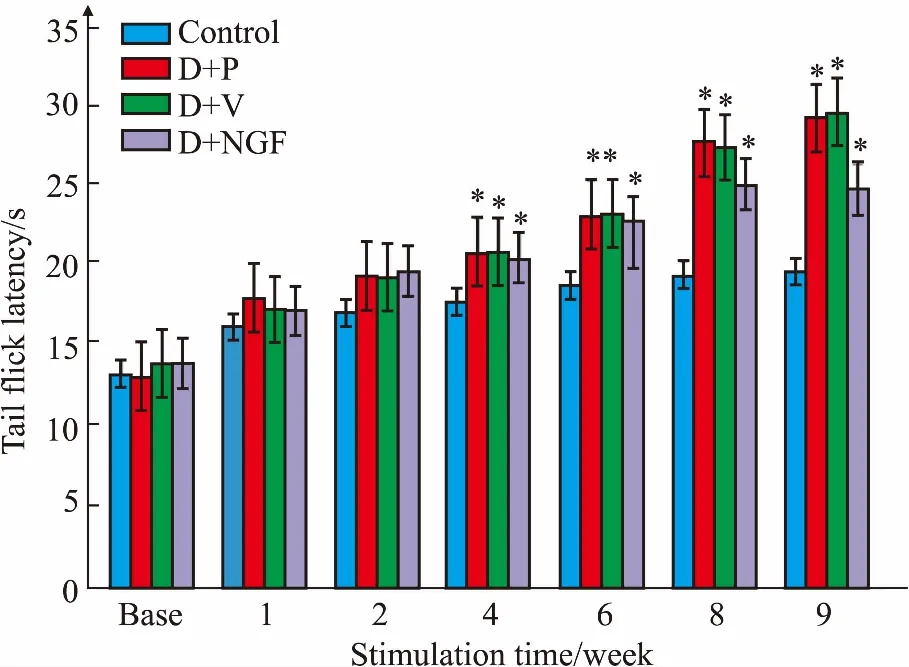
Fig 1 Difference in tail-flick latency of rats between each group n=6)*P<0.05 vs control group
2.3大鼠心脏免疫荧光观察结果因rAAV9-NGF自身携带GFP标签,故可借助免疫荧光技术验证外源基因NGF是否稳定转染入心脏组织中。如Fig 2所示,第9周时,D+V组和D+NGF组有大量的GFP蛋白散在分布于细胞内,表明病毒已稳定转染;而第7周时却未见GFP蛋白的表达,rAAV9-NGF未稳定转染。
如Fig 3所示,第7周时,与对照组相比,D+P组、D+V组和D+NGF组大鼠心肌处的NGF、CGRP和神经纤维特异性标记物免疫荧光减弱,但D+P组、D+V组和D+NGF组3组间无明显差异。如Fig 4所示,第9周时,CGRP免疫反应阳性神经纤维多见于心外膜和心肌层,尤其是血管周围和血管内皮处。D+P组和D+V组大鼠心肌处的NGF、CGRP和神经纤维特异性标记物PGP9.5比对照组和D+NGF组明显减少,而对照组与D+NGF组无明显差异。
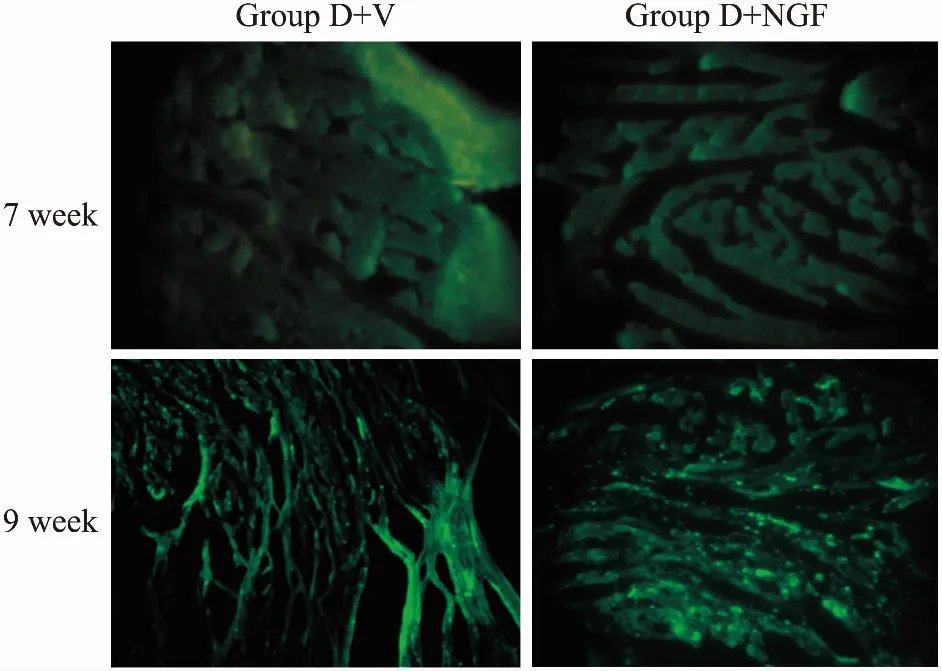
Fig 2 Expression of GFP in group D+V and D+NGF (×20)
At the ninth week, GFP could be seen clearly in group D+V and D+NGF.
2.4各组左心室心肌组织中NGF、CGRP的变化Tab 1结果显示,对照组心肌组织中NGF、CGRP含量明显高于D+P组和D+V组(P<0.05),提示糖尿病会导致心肌组织的NGF、CGRP表达下降。但D+NGF组的NGF、CGRP的含量却明显高于D+P组与D+V组(P<0.05)。对照组与D+NGF组差异无统计学意义。
Tab 1 Expression of NGF, CGRP in rat myocardium of each group n=6)
*P<0.05vscontrol group;#P<0.05vsgroup D+P;△P<0.05vsgroup D+V
2.5各组心功能指标的变化Tab 2结果显示,对照组的LVSP、LVEDP、HR、+dP/dtmax、-dP/dtmax明显高于D+P组和D+V组(P<0.05),提示糖尿病大鼠的心功能明显减弱。但D+NGF组的LVSP、LVEDP、HR、+dP/dtmax、-dP/dtmax却明显高于D+P组和D+V组(P<0.05)。对照组与D+NGF组间无差异。
3 讨论
DPN是一种由多病因引起的以血糖增高为特征的代谢性疾病,由于胰岛素缺乏和血脂异常等因素相互作用,影响感觉、运动和自主神经纤维,尤其是极易影响心脏的感觉神经,从而导致轴突萎缩、再生潜能减弱、发炎及纤维进行性丧失[9]。NGF广泛分布于周围组织、中枢及外周神经系统,不仅能营养神经元,而且能促进突触生长,是介于神经系统和心血管系统之间的一种介质,对大脑的发育、神经系统的生长、损伤神经的再生和功能恢复具有决定性的作用[2]。糖尿病心脏感觉神经病变发病机制包括缺血性微血管病变、NGF及其受体的缺乏、晚期糖基化终末产物的过度产生、氧化应激、线粒体功能紊乱、遗传易感性等,其中NGF及其受体的缺乏是一个极其重要的因素[10]。NGF的表达下调后,可使受其调节的神经肽CGRP减少,使心脏感觉神经纤维进行性缺失和异常再生,心肌细胞凋亡,心功能恶化[3]。研究证明,采用外源性的NGF治疗心脏感觉神经病变后,糖尿病导致的心脏感觉神经变性得到改善[11]。

Fig 3 Expression of NGF, CGRP and PGP9.5 in myocardium at 7th week (×40)
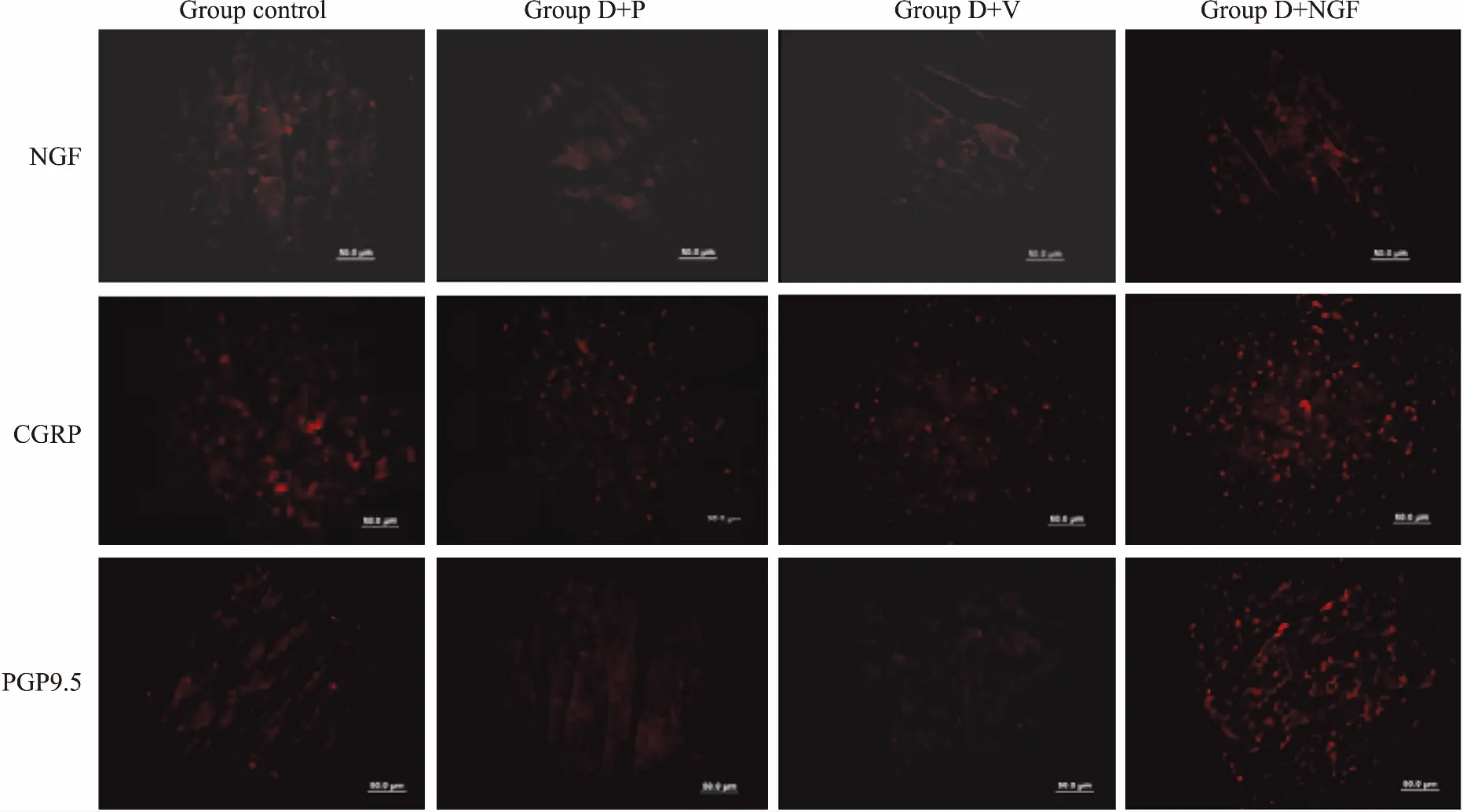
Fig 4 Expression of NGF, CGRP and PGP9.5 in myocardium at 9th week (×40)
Compared with group D+P and group D+V, the red fluorescence could be seen clearly in control group and group D+NGF.

Tab 2 Difference in cardiac function of rats in each group n=7)
*P<0.05vscontrol group;#P<0.05vsgroup D+P;△P<0.05vsgroup D+V
基因治疗为糖尿病心脏感觉神经病变开创了新的治疗途径。本研究采用腹腔注射STZ建立糖尿病模型,利用心肌点注射转染rAAV9-NGF基因至心肌组织上。结果表明,注射STZ后,大鼠出现热痛阈值升高,甩尾潜伏期延长,并随着病程的进展而更加明显。由于构建的病毒需要至少3周,才可稳定转染入心肌组织,因此,NGF基因转染后第2周(注射STZ后第6周)时并未见明显的GFP的表达,第5周(注射STZ后第9周)时可以看到明显的GFP表达,表明rAAV9-NGF构建成功且感染心肌组织,免疫荧光结果显示,心肌组织中,尤其是心外膜边界处和血管周围的NGF、CGRP和神经纤维分布增多。糖尿病大鼠心肌组织中NGF、CGRP蛋白的表达明显上调,心功能得到改善。
已有研究证实,心脏感觉神经元损伤时,NGF可与TrkA结合,导致自身酪氨酸残基磷酸化,逆转运至细胞质,产生多种信号分子,并将信号传递到细胞核,调控细胞基因的表达,如CGRP,发挥生物效应,从而维持受损神经元的存活和分化,决定轴突生长方向,促进受损神经修复,诱导突触延伸[12]。CGRP具有广泛的生物学效应,可以加强心肌收缩力,增加心输出量,提高灌注压,加快心率,降低血液黏稠度,改善心肌血管血流性质[4]。因此,本实验采用心肌点注射转染的方法,将rAAV9-NGF原位导入心脏组织中,使NGF过表达。前期研究表明,过表达的NGF通过选择性地结合TrkA和p75NTR,活化cAMP/Ras反应元件,然后持续激活MAPK信号转导通路ERK,进而上调CGRP的表达[13]。CGRP与其受体结合后,激活鸟苷酸环化酶,促进细胞内环磷酸腺苷和前列腺素的释放,发挥强大的舒血管作用[4],进而产生对心血管系统保护作用。
由此可以证实,rAAV9-NGF可以转染到糖尿病大鼠心肌组织中,且稳定表达,营养神经纤维,促进神经纤维的再分布,上调CGRP的表达,部分改善心功能,产生心脏保护作用。为临床有效地控制DPN,尤其是心脏的感觉神经病变,提供了新的治疗思路。