低氮源消耗和高产雷帕霉素菌株的选育
王欣荣 张雪霞 褚以文 郑智慧 苟小军 路新华
(抗生素研究与再评价四川省重点实验室,四川抗菌素工业研究所,成都 610052;2 华北制药集团新药研究开发有限责任公司,石家庄 050015)
雷帕霉素(rapamycin, RPM)是一种具有免疫抑制活性的大环内酯类抗生素。起初被作为低毒性的抗真菌药物,1989年开始把雷帕霉素作为治疗器官移植的排斥反应,是一种疗效好、低毒、无肾毒性的新型免疫抑制剂[1]。科学家近期发现它另外一种用途:可用于治疗阿尔茨海默症(老年性痴呆)。目前雷帕霉素已被成功开发为新型强效的免疫抑制剂,用于器官移植抗排斥反应;以及新型包衣涂层药物,用于涂层支架,防止心血管再狭窄;以雷帕霉素为基本结构单元进行衍生物的药物合成研究,使该类药物在抗肿瘤领域已有多个药物上市[2-3]。但由于发酵水平低、生产成本高,很多患者在经济上无法接受,因而,其推广应用受到了一定的限制。
通过物理或化学的条件进行随机的诱变是改良菌株的经典方法,虽然有效但通常需要耗费大量的时间和资源。“核糖体工程”是由日本国家食品研究所的Kozo教授[4]首先提出来核糖体工程(ribosome engineering)这一概念,它是以核糖体蛋白结构上的突变对微生物次级代谢调控作用的影响机制出发建立起来的微生物推理育种的新方法。常用于抗性筛选的抗生素有多种,其中以链霉素、利福平进行筛选的效果最佳[5-6]。
单菌多次级代谢产物(one strain many compounds,OSMAC)策略是通过改变培养基的营养成分、改变培养状态、表观遗传调控及添加酶抑制剂等方法,充分挖掘微生物合成次级代谢产物的能力[7]。雷帕霉素产生菌包括吸水链霉菌和游动放线菌等,它们的共同特点是发酵培养基中含有大量的棉籽饼粉、黄豆饼粉和玉米浆等复杂氮源,带来了巨大的环保压力。
本研究以游动放线菌SIIA-1602作为出发菌株,首次将亚硝基胍、核糖体工程育种和常压室温等离子体方法结合,用于高产雷帕霉素菌株的选育,在筛选培养基中加入赖氨酸或哌可酸,以期筛选得到发酵水平有较大提高,氮源利用更加高效的新菌株,提高雷帕霉素的产量,以便降低生产成本,减少废物排放,满足市场需求。
1 材料与方法
1.1 材料
1.1.1 菌种
出发菌株:游动放线菌SIIA-1602(ActinoplanesSIIA-1602),由本研究组保藏。
1.1.2 培养基及培养条件
平板及斜面培养基:葡萄糖,酵母提取物,可溶性淀粉,琼脂等;pH自然。
种子培养基:葡萄糖,酵母提取物,可溶性淀粉,玉米浆,氯化钠,CaCO3等,自来水配制,pH6.8~7.0。
发酵培养基:(1)对照配方(g/L):葡萄糖40.0,淀粉20.0,棉籽饼粉10.0,玉米浆10.0,黄豆饼粉20.0,氯化钠2.0,磷酸二氢钾2.0,甘油4.0,豆油8.0,CaCO34.0,自来水配制,pH7.0~7.2,摇瓶装液量25mL/250mL。
(2)配方1(g/L):葡萄糖40.0,淀粉20.0,棉籽饼粉10.0,玉米浆5.0,黄豆饼粉4.0,氯化钠2.0,赖氨酸8.0,磷酸二氢钾2.0,甘油4.0,豆油8.0,CaCO34.0,自来水配制,pH7.0~7.2,摇瓶装液量25mL/250mL。
(3)配方2(g/L):葡萄糖40.0,淀粉20.0,棉籽饼粉7.0,玉米浆5.0,黄豆饼粉5.0,哌可酸1.0,氯化钠2.0,磷酸二氢钾2.0,甘油4.0,豆油8.0,CaCO34.0,自来水配制,pH7.0~7.2,摇瓶装液量25mL/250mL。
1.1.3 试剂与仪器
试剂:链霉素购自Sigma公司;亚硝基胍,TCI;其余试剂均为国产分析纯,雷帕霉素对照品购自美国药典委员会。
仪器:立式蒸气压灭菌锅,上海申安医疗器械厂; ARTP诱变育种仪,无锡源清天木生物科技有限公司;Agilent technologies 1200高效液相色谱仪、摇床(美国NBS);10t微生物发酵罐系统(华北制药工程装备有限公司)。
1.2 方法
1.2.1 培养方法
斜面及平板培养方法:无菌环取菌种涂布于培养基上,培养温度28℃,培养9~12d。
种子培养方法:从活化的菌种斜面上挑取一环菌体接种至种子培养基中,培养温度28℃,摇床转速220r/min,培养80h。
摇瓶发酵方法:将培养80h的种子以6%接种量接入发酵培养基,培养温度28℃,摇床转速220r/min,培养168h。
10t发酵罐发酵方法:将培养60h的种子液(培养基以摇瓶发酵培养基的基础上,添加0.05%的泡敌)以5%接种量接入发酵罐(发酵培养基在摇瓶发酵培养基的基础上,添加0.05%的泡敌),发酵罐装液量为7000L,培养温度28℃,搅拌速度120r/min,通气量为7000L/min,培养周期6~8d。
1.2.2 菌悬液的制备
取新鲜斜面1支,加入灭菌的0.85%生理盐水10mL,用竹签刮下菌丝,制成菌悬液,玻璃珠30min,220r/min打碎,过滤,收集菌悬液,控制浓度为107CFU/mL。
1.2.3 NTG诱变
NTG用丙酮溶解,配制成浓度为10mg/mL。取1mL单孢子悬液,加入NTG母液,使终浓度分别为0.05和0.1mg/mL,震荡处理时间为25、50和75min,加入硫代硫酸钠终止反应,将经诱变处理的菌悬液稀释并涂布到平板培养基上,于28℃培养11d,计算致死率,并挑选单菌落斜面培养后采用3种发酵培养基进行初筛,高产菌株自然分离后进行复筛。
1.2.4 链霉素抗性诱变
以NTG高产突变株为出发菌株,将新鲜菌悬浮液涂布于链霉素浓度30~150mg/mL的平板培养基上,28℃培养11d, 观察生长情况,统计死亡率;挑取不同剂量下存活菌落继续培养11d,进行摇瓶发酵检测,考察菌种的突变倾向,确定最适筛选压力。在较适链霉素抗性筛选压力下筛选抗性菌株,斜面培养后采用3种发酵培养基进行初筛,高产菌株自然分离后进行复筛。
1.2.5 ARTP诱变[8]
将经上级诱变筛得菌株的单孢子悬液涂布于待照射载片上,按照ARTP生物诱变育种机的操作流程,以氦气为工作气体,点样量为10μL,风干时间20s,设定功率为120W,通气量为10SLM,等离子体发射源与样品间距离为2mm。处理时间为0、30、60、90、120、150和180s,将诱变处理后的孢子洗下,稀释并涂布到固体平板培养基上,置于28℃培养11d,计算致死率,并挑选单菌落斜面培养后采用3种发酵培养基进行初筛,高产菌株自然分离后进行复筛。
1.2.6 遗传稳定性的考察
将筛选出的高产菌株在斜面培养基上连续转接5代,每代菌株转接3种发酵培养基,检测雷帕霉素的产量,并对各代菌株的雷帕霉素产量进行分析比较,检验菌株的遗传性状是否稳定。
1.2.7 雷帕霉素效价分析方法[9]
取发酵液3mL,加入丙酮7mL混匀,超声处理30min,12000r/min离心,取上清液进行HPLC分析。色谱条件:C18(250mm×4.6mm, 5μm)色谱柱,流动相为甲醇:乙腈:水=60:25:30(V:V:V),柱温50℃,流速1.0 mL/min,检测波长277nm,进样量10μL。
1.2.8 氨基氮测定
准确吸取2.0mL滤液于250mL三角烧瓶中,加10mL纯水及0.1%甲基红指示剂2~3滴,加0.1mol/L HCl 1~2滴至红色,用0.02mol/L NaOH回滴定至黄色,加18%甲醛4mL,摇匀,放置5min,加酚酞2~3滴,以0.02mol/L NaOH滴定,滴至微红色为终点(颜色的变化顺序:红→黄→微红),记录NaOH毫升数,根据所耗NaOH毫升数,查表即得氨基氮的含量。
2 结果
2.1 NTG诱变
在0.05和0.1mg/mL的诱变剂量下,累计处理75min,致死率均达到80%以上(表1)。经诱变处理后挑取的单菌落200株经3种培养基初筛,0.1mg/mL NTG诱变50min,正突变率最高为32%。选取30株正突变高于15%的菌株经复筛后得到突变菌株N-092,采用不加前体物质赖氨酸或哌可酸的发酵培养基,发酵效价达到486μg/mL,较SIIA-1602提高了23.0%;而采用删减氮源添加前体物质赖氨酸或哌可酸的发酵培养基分别达到467和440μg/mL,较SIIA-1602分别提高了37.4%和57.1%。
2.2 链霉素抗性突变株选育
在链霉素30~150mg/mL范围内观察游动放线菌SIIA-1602的生长表现。菌落在30~50mg/mL剂量以内死亡率较小;在70~90mg/mL范围内死亡率逐渐增大;120mg/mL以上菌落生长极微弱,仅有极个别针点状菌落生长,不能确定是否是由于涂布不均匀或其它原因而存活,故而不进行筛选。

表1 NTG诱变致死率结果Tab. 1 The fatality rate curve of NTG mutagenesis
在链霉素50~90mg/mL的剂量范围内,挑取不同菌型共120株在3种发酵培养基上培养,考察雷帕霉素发酵单位,统计突变率(发酵单位变化超过±10%视为发生突变)。实验显示链霉素抗性剂量达70mg/mL时正向突变较好。
选取25株正突变高于15%的菌株经复筛后得到突变菌株SN-187,采用不加前体物质赖氨酸或哌可酸的发酵培养基,发酵效价达到548μg/mL,较N-092提高了15.4%;而采用删减氮源添加前体物质赖氨酸或哌可酸的发酵培养基分别达到562和522μg/mL,N-092分别提高了23.4%和19.5%。
2.3 ARTP诱变
菌株致死率与等离子照射时间呈正相关,ARTP处理90s,致死率为90%左右,处理时间为120s时,致死率达到100%)。经诱变处理后挑取的单菌落120株经3种发酵培养基初筛,ARTP处理90s,正突变率最高为33.6%。选取35株正突变率高于15%的菌株经复筛后得到突变菌株ASN-256,采用不加前体物质赖氨酸或哌可酸的发酵培养基,发酵效价达到615μg/mL,较SN-187提高了13.6%;而采用删减氮源添加前体物质赖氨酸或哌可酸的发酵培养基分别达到706和697μg/mL,较SN-187分别提高了26.2%和34.0%。
2.4 高产菌株的遗传稳定性实验
将经过3轮诱变筛选出的高产菌株ASN-256在斜面培养基上连续转接5代,其产孢速度基本一致;对照配方组、赖氨酸组和哌可酸组雷帕霉素的产量分别稳定在595~618、698~715和690~706mg/L,其结果见表2,表明该菌株的遗传性能基本稳定。
2.5 10t发酵罐试验结果
采用突变株ASN-256按照“1.2.1”项方法进行了10t发酵罐发酵研究,采用添加哌可酸的发酵培养基,分别在48和96h补加了哌可酸0.05%,其发酵过程中氨基氮和生物量变化曲线如图1,其发酵单位达到1250mg/L,比摇瓶发酵水平进一步增加了78.6%。菌株SIIA-1602采用在对照配方的发酵过程中,氨基氮和生物量变化曲线如图1,其发酵单位为439mg/L。在发酵过程中,哌可酸组的氨基氮水平和生物量约为对照组的50%和60%,放罐时由于菌丝开始自溶,对照组的氨基氮显著增加,而哌可酸组也略有上升。由于哌可酸组发酵单位明显提高,且最后一天单位涨幅减缓,可以考虑提前一天放罐,废液中的氨氮排放将大幅降低。经放罐粗提,哌可酸组产生的菌渣量为345kg,约为对照组的50%。
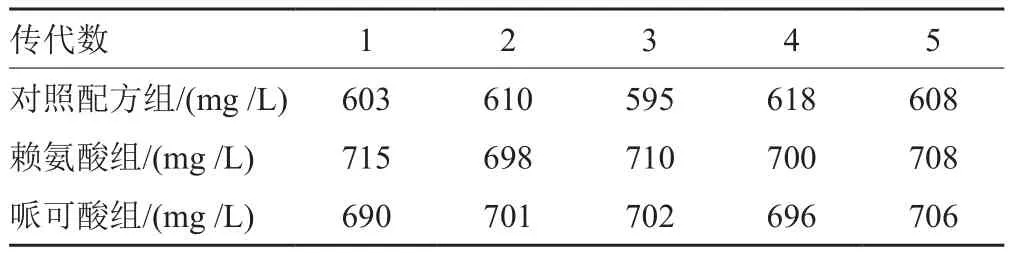
表2 A-256的遗传稳定性Tab. 2 The genetic stability of ASN-256
3 结论与讨论
以游动放线菌SIIA-1602为出发菌株,采用NTG诱变得到突变株N-092,发酵水平提高23.0%,采用删减氮源添加前体物质赖氨酸或哌可酸的发酵培养基则分别提高37.4%和57.1%;采用链霉素抗性诱变N-092,得到多株高产菌株,其中SN-187发酵水平较原出发菌株N-092提高15.4%,采用删减氮源添加前体物质赖氨酸或哌可酸的发酵培养基分别提高23.4%和19.5%;采用ARTP育种诱变SN-187,得到多株高产菌株,其中ASN-256发酵水平较原出发菌株SN-187提高13.6%,采用删减氮源添加前体物质赖氨酸或哌可酸的发酵培养基分别提高26.2%和34.0%。出发株游动放线菌SIIA-1602经过NTG诱变、链霉素抗性和ARTP诱变筛选得到的突变株ASN-256,其发酵水平提高了55.7%,发酵培养基删减氮源添加了赖氨酸和哌可酸后,发酵水平提高分别107.6%和148.9%。
在10t发酵罐通过流加哌可酸,使菌种ASN-256发酵单位进一步提高到1250mg/L,是菌株SIIA-1602采用配方1的发酵水平的2.85倍。菌种ASN-256总氮源使用量减少50%,放罐时氨基氮排放仅为菌株SIIA-1602的一半,菌渣量也显著降低。由于发酵单位大幅提高,提前一天放罐则可以减少菌丝自溶带来的废液氨氮增加,进一步降低发酵废液的氨基氮水平,使氨氮保留于菌渣,通过其它方式处理。
诱变育种是最常用的有效育种手段,采用多种诱变剂诱变育种,进行积累诱变,大大增加了菌株的突变频率。选择氨基糖甙类抗生素作为筛选压力,试图获得导致核糖体蛋白发生突变,同时又能够激活菌种产抗能力的变异株。根据雷帕霉素的生物合成途径研究可知,雷帕霉素由6个乙酸和7个丙酸单位组成聚酯环,合成起始单位为环外的环己烷,来源于莽草酸;环上的哌可酸来源于赖氨酸[10-11]。发酵培养基中复杂的有机氮源可以提供赖氨酸,但也造成了氮源的浪费,使培养基过于丰富,加大了后期发酵废液的环保处理压力。因此,采用化学结构导向的分子设计育种方法,结合OSMAC策略中改变营养成分的方法,通过改变筛选培养基,减少复杂氮源,加入赖氨酸或直接添加哌可酸,有可能筛选到直接利用哌可酸合成雷帕霉素的菌种,减少氮源的使用。根据目标产物的生物合成途径,在诱变筛选发酵过程中添加前体作为筛选压力,试图解除和缓解产物合成的限速步骤,可以进一步快速获得解除终产物反馈抑制突变株。本研究将抗性诱变应用于雷帕霉素生产菌株,结合NTG和ARTP诱变,结合OSMAC策略筛选得到具备链霉素抗性,氮源利用率显著提高的高产菌株。该菌株在生产能力、氮源利用和传代稳定性方面都获得了明显的改善和提高;发酵组分无明显变化,对后续工艺未产生不利影响。
经过诱变得到的突变株ASN-256雷帕霉素产量大幅提升,其发酵废液中氨基氮水平大幅降低,菌渣量也减少了50%,显著减少了环保处理的费用,降低了生产成本。在环境污染问题日益突出的今天具有较大的意义,符合节能减排的社会需求。
——雷帕霉素

