间歇性循环张力对人间充质干细胞成软骨分化的影响
杨必敬,汪 靖,葛 鑫,徐子昂,徐宏光
(皖南医学院第一附属医院 弋矶山医院 脊柱外科,安徽 芜湖 241001)
间充质干细胞(mesenchymal stem cells,MSCs)是干细胞家族中重要组成成员之一,属于多功能干细胞,具有多向分化的能力和自我复制的特点,研究证明MSCs在特定的环境下能够分化成骨、软骨、神经、血管等不同组织的细胞[1-2]。半月板的损伤可以破坏膝关节的稳定性并使其退变,利用间充质干细胞的治疗潜力可以恢复半月板的独特结构和功能,临床上也可以减轻患者的痛苦[3-4]。一定的力学刺激在人的骨骼发育、骨质生长、骨折的损伤修复过程中起到了重要作用[5],间歇性循环张力(intermittent cyclic mechanical tension,ICMT)可以重排软骨细胞的骨架引起细胞形态上的改变,但是短时间内给予适当的力学牵张可以调节钙化相关的基因表达从而维持软骨细胞表型和功能的稳定[6-7]。骨性关节炎是骨科中的常见病,其主要原因就是软骨细胞合成和分解平衡失调,导致软骨不断减少,从而发生炎症反应。目前临床上缺乏有效的方法去修复软骨细胞的缺损。本实验主要研究在间歇性循环张力作用下,能否促进干细胞向软骨方向分化,进而为探索出有效治疗骨性关节炎的新方法提供理论基础。
1 材料与方法
1.1 材料 人间充质干细胞购自美国ScienCell公司。试剂及仪器:DMEM/F12培养基、胎牛血清、胰蛋白酶、磷酸盐缓冲液(Gibico,美国);成人软骨诱导液(赛业生物科技有限公司,中国);CCK-8试剂盒(翔博生物科技有限公司,中国);凋亡试剂盒(凯基生物技术公司,中国);番红O染色试剂盒(索莱宝生物科技有限公司,中国);Trizol(Invitrogen,美国);Nano-Drop2000(Thermo&Scientific,美国);Real-time PCR试剂盒(Takara,日本);RT-PCR仪(Roche LightCycler480,德国);FX-5000细胞应变加载系统、BioFlexTM 六孔加力板(美国Flexcellint国际公司)。
1.2 方法
1.2.1 培养人间充质干细胞 复苏原代人间充质干细胞,将其放入37 ℃水浴锅快速融化,移入15 mL离心管并以10 000 r/min离心5 min,去上清,然后加入含10%胎牛血清的DMEM/F12培养基1 mL吹打混匀,接种到10 cm培养皿后放入培养箱内培养(37 ℃、5%CO2),3 d换一次液,直到细胞融合至80%~90%时按1∶2或1∶3传代,取P2代细胞进行实验,待P2代细胞贴壁后加入成软骨诱导液,实验分为加力组(10%伸长率、0.5 Hz、8 h/d)和对照组(不加力相同环境下培养)进行细胞检测。
1.2.2 用CCK-8试剂检测细胞增殖 取两组细胞,弃上清,每孔加入含100 μL CCK-8的培养液1 mL,放入培养箱孵育2 h,之后吹打混匀(注意不能产生气泡),每孔吸100 μL放入96孔板在酶联免疫检测仪上测量OD值,测量波长为450 nm,每组设4个副孔,计算其平均OD值,绘制细胞增殖曲线。
1.2.3 用流式细胞术检测细胞凋亡 收集两组细胞,取1×105细胞用500 μL Binding Buffer重悬,加入5 μL Annexin Ⅴ-FITC混匀,最后再加入5 μL碘化丙啶染色液混匀。室温、避光反应15 min,在流式细胞仪下检测细胞染色情况,利用Flow JO软件分析细胞凋亡情况。
1.2.4 番红O染色检测成软骨情况 取两组细胞吸去培养液,用PBS洗2次,再用4%的多聚甲醛固定5~6 min,PBS洗2遍,加入番红O染色5~6 min,吸除染液PBS洗涤,晾干后观察拍照。
1.2.5 RNA的提取及Real-time PCR 吸去六孔板中的培养液,用PBS洗两次,每孔加入1 mL Trizol冰上裂解20 min提取RNA,用Nano-Drop 2000测定RNA浓度并达到实验要求纯度,按20 μL反转录体系反转成cDNA后进行RT-PCR,每个样品均设3个副孔。反应条件:95 ℃预变性30 s;95 ℃变性5 s;60 ℃退火延伸25 s,扩增50个循环。PCR反应引物如表1,GAPDH为内参。使用Roche LightCycler480软件分析结果,计算2-△△Ct值。

表1 实时聚合酶链反应引物序列表

2 结果
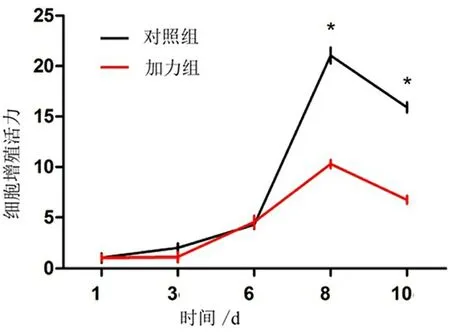
2.1 CCK-8检测细胞增殖结果 前期加力组与对照组的增殖水平大致相同,从第6天开始加力组抑制间充质干细胞的增殖,差异有统计学意义(P<0.05)(表2,图1)。

表2 两组CCK-8检测细胞增殖结果比较
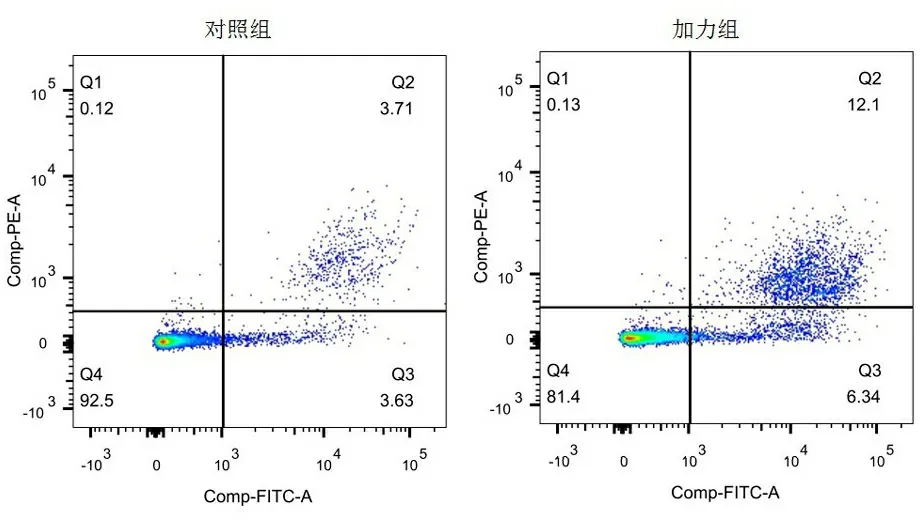
2.2 流式细胞术检测细胞凋亡情况 细胞培养第14天,加力组细胞凋亡数(17.62±0.75)多于对照组(8.26±0.81),t=14.786,P<0.01,说明加力促进细胞凋亡(图2)。
2.3 番红O染色检测成软骨结果 细胞培养第14天,番红O染色加力组颜色浅于对照组(图3)。
2.4 Real-time PCR检测软骨基因表达结果 第14天检测细胞软骨基因的表达水平,结果显示对照组软骨基因表达水平高于加力组,加力可以抑制ACAN、COLⅡ、SOX9的表达,差异具有统计学意义(P<0.05)。见表3和图4。
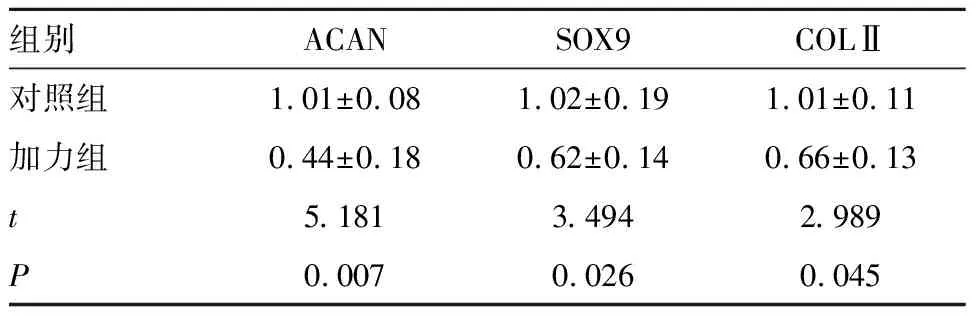
表3 两组Real-time PCR检测软骨基因表达结果

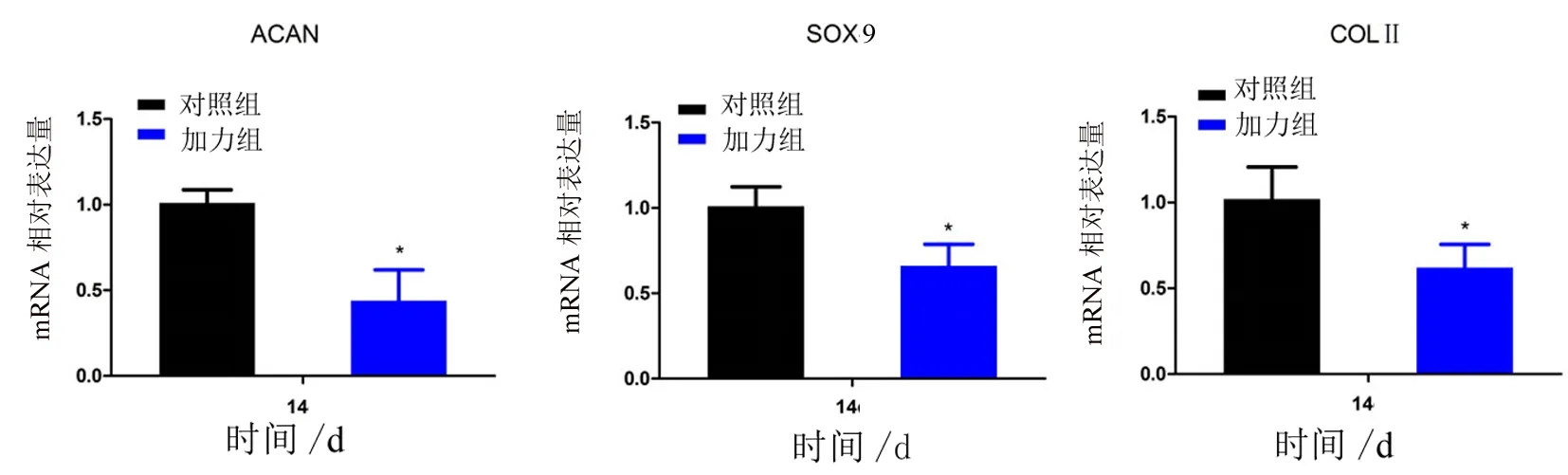
第14天加力组ACAN、COLⅡ、SOX9基因的表达水平低于对照组,差异具有统计学意义(*P<0.05)。
3 讨论
软骨细胞作为种子细胞存在来源不足、机体损伤及老化等多种问题,而间充质干细胞具有自我复制和多向分化的潜能[8-10]。我们可以利用间充质干细胞这一特性,找到固定的条件使间充质干细胞向成软骨方向分化,解决软骨组织工程中种子细胞来源问题。
机械牵张力是一种能够影响细胞功能和结构的外界刺激,不同种类的细胞具有明显的差异性,对相同的力学刺激所表达出的结果不同,同种类细胞对不同的力学刺激所产生的结果也不同[11]。研究表明适当的力学刺激可以加速牙周韧带干细胞的增殖和成骨分化,使产生破骨细胞和炎性因子的量达最低水平;过度的力学刺激则会导致相反的结果[12]。还有研究发现在没有任何生物化学因子影响的条件下,3%左右的牵张力可以促进间充质干细胞向成骨方向分化,而10%的牵张力可以使其向平滑肌细胞分化[13]。大部分的研究证明,力学刺激可以影响干细胞的增殖和成骨分化,但张力对人间充质干细胞成软骨分化影响很少有文献报道。本实验在10%的力学刺激作用下,通过检测间充质干细胞增殖,凋亡,体外成软骨染色和软骨基因的表达,证明了10%的力学刺激是抑制间充质干细胞向软骨分化的。当然本文的不足之处为只研究了10%的力学刺激,其他的力学强度以及力学频率还没有去验证。另外,我们之所以会选择第14天去检测软骨基因表型是因为番红O染色最少要两周才能染出软骨基质的颜色,我们想从同一时间点的软骨染色和软骨基因表达两个指标去验证力学刺激对软骨分化的影响。但是两周之前软骨基因的表达变化我们尚不清楚,所以加力后检测软骨基因表达的时间可能还需要调整。
目前软骨缺损和修复问题面临很大的挑战,本研究发现间歇性循环张力作用下影响了干细胞成软骨分化,这为临床上治疗软骨再生问题提供了新思路,同时也为今后骨关节炎的治疗奠定了实验和理论基础。

