EGCG恢复Sirt-1拮抗高糖诱导的PC12细胞凋亡
袁 晖,朱明亮,闫国防
(中国人民解放军第一六九医院 神经外科,湖南 衡阳 421000)
高糖微环境会导致神经细胞的病理生理变化,如自噬,内质网应激[1]等,诱导神经细胞凋亡,导致神经系统中枢性及周围性病变,危害人类的健康。表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是绿茶中提取的多酚的活性成分,对细胞具有保护作用,如缓解氧化应激[2],抑制脂质聚集,减轻自噬[3]等,在神经系统化方面,在促进神经细胞修复,抗炎等方面具有积极的作用。
Sirt-1是依赖于NAD+的组蛋白去乙酰化酶,在生物体中广泛存在并调节细胞的存活。Nagar等发现Sirt-1能够介导因氧化应激引起的细胞损伤的保护作用[4];在神经研究方面,Sirt-1能够介导缺血再灌注脑损伤的神经保护作用[5],因此,我们联想到,EGCG发挥对神经细胞凋亡的保护作用,Sirt-1是否参与其中。我们实验发现,EGCG对高糖诱导的神经细胞的损伤提供了一定的保护作用,Sirt-1介导其中。这些研究结果为糖尿病神经细胞损伤的药物研究提供了思路,现报道如下。
1 材料与方法
1.1 细胞培养方法 PC12细胞的培养使用DMEM(Hyclone)培养基加入10%胎牛血清(Gibico),于27℃,5%CO2恒温培养箱中孵育维持。取对数期细胞根据实验需要,种植于6、24及96孔的实验板(Corning)中进行培养、观察及提取蛋白。
1.2 Cell Counting Kit-8(CCK-8)检测PC12细胞的活性 取对数期细胞种植于96孔板,待细胞密度约75%时加入相应浓度的药物处理细胞,每一浓度至少3个实验样本,孵育24 h后,试验孔内加入10 μL的CCK-8试剂(Solarbio),孵育2 h,使用酶标检测仪450 nm观察OD数值,并统计分析。
1.3 ELISA法检测Bcl-2的表达活性 取对数期细胞加入对应浓度的药物处理细胞24 h,提取细胞蛋白并定量。按照ELISA试剂盒(Invitrogen)中的说明书配置试剂:以每孔100 μL将细胞蛋白加入酶标板内,覆膜于摇床上室温进行3 h孵育,除去酶标板内液体使用1×洗涤液清洗2次,每孔加入1×活性液200 μL,酶标检测仪450 nm观察OD数值,并统计分析。
1.4 免疫荧光检测细胞胞质Caspase-3及胞核DAPI的表达 对数期细胞种植于24孔板,待细胞密度约75%时加入对应浓度的药物,孵育24 h,PBS清洗1次,冰甲醇固定10 min。加入Caspase-3一抗(Abcam),室温孵育1 h;PBS清洗2次,加入荧光二抗(Solarbio)室温避光孵育1 h;PBST清洗1次,加入DAPI,室温孵育2 min。荧光显微镜10×40倍率观察并拍照。
1.5 Western-Blot法检测Sirt-1的表达 取对数期细胞加入对应浓度的药物处理24 h,提取细胞蛋白并定量。使用凝胶进行蛋白电泳,PVDF膜采用半干法转膜30 min;TBST加入5%脱脂奶粉常温封闭2 h,加入Sirt-1一抗(Abcam)封闭孵育12 h,TBST清洗3次,加入二抗(Cell Signaling)摇床孵育2 h,TBST清洗3次后使用成像仪显影。
1.6 统计分析 采用SPSS 18.0进行统计分析,数据采用平均数±标准差表示,组间差异采用单因素方差分析(One-way ANOVA)中的最小显著差异检验(LSD-test),P<0.05 为差异有统计学意义。
2 结果
2.1 高浓度葡萄糖诱导PC12细胞的凋亡 使用不同浓度的葡萄糖(15、 30、 45 mmol/L)处理PC12细胞24 h,结果发现,PC12细胞的活性随葡萄糖给予浓度的递增而下降(图1A,F=2.36,P<0.05),较对照组分别下降了14%、32%及57%;使用ELISA法检测了Bcl-2的表达,由图1B可见,具有抑制凋亡作用的Bcl-2蛋白的表达呈现了同样的趋势(图1B,F=11.05,P<0.05),较对照组分别下降了8%、30%及35%;为了更直观地观察细胞凋亡的发生,我们采用免疫荧光观察细胞质中凋亡蛋白家族的成员Cleaved-Caspase3的表达活性,由图1C中红色荧光染色的Cleaved-Caspase3可以观察到,葡萄糖处理后的PC12细胞的胞质中,红色荧光聚集密度较对照组有明显增加,与处理浓度呈现一定的相关性。此外,我们使用DAPI对细胞核进行了染色,葡萄糖损伤组的荧光强度增高,以上表明,高浓度葡萄糖对PC12细胞造成了明确的损伤。
2.2 EGCG保护高糖诱导的PC12细胞的凋亡 与葡萄糖30 mmol/L损伤组相比,加入EGCG(10、20、40 μmol/L)对细胞活力提升具有积极的作用,细胞活性较损伤组分别提升了2%、20%及24%,细胞活力的提升率与EGCG浓度呈现正相关(图2A,F=1.98,P<0.05),而单独使用EGCG对PC12细胞活力无明显影响;加入EGCG处理后,Bcl-2的表达分别提升了10%、22%和25%,20 μmol/L浓度以上的EGCG对Bcl-2的表达具有明确的统计学意义(图2B,F=23.67,P<0.01);由图2C可以观察到,胞质中红色荧光染色的Cleaved-Caspase3在加入EGCG保护组中的荧光强度和密度,相比较损伤组有一定程度的减弱。以上结果表明,EGCG对高糖诱导的细胞损伤具有保护作用。
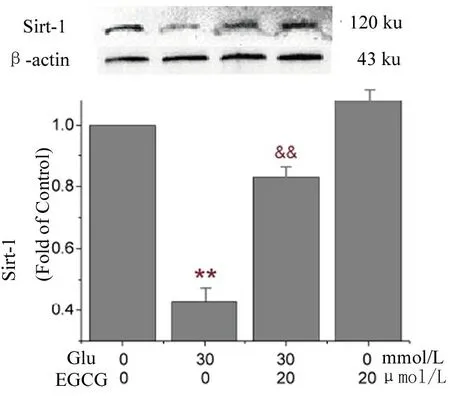
2.3 EGCG拮抗高糖对Sirt-1表达的抑制 与对照组相比,葡萄糖损伤组抑制了Sirt-1的表达,加入EGCG后则一定程度恢复了Sirt-1的表达,单独使用EGCG则对Sirt-1表达影响的差异无统计学意义(图3,F=14.71,P<0.01)。
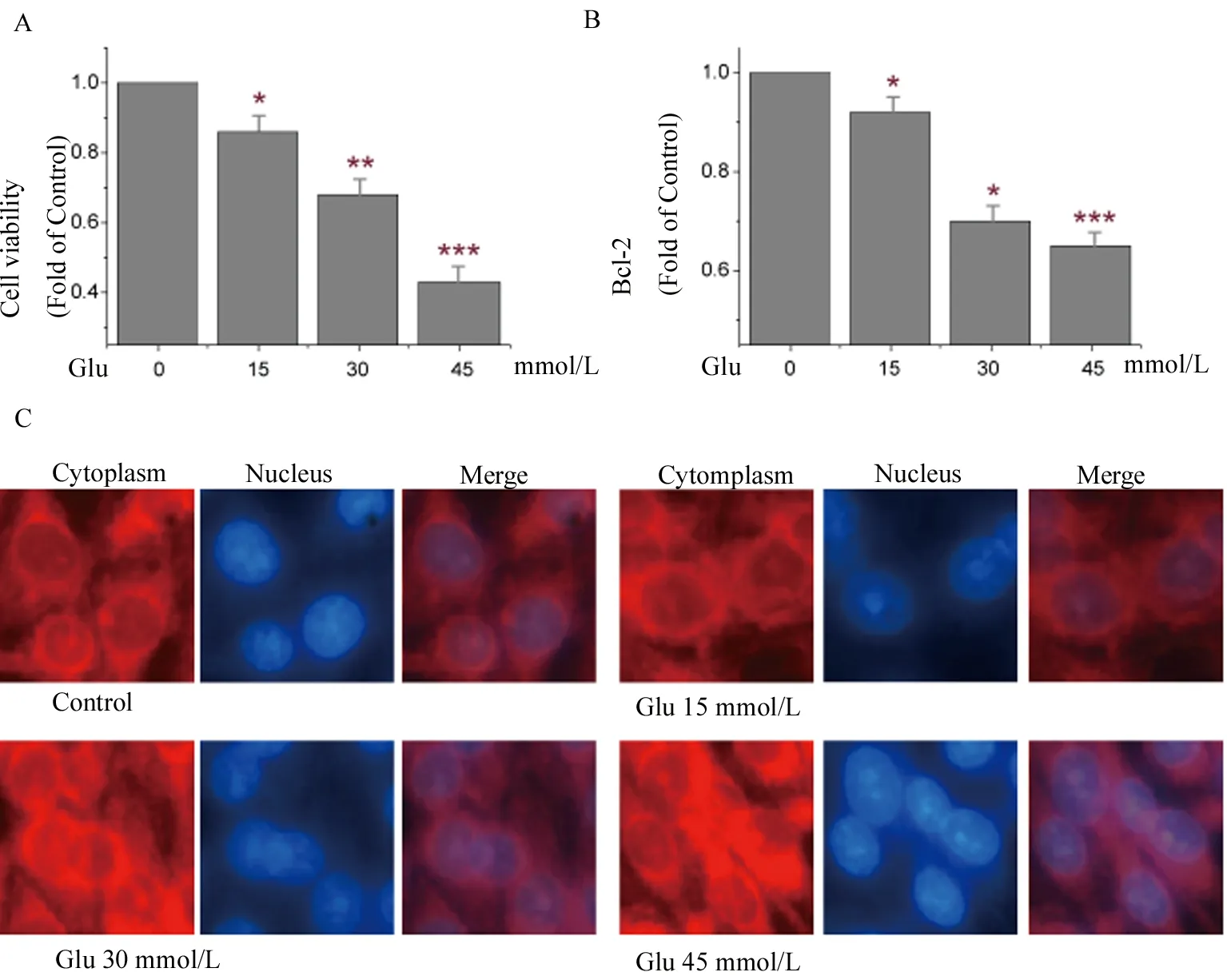
A.CCK-8检测PC12细胞活力;B.ELISA法检测Bcl-2的表达;C.免疫荧光观察胞核内Cleaved-Caspase3表达活性,观察胞核中DAPI的表达。
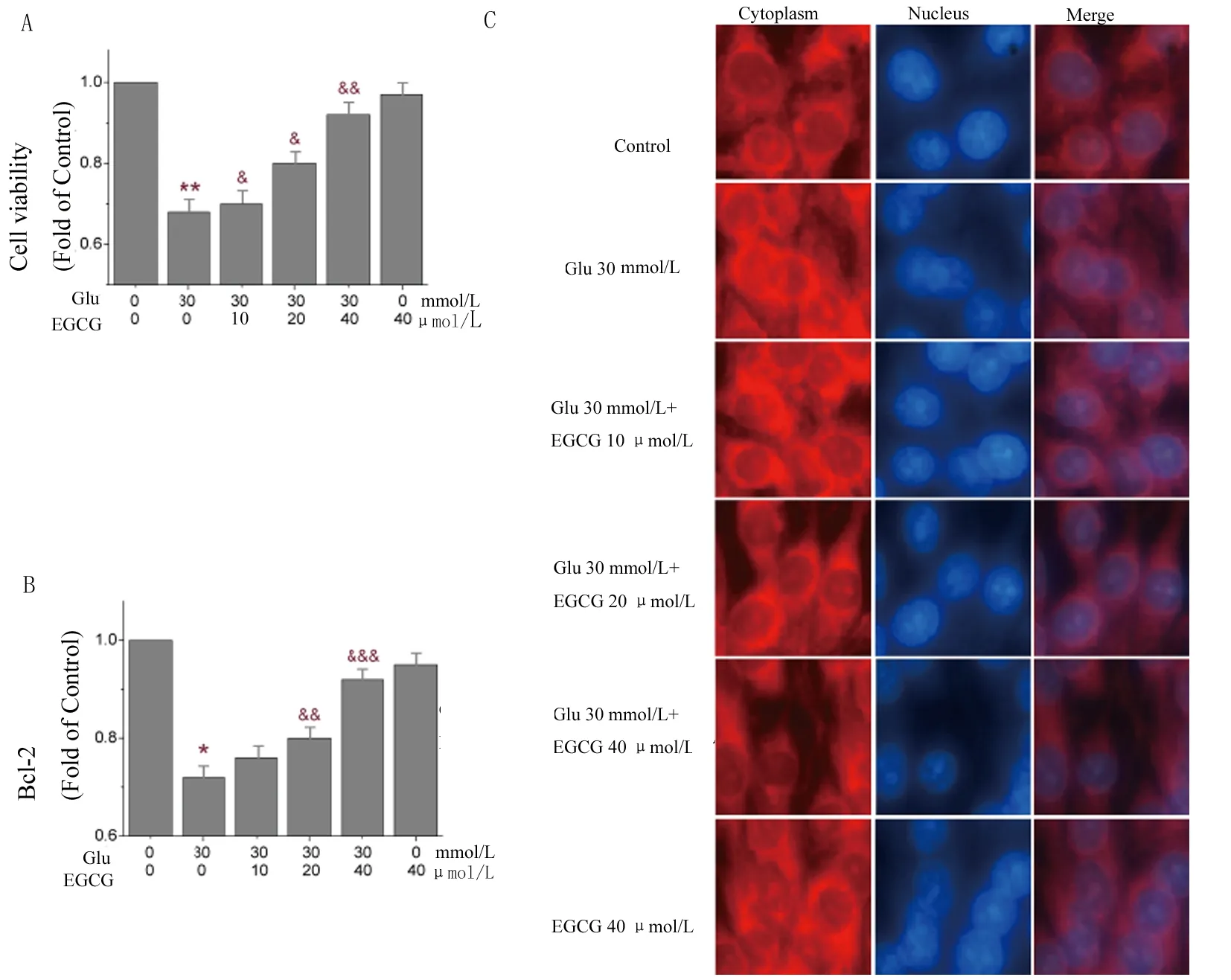
A.CCK-8检测PC12细胞活力;B.ELISA法检测Bcl-2的表达;C.免疫荧光观察胞核内Cleaved-Caspase3表达活性,观察胞核中DAPI的表达。**P<0.001,*P<0.01,vs. 对照组;&&&P<0.001,&&P<0.01,&P<0.05,vs. 葡萄糖损伤组(Glu 30 mmol/L)。
2.4 Sirt-1阻断剂Sirtinol逆转了EGCG对PC12细胞的保护作用 通过预实验发现浓度为15 μmol/L的Sirtinol在不明显损伤细胞的同时能对Sirt-1发挥较好的阻断作用。由图4可以得知,加入Sirtinol与EGCG同时处理组的细胞活性较EGCG保护组下降了8%(F=1.59,P<0.05),Bcl-2的表达下降了16%(F=37.96,P<0.01);Cleaved-Caspase3在胞质中的荧光强度也出现了对应的增高,提示Sirt-1介导了EGCG对PC12细胞的保护作用。
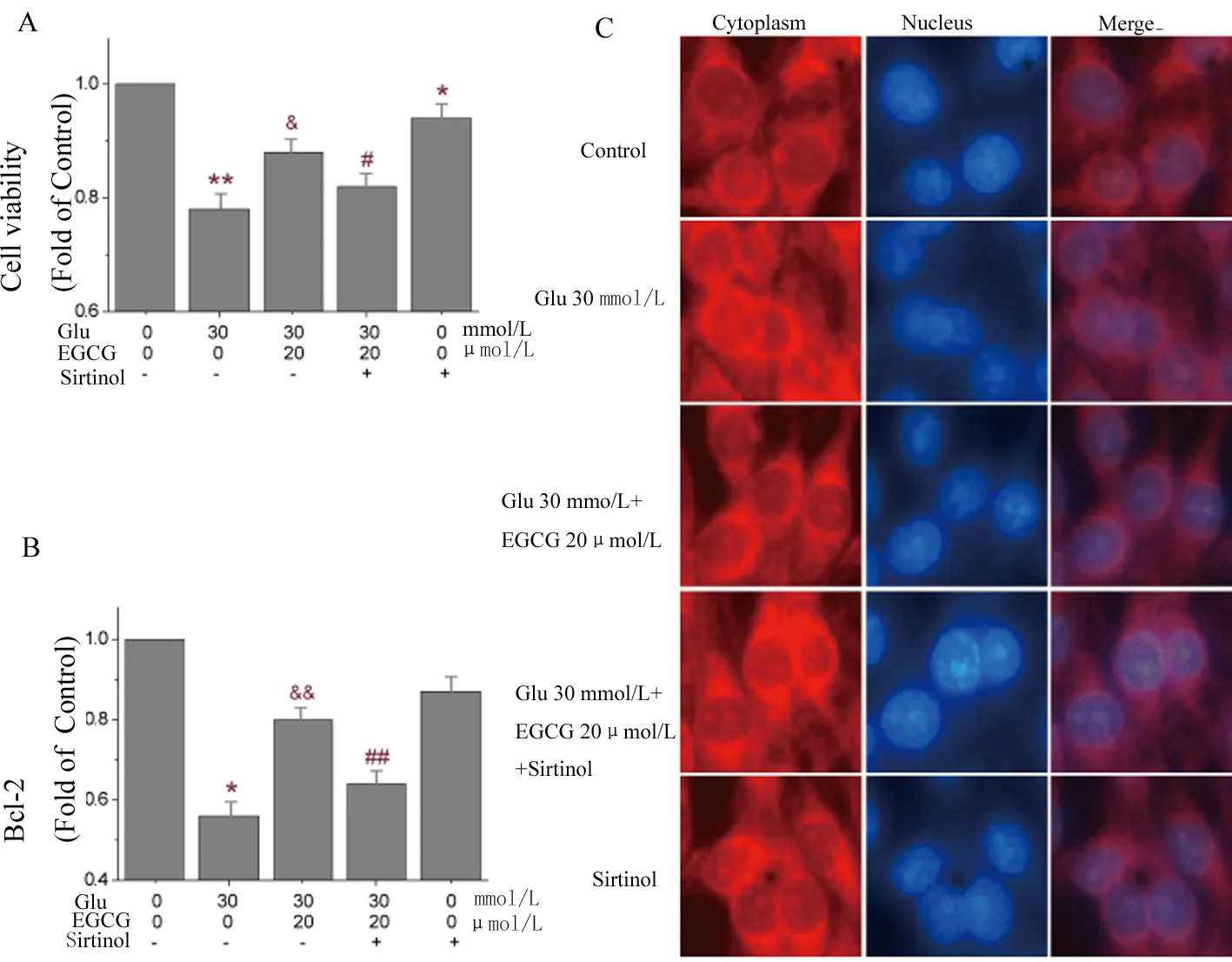
A.CCK-8检测PC12细胞活力;B.ELISA法检测Bcl-2的表达;C.免疫荧光观察胞核内Cleaved-Caspase3表达活性,观察胞核中DAPI的表达。
3 讨论
相关实验证实,持续的高糖微环境会导致神经细胞的凋亡,出现一系列神经细胞损伤引起的并发症,危害人们的健康及生存质量。因此寻求高糖环境下神经细胞的保护作用并改善损伤显得尤为重要。为此,我们通过实验发现:EGCG对高糖诱导的神经细胞损伤提供了较为积极的保护作用,Sirt-1介导了这种保护作用。
EGCG是绿茶多酚的活性成分,既往研究表明其具有强大的抗氧化作用[2],保护细胞的DNA免受损害,同时在心脑血管、神经保护方面发挥了积极的作用,机制涉及抗氧化应激,抑制内质网应激[1]等;此外,还有研究表明,EGCG具有抗病毒[6]、抗炎、抑制肿瘤[7]等功效,机制涉及抑制肿瘤相关酶的活性从而抑制增殖,诱导癌细胞凋亡等。
为明确高糖微环境对神经细胞的损伤及EGCG提供的保护作用,我们使用PC12细胞模拟神经细胞,PC12来源于小鼠嗜铬细胞瘤,具有类神经细胞的生物特性及分泌能力,是神经病理生理研究公认的理想实验对象[8]。我们采用不同浓度的葡萄糖(15、 30、 45 mmol/L)处理PC12细胞,通过检测细胞活力,凋亡保护蛋白Bcl-2的表达客观评估细胞的存活情况;Caspase3在胞质内被磷酸化,活化后的Caspase3通过对DNA修复酶的剪切启动细胞的凋亡程序,是公认为评估凋亡的可靠指标[9],我们采用免疫荧光法分别标记细胞质内活化的Caspase3以及胞核内DAPI的表达,以直观地感受细胞凋亡发生时,凋亡相关指标的表达强度。结果表明高糖微环境诱导了神经细胞的凋亡。接下来,我们通过加入EGCG,并与损伤组相比较来评估其提供的神经细胞保护作用,同样通过检测凋亡相关指标,我们发现EGCG对高糖诱导的神经细胞凋亡提供了较为可观的保护作用,与我们的预期相一致。
此外,我们进一步探讨了Sirt-1在细胞保护中的介导作用。Sirt-1被许多科学家称为“长寿基因”,正是由于其参与了细胞的分化、代谢,进而调节细胞寿命,并决定了细胞的存活[10]。有研究证实:Sirt-1在许多神经退行性变中扮演了保护者的角色[11]。在我们的实验中,我们发现EGCG不仅具有提升Sirt-1的表达、逆转高糖对Sirt-1的抑制作用,而且使用Sirt-1特异性阻滞剂Sirtinol后,EGCG的保护作用被逆转,这些都表明,Sirt-1介导了EGCG对PC12细胞的保护作用。此外,单独使用Sirtinol对细胞活力也产生了轻微的抑制作用,具有统计学意义,提示Sirt-1可能还通过其他通路介导和发挥了细胞的保护作用。然而,EGCG对高糖诱导的神经细胞的损伤的更深入的机制,以及其他应激及保护方面的研究仍需进一步探索。
通过实验,我们证实EGCG能够通过Sirt-1的介导从而提供对高糖诱导的PC12细胞的保护作用,这为高糖诱导的神经系统病变提供了新的思路。基于我们的研究,运用EGCG为神经病变提供保护或许是新的策略与方法,也为神经系统病变的治疗提供了新的视角。

