高糖环境对肾小球足细胞及TNFR1的影响
吴 雪,章 尧,孟祥健,张斌华,王李卓,高家林
(1.皖南医学院第一附属医院 弋矶山医院 内分泌科,安徽 芜湖 241001;2.皖南医学院 生物化学与分子生物学教研室,安徽 芜湖 241002)
糖尿病肾病(diabetic nephropathy,DN)作为糖尿病(diabetes mellitus,DM)的微血管并发症,常导致终末期肾衰。持续的蛋白尿、高血压、肾小球滤过率下降是DN的主要临床表现。不仅如此,DN还与DM病人心血管事件的发生率、病死率密切相关[1]。足细胞是终末分化的肾小球内皮细胞,参与肾小球滤过屏障的组成。持续的高糖状态可以损伤足细胞功能,DN蛋白尿的产生也与其有关[2]。
DN具有发病时难察觉,发生时难治愈的特点,其发病机理尚不明确,目前缺乏有效治疗。晚期糖基化终末产物的沉积,肾素-血管紧张素-醛固酮系统及蛋白激酶C的激活,多元醇通路的活化,机体氧化应激水平增加及遗传因素一直被认为是DN的主要发病机制。越来越多的研究证实炎症机制在DN的进展中发挥重要作用,并且成为学术界研究的新热点[3]。本文旨在通过高糖诱导足细胞炎症,寻找DN治疗的新靶点,完善DN的发病机制,为DN的防治提供新的方向。
1 材料与方法
1.1 材料 小鼠肾小球足细胞(MPC5细胞)购自北京北纳创联生物技术研究院,于90%DMEM低糖培养基,10%优质胎牛血清培养。DMEM低糖培养基(GE Healthcare Life Science),葡萄糖(西陇化工),甘露醇(合肥睿捷),胎牛血清(上海双洳),胰酶细胞消化液(碧云天),pIRS-1Ser307抗体(碧云天),pAKTSer473(Abcam),CollagenⅠ(Proteintech),Fibronectin(Proteintech),IL1β(Proteintech),TNFR1(Proteintech),β-actin(Sigma),辣根过氧化物酶标记山羊抗兔IgG(H+L)(碧云天),辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(碧云天),DAPI染色液(碧云天),化学发光底物(Thermo Fisher Scientific),彩色预染蛋白质分子量标准(Sigma),RIPA裂解液(碧云天),PMSF(碧云天),SDS-PAGE蛋白上样缓冲液(碧云天),PVDF蛋白转印膜(碧云天),超纯水(Millipore)。
1.2 细胞处理 细胞设为正常对照组(D-葡萄糖5.5 mmol/L)、高渗组(D-葡萄糖 5.5 mmol/L+甘露醇39.5 mmol/L)、高糖组(D-葡萄糖 45 mmol/L),葡萄糖及甘露醇干预细胞48 h后提取细胞蛋白。同样的方法再处理细胞两次,共提取3批蛋白样本。
1.3 western blotting 检测 细胞干预48 h后,弃培液,PBS漂洗3次,加入蛋白裂解液(1 mL RIPA裂解液+10 μL PMSF)冰上裂解10 min,细胞刮刀刮下。裂解的细胞转移至1.5 mL EP管,在超声波细胞破碎仪上进行充分匀浆,匀浆完成后,继续冰上裂解30 min。测定蛋白浓度,用SDS-PAGE蛋白上样缓冲液进行蛋白变性。配胶完成后开始上样、电泳,上样顺序为正常对照组,高渗组,高糖组。电泳浓缩胶时,电压设为80 V,电泳分离胶时,电压设为120 V。电泳完成后进行转膜,转膜条件110V/90 min,冰浴。转膜完成后室温封闭90 min,4℃过夜孵育一抗。次日,洗一抗,每次10 min,洗3次。后室温孵育二抗2 h,洗二抗,每次10 min,洗3次。曝光,Image J分析灰度值。按上述方法在提取的3批蛋白样本上进行3次独立实验。
1.4 DAPI染色 细胞干预72 h,弃培液,加入PBS漂洗1次。细胞固定,加入DAPI染色液,避光染色10 min。弃去DAPI染色液,PBS漂洗3次,每次5 min,即可在荧光倒置显微镜下观察。

2 结果
2.1 足细胞胰岛素信号通路的变化 western blotting结果显示,细胞刺激48 h以后,pIRS-1Ser307在高渗组和高糖组表达均高于正常组,差异有统计学意义(P<0.05),而高渗组和高糖组表达差异无统计学意义(P>0.05);pAKTSer473在高渗组表达升高(P<0.05),但在高糖组表达下降(P<0.05),差异均有统计学意义(P<0.05)(图1,表1)。

表1 足细胞胰岛素信号通路蛋白表达水平
注:与正常对照组比较,*P<0.05;与高渗组比较,#P<0.05。
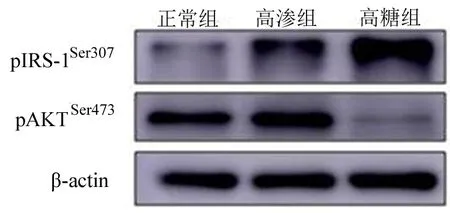
图1 足细胞胰岛素信号通路的变化
2.2 足细胞纤维化及炎症水平的变化 western blotting结果显示,细胞刺激48 h以后,CollagenⅠ、Fibronectin及IL1β在高渗组和高糖组表达均高于正常组,差异均有统计学意义(P<0.05);CollagenⅠ在高糖组表达高于高渗组,差异有统计学意义(P<0.05);其他两组间差异无统计学意义(P>0.05)(图2,表2)。

表2 足细胞纤维化及炎症蛋白表达水平
注:与正常对照组比较,*P<0.05;与高渗组比较,#P<0.05。
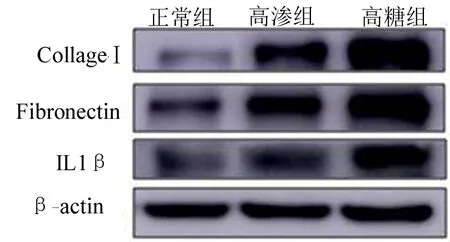
图2 足细胞纤维化及炎症水平的变化
2.3 足细胞TNFR1表达的变化 western blotting结果显示,细胞刺激48 h以后,炎症因子TNFR1在高渗组和高糖组表达均高于正常组,差异有统计学意义(P<0.05),而高渗组和高糖组表达差异无统计学意义(P>0.05)(图3,表2)。

图3 足细胞TNFR1表达的变化
2.4 高糖对足细胞形态的影响 高糖刺激72 h后,高糖组与正常对照组比较,细胞胞体明显变大,细胞间边缘不清,足细胞失去正常形态(图4)。

2.5 高糖对足细胞核的影响 高糖刺激72 h后,进行DAPI染色。结果显示高糖组与正常对照组比较,部分细胞核缩小、变亮,细胞出现核固缩(图5)。
3 讨论
足细胞是肾小球滤过屏障的主要成分,在DN的进展中具有重要地位,可通过参与肌动蛋白细胞骨架重排阻止尿蛋白的产生[4]。DN伴随的高糖环境可以损伤足细胞的功能,本实验中高糖不仅影响了足细胞的形态,还促其出现了核固缩。提示足细胞发生凋亡,正常生存受到影响,这种现象与Wang等人的实验结果相符合[5]。近来有研究证实,足细胞和骨骼肌细胞、肝细胞一样,也是胰岛素作用的靶细胞,并且在产生蛋白尿前就已发生胰岛素抵抗[6]。在DN中,IRS1/PI3K/AKT信号通路是足细胞发生胰岛素抵抗的主要机制[7]。Ser307是IRS1上一个重要的酪氨酸磷酸化位点,pIRS-1Ser307对胰岛素信号通路具有负性调控作用。本实验中,甘露醇和高糖刺激下足细胞pIRS-1Ser307表达增高,提示IRS1酪氨酸位点磷酸化增强,IRS1与胰岛素受体正常结合受到影响[8]。AKT是IRS1/PI3K/AKT信号通路下游主要部分,而pAKTSer473是AKT的完全活化形式[9]。本实验中,高糖刺激下pAKTSer473表达下降,提示AKT的正常功能受到影响。高糖刺激下的足细胞,胰岛信号通路发生异常,胰岛素抵抗明显增加。

红色箭头表示核固缩。
虽然DN的发病机制不明,发展也受诸多因素影响,譬如病程、患者年龄、种族、肾脏疾病易感性,但当DN进展至终末期肾衰时常伴有明显的肾脏纤维化[10]。肾脏许多病理改变与肾脏纤维化有关,比如肾小球硬化,肾小管间质纤维化,足细胞损伤等[11]。细胞外基质在肾脏修复时的过度沉积是肾脏纤维化的一个主要原因,而CollagenⅠ及Fibronectin是其主要成分[12]。本实验中CollagenⅠ及Fibronectin在甘露醇和高糖刺激下表达增高,提示足细胞纤维化水平上升。炎症在DN中展现出重要地位,有学者认为DN病人实质是长期处于一种区别于红肿热痛为主要表现的“微炎症”状态。DN伴随的高糖环境可诱发机体内炎症的级联反应,通过巨噬细胞浸润,炎症信号通路激活,炎症因子高表达等方式促进DN的发展[13]。此外,有研究证实胰岛素抵抗与DM病人免疫系统的激活及慢性低度炎症状态密切相关[14]。本实验中,甘露醇和高糖刺激下炎症因子IL1β在足细胞的表达升高。Khurrum Shahzad等也已证实,DN小鼠肾脏中IL1β的表达增加。
本实验发现,在高糖刺激足细胞发生胰岛素抵抗,纤维化及炎症水平明显增高的情况下,炎症因子TNFR1在高渗组、高糖组表达均升高。TNFR1也被称作为p55、 p60、 CD120a 或 TNFRSF1A,主要通过NFκB和MAPK炎症通路发挥促炎作用[15]。TNFR1作为一种跨膜糖蛋白,是人体TNF受体超家族主要成员之一,其分子量为60 ku,位于染色体12p13[16]。正常情况下,肾脏中TNFR1在肾小球表达相对较高,且在足细胞中TNFR1的表达受炎症因子TNF α的调控[17-18]。本实验发现TNFR1在高渗组和高糖组表达均升高,且差异均具有统计学意义,因此认为DN伴随的高渗、高糖均可影响足细胞TNFR1的表达。已有临床实验证实,DN病人血循环中TNFR1的水平较高,且血清中TNFR1的表达水平与炎症因子CRP及IL6的水平相关[19-20]。虽然TNFR1在肾脏的机制研究较少,但已证实TNF在肾脏中强大的炎症效应主要是通过其受体TNFR1实现的。在肾小球肾炎中,敲除TNFR1基因可以减轻肾小球炎症水平,缓解疾病的发展[17]。因此,结合本实验结果,推测TNFR1影响了DN的进展,炎症机制是其主要参与途径。
炎症与DN密切相关,本实验发现在甘露醇和高糖刺激下炎症因子TNFR1在足细胞中表达升高。虽然有相关临床实验,但是TNFR1在DN的机制研究仍然空白。深入研究TNFR1可能为DN发病机制的补充及防治带来新的方向。

