4-HR 与抗坏血酸对中华管鞭虾多酚氧化酶的抑制动力学模拟分析
周宇芳,胡建坤,郝云彬,相兴伟,杨会成,郑 斌,*,肖金星
(1.浙江省海洋开发研究院,浙江 舟山 316100;2.江南大学食品学院,江苏 无锡 214122;3.浙江大学舟山海洋研究中心,浙江 舟山 316100)
我国是虾类养殖与捕捞大国,总产量位列全球首位,其中海水虾占比56%以上,是我国大宗出口水产品之一[1-2]。海水虾味美肉嫩,营养丰富,深受消费者青睐,在我国水产食品中占有支柱地位。由于体内水分、蛋白质等含量高,虾类在捕捞、运输、加工及贮藏过程中容易腐败变质,尤其是极易发生黑变[3]。海水虾黑变的发生是由于表面酪氨酸或其衍生物等色原物质在多酚氧化酶(polyphenoloxidase,PPO)的作用下经过一系列生化反应最终产生黑色素[4],严重影响产品感官品质,制约其商品价值。因此,保持虾的色泽和鲜度成为海水虾产业的关键技术,保鲜防黑变技术的研发对于保证原料品质、避免经济损失意义重大。
目前,我国普遍采用二氧化硫产生物(亚硫酸盐),其能将黑色素形成过程的中间产物醌还原成无色化合物(双酚),从而有效防止虾类黑变[5]。但是,亚硫酸盐添加到食品中存在严重的安全性问题,联合国粮农组织和世界卫生组织以及美国、日本、欧盟等国家都严格规定虾肉中SO2残留不得超过0.1 mg/g[6]。近年来,国内外学者在虾类防黑变生物保鲜剂的开发方面进行了部分研究,但是主要集中在中华管鞭虾(Solenocera crassicornis)等不同品种虾类PPO的制备与生化特征分析[7-9]、不同抑制因子效果评价[10-12]及复合抑制剂产品开发[13-14]等方面,缺乏对抑制功效成分作用机理的系统研究。分子动力学模拟是一种在原子水平上理解分子运动细节的方法[15],可以直观给出反应体系在一定温度条件下的结构变化等,是研究酶催化机理的有效方法[16]。因此,可应用分子动力学模拟预测推断抑制因子对PPO的抑制机理。
本实验针对团队前期开发的海水虾无硫复合抑制剂主要功效成分4-己基间苯二酚(4-hexylresorcinol,4-HR)与抗坏血酸,开展2 种抑制因子的抑制效果及抑制类型研究,同时从抑制因子化学结构及动力学模型出发分析推断其抑制机理,为绿色、高效的海水虾防黑变产品的应用推广提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜中华管鞭虾购自舟山国际水产城码头,加冰运回实验室后,-80 ℃超低温暂存。
L-抗坏血酸(食品级),4-HR、3-(3,4-二羟基苯基)-L-丙氨酸(3,4-dihydroxyphenyl-L-alanine,L-DOPA)(均为分析纯) 美国Sigma-Aldrich公司;丙酮、磷酸二氢钾、磷酸氢二钾、无水硫酸铵(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
IKA T10组织匀浆机 艾卡(广州)仪器设备有限公司;UV2300紫外-可见分光光度仪 上海天美科学仪器有限公司;CT14RD冷冻离心机 上海天美生化仪器设备工程有限公司;HH-4数显恒温水浴锅 国华电气有限公司;DHG-9076A恒温干燥箱 上海精宏实验设备有限公司;BSA224S分析天平 赛多利斯科学仪器有限公司;FE28-Stan pH计 梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 海水虾PPO的制备
采用Xiang Xingwei等[7]的方法,进行PPO的制备。
1.3.2 PPO活力的测定
参照Nirmal等[17]的方法并略有改进。以L-DOPA为特异性底物,将1 mL 0.05 mol/L磷酸盐缓冲液(pH 6.0)与1.2 mL 15 mmol/L L-DOPA混合均匀,45 ℃预热3 min,然后加入45 ℃预热3 min的待测酶液200 μL,混匀后立即在波长475 nm处测定吸光度变化,测定6 min,每1 min吸光度增加0.001定义为1 个酶活力单位。
1.3.3 抑制因子对PPO酶促反应的影响
反应体系中依次加入45 ℃预热过的1.2 mL 15 mmol/L L-DOPA、1 mL 0.05 mol/L磷酸盐缓冲液(pH 6.0)、100 μL不同浓度的抑制因子和200 μL酶液,2 种抑制因子在反应体系中的终浓度如下:4-HR分别为0.01、0.03、0.05、0.10 mmol/L,抗坏血酸分别为0.5、1.0、2.0、2.5 mmol/L,酶活力测定方法同1.3.2节,空白对照组以100 μL超纯水代替抑制因子。酶被抑制因子处理前后酶活力变化以剩余酶活力表示。酶促反应体系达到稳定态后,吸光度随时间延长的线性段直线外推得到的横截距为迟滞时间。
1.3.4 抑制因子对PPO的抑制类型和抑制常数
以L-DOPA为底物,在不同底物浓度条件下,测定不同浓度的4-HR与抗坏血酸的PPO活力抑制效果。通过Lineweaver-Burk双倒数作图,以底物浓度的倒数为X轴,反应速率的倒数为Y轴,判断不同抑制剂的抑制类型。抑制常数的测定是通过直线的斜率和纵轴截距对抑制剂浓度二次作图,得到抑制剂对游离酶的抑制常数(KI)。
1.3.5 2 种抑制因子作用过程的化学动力学模拟分析
采用ChemBioOffice Ultra软件,利用分子动力学模型MM2力场,基于量子化学的分子动力学计算方法对酶抑制反应路径进行多次模拟优化,利用密度泛函理论计算各反应路径中稳态和过渡态的结构和能量,并对分子模拟结果进行验证[18-21]。通过以上分子动力学模拟分析,预测各抑制动力学流程及产物结构变化特征,探讨2 种抑制因子的抑制机理。
1.4 数据统计与分析
采用SPSS 19.0软件进行数据分析,采用Excel 2007软件绘图。采用ChemBioOffice Ultra软件进行分子动力学模拟计算,并绘制反应流程图及结构变化示意图。
2 结果与分析
2.1 2 种抑制因子对中华管鞭虾PPO酶促反应的影响
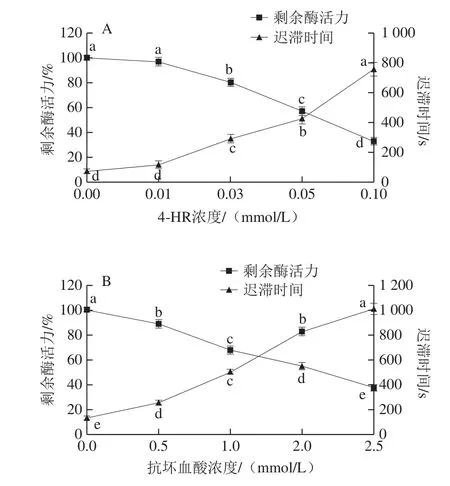
图1 4-HR(A)和抗坏血酸(B)对中华管鞭虾PPO活力和迟滞时间的影响Fig. 1 Effects of 4-HR (A) and ascorbic acid (B) on the relative activity and the lag time of PPO
由图1A可知,4-HR对PPO活力有明显的抑制作用。随着4-HR浓度的增加,PPO的剩余酶活力逐渐降低,半抑制浓度为0.072 mmol/L。同时,4-HR使PPO酶促反应的发生产生一定的延滞,迟滞时间随4-HR浓度的增加而显著延长(P<0.05)。4-HR对PPO的延滞可能是4-HR与底物竞争性地与酶结合,产生无色物质,阻止黑变的发生。由图1B可以看出,抗坏血酸对PPO的抑制作用明显,其抑制作用及迟滞时间随抗坏血酸浓度的增加而增大(P<0.05),半抑制浓度为2.02 mmol/L,远高于4-HR,说明4-HR对中华管鞭虾PPO的抑制作用能力更强,与Leekim等[22]研究结果一致。
2.2 2 种抑制因子对海水虾PPO的抑制类型
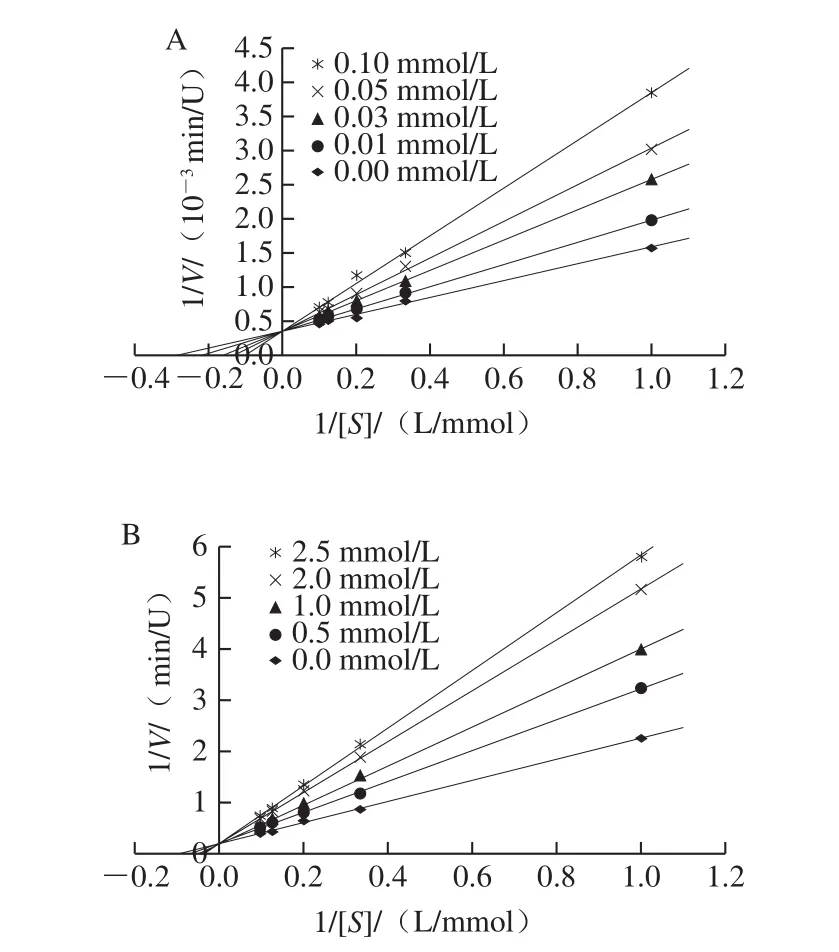
图2 不同浓度4-HR(A)和抗坏血酸(B)处理的中华管鞭虾PPO的Lineweaver-Burk图Fig. 2 Lineweaver-Burk plots for PPO in the presence of different concentrations of 4-HR (A) and ascorbic acid (B)
图2 为1 组纵轴截距不变的直线,说明4-HR与抗坏血酸不改变酶促反应的最大反应速率(Vmax),只影响米氏常数(Km),Km随着抑制剂浓度的增加而增大,表明4-HR、抗坏血酸对中华管鞭虾PPO的抑制作用均为竞争性抑制,说明2 种抑制因子同底物竞争性地与酶结合。
大多数PPO的竞争性抑制剂与底物在结构上有一定的相似性[23]。4-HR是间苯二酚的衍生物,结构与PPO底物邻苯二酚相近。在底物存在的情况下,4-HR苯环上羟基与氧化态酶的活性中心部位竞争性结合[24],从而减少酶与底物的接触浓度,降低其催化效率,抑制黑变的发生。这与Alvarez-Parrilla[25]和Galvão[26]等研究4-HR黑变抑制作用结果一致。以不同抑制剂条件下测定的Km对抑制剂浓度作图,从直线斜率可求得4-HR对PPO的抑制常数KI为0.022 mmol/L。
关于抗坏血酸的抑制作用目前有2 种推测,一般认为它们是通过将PPO氧化中间产物邻苯醌还原为邻苯二酸和脱氢抗坏血酸以阻止黑色素生成[27-29];Ali[30]和Arias[31]等研究认为,抗坏血酸除了能直接还原醌类化合物,其也可以通过与PPO活力中心结合,直接对PPO产生抑制作用,图2B实验结果也佐证了这一观点。不同抑制剂条件下测定的Km对抑制剂浓度作图,从直线斜率可求得抗坏血酸对中华管鞭虾PPO的抑制常数KI为1.388 mmol/L。
2.3 2 种抑制因子作用过程的化学动力学模拟分析
2.3.1 4-HR抑制反应的模拟分析
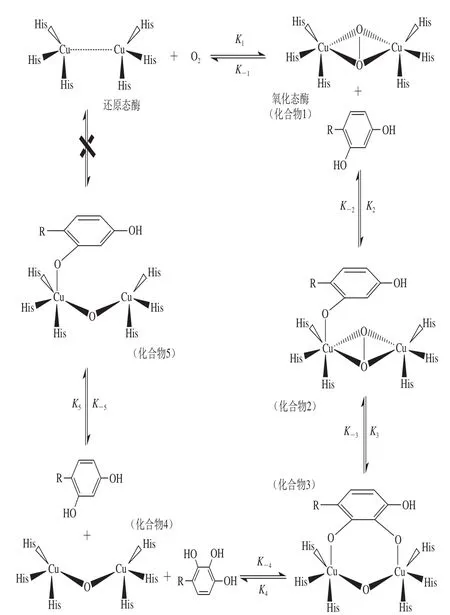
图3 4-HR抑制PPO动力学模型流程图Fig. 3 Schematic illustration of PPO inhibition by 4-HR
PPO是多亚基的含铜金属酶,每个亚基含2 个金属铜离子,2 个金属铜离子分别与蛋白质分子中2 个平展的组氨酸和1 个弱的直立组氨酸配体结合,另有1 个内源桥基将2 个铜离子联系在一起,构成PPO催化氧化反应活性中心[32](图3中还原态酶)。4-HR是间苯二酚的衍生物,采用MM2力场模拟关键结合部位分子-原子之间的动力学关系,预测4-HR与PPO的抑制反应流程如图3所示。经计算,中间产物1、2、3、4和5的结合能分别为445、463、122、127 kcal/mol和1 003 kcal/mol,化合物3和化合物4的能量急剧降低,化学反应更易发生,诱导反应向抑制方向发展,而化合物5能量极高,不能分解再次得到初始产物脱氧态酶。
根据4-HR抑制过程的分子结构化学动力学模拟结果,推测4-HR的抑制机理为:酚还原态酶(铜离子态)在氧气的作用下,以过氧键结合并联结2 个铜离子形成配位键占据铜离子的2 个赤道面位置,并作为铜离子之间的桥联配体,形成酚氧化态酶(化合物1),构型由平面四边形转变为三角双锥型,如图4所示。4-HR苯环间位羟基上的氧原子作为亲核试剂进攻酚氧化态酶上的铜离子,络合成四角双锥型构型的配位体(化合物2)。因四角双锥结构的存在,氧氧键受σ*受体作用而带有较少的负电荷,而π电子受体与氧氧键的σ*轨道上的电子作用,削弱了氧氧键,氧原子发生迁移,导致四角双锥结构转变成更稳定的三角双锥型结构(化合物3)。在酸性条件下,化合物3脱去邻苯三酚形成具有平面四边形结构化合物4。因化合物5结合能很高(1 003 kcal/mol),形成后体系很稳定,故化合物4与4-HR结合进入一条几乎死循环途径,不参与正常产物的生成,破坏了PPO的循环催化路径,阻止了PPO与底物的结合,降低其催化效率,抑制黑变发生。

图4 4-HR催化体系结构变化示意图Fig. 4 Schematic diagram of the structural changes of 4-HR-inhibited catalytic system
2.3.2 抗坏血酸抑制反应的模拟分析
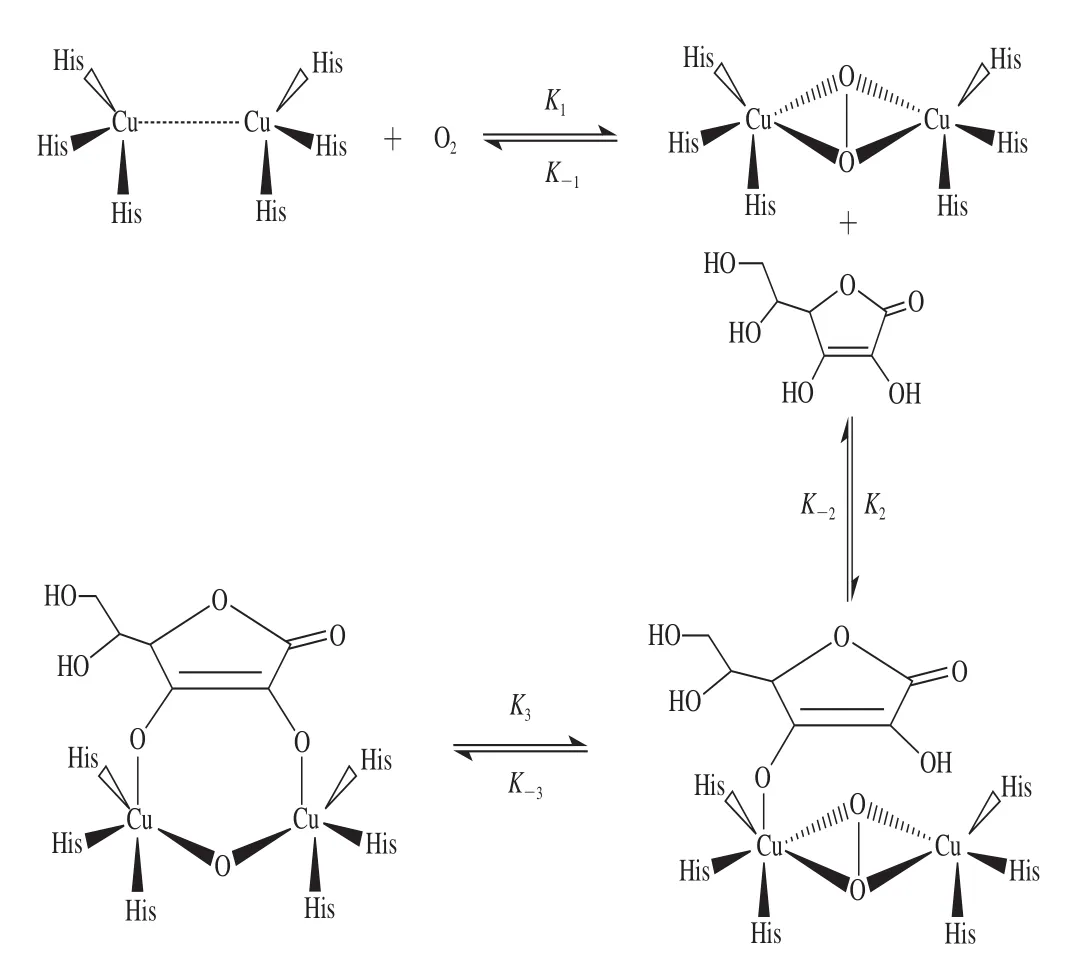
图5 抗坏血酸抑制PPO动力学模型流程图Fig. 5 Schematic illustration of PPO inhibition by ascorbic acid
抗坏血酸分子结构中存在4 个羟基,分别是芳环上2 个羟基,内侧支链上1 个羟基,外侧支链上2 个羟基。假设4 个羟基分别与PPO活力中心络合,根据分子力场轨道理论,采用薛定谔方程对稳态的最小能量进行计算,预测其抑制机理如图5所示。芳环上2 个羟基与活性中心结合的最小静态稳定能量分别为461 kcal/mol和463 kcal/mol,内侧支链上羟基与活性中心络合的能量为1 116 kcal/mol,外侧支链上羟基与活性中心络合的最小静态稳定能量为473 kcal/mol,这表明,内侧上羟基空间位与活性中心的静态稳定能量很高,生成的化合物不稳定。芳环上氧的σ*孤对电子,受芳环上π电子共轭作用,活性较高,与PPO的静态稳定能更低,生成的化合物更稳定。而这一能量数值与底物邻苯二酚(463 kcal/mol)几乎一致,表明抗坏血酸的抑制作用与邻苯二酚的促进作用可构成直接竞争关系。而在后续反应中,抗坏血酸的结合能更高,生成更稳定的PPO络合物,降低了PPO与底物的接触浓度,阻止了原双酚催化循环的发生,从而发挥出防黑变作用。
3 结 论
4-HR、抗坏血酸均能抑制中华管鞭虾PPO活力。随着2 种抑制因子浓度的增加,PPO活力不断下降,其中,4-HR对PPO活力的抑制效果强于抗坏血酸。被不同浓度4-HR、抗坏血酸处理的PPO参加的反应体系,随着底物浓度的增加,PPO的Km值逐渐增加,而反应体系Vmax趋于相等,符合竞争性抑制剂作用于酶的特点。4-HR、抗坏血酸与PPO双铜活性中心的初始结合能量大小接近,均可与PPO活力中心结合发挥抑制效果。在反应过程中,4-HR与PPO会生成一种高稳定络合物,持续有效地消耗PPO,降低酶与底物的接触浓度,较大程度上抑制黑变。此外,推测抗坏血酸存在2 种作用机制,一方面能通过与PPO活力中心络合,直接对PPO产生抑制作用,另一方面能通过还原中间产物醛类抑制黑色素的生成。

