沉默氧增强蛋白(OEE2)对辣椒疫霉效应因子RxLR19781的免疫功能影响
梁涛,王俪颖,朱彤彤,马艳飞,江韦霖,冀瑞卿*
沉默氧增强蛋白(OEE2)对辣椒疫霉效应因子RxLR19781的免疫功能影响
梁涛1,王俪颖1,朱彤彤2,马艳飞2,江韦霖2,冀瑞卿1*
1. 吉林农业大学食药用菌教育部工程研究中心, 吉林 长春 130118 2. 山东农业大学植物保护学院 山东省蔬菜病虫生物学省级重点实验室, 山东 泰安 271018
辣椒疫霉菌()是一种寄生范围广且能够产生大量RxLR效应因子来参与侵染寄主的病原卵菌。资料表明目前对多数辣椒疫霉RxLR效应因子在植物体内如何行使功能积累较少。本研究从辣椒疫霉菌中分离鉴定1个效应分子RxLR19781,为了初步明确RxLR19781的功能特性,本研究借助于烟草脆裂病毒(,TRV)介导的基因沉默技术,将RxLR19781的互作蛋白基因NbOEE2在本氏烟中瞬时沉默,通过qRT-PCR验证得到NbOEE2沉默植株,在沉默后的本氏烟植株中接种RxLR19781并验证该RxLR效应因子的功能。结果表明,在NbOEE2沉默植株上,RxLR19781不抑制辣椒疫霉游动孢子侵染。本研究结果表明OEE2可有效调控RxLR19781的功能特性,为进一步深入开展辣椒疫霉效应因子RxLR19781功能机制研究奠定了基础。
辣椒疫霉; 效应因子; TRV; 基因沉默
辣椒疫霉菌()是一种在世界范围内广泛引起辣椒疫病的土壤兼性寄生菌,其分布广泛,主要寄主是包括辣椒、茄子、西红柿、黄瓜等在内的多种茄科和葫芦科植物[1]。辣椒疫霉菌引起的作物疫病是作物生产上的毁灭性病害,造成巨大的经济损失,同时还能侵染模式植物拟南芥和本氏烟,是卵菌研究的重要模式材料[2]。在辣椒疫霉菌侵染寄主的过程中,病原菌能够分泌大量的RxLR效应分子来调控寄主的防卫反应以躲避寄主的免疫识别[3,4]。当寄主植物不含有相应的抗病蛋白时,效应分子通过干扰或者破坏植物的防卫反应从而促进病原菌的侵染;当寄主植物含有效应分子对应的抗病蛋白,寄主植物识别相应的效应分子引发效应分子触发的免疫反应(Effector-triggered immunity,ETI),从而抑制病原菌侵染[5]。
病毒诱导的基因沉默(Virus-induced gene silencing,VIGS)是一种转录后的基因沉默技术,可以利用携带靶标基因序列的cDNA片段病毒载体去侵染植株,从而引起植物内源基因的沉默,通过对植株表型变化的分析,为进一步研究该内源基因的功能提供依据[6]。基于一种双链RNA病毒——烟草脆裂病毒(Tobacco rattle virus,TRV)所构建的VIGS载体体系,是目前应用最为广泛的VIGS载体系统。TRV介导的基因沉默(TRV-VIGS)是把TRV病毒的基因组构建到植物表达载体,同时借助农杆菌可以侵染植株的特性,通过农杆菌注射植株将农杆菌侵入到植物中,完成基因转化[7]。TRV-VIGS以其沉默效率高、持续时间长,寄主植物病毒症状轻,不会掩盖沉默表型,且在各种组织均可产生基因沉默的优点,成为目前应用最为广泛的一类基因沉默体系,已在番茄[8]、烟草[9]、辣椒[10]、拟南芥[11]等植物上成功应用。
之前研究表明,效应因子RxLR19781可以抑制辣椒疫霉游动孢子侵染,且通过酵母双杂、双分子荧光、免疫共沉淀(Co-Immunoprecipitation)技术验证了该效应因子与氧增强蛋白(OEE2)互作。本研究借助于TRV介导的基因沉默技术,将氧增强蛋白在本氏烟中瞬时沉默,对OEE2是否参与辣椒疫霉效应因子RxLR19781抑制游动孢子侵染的功能进行更深一步的研究。
1 材料与方法
1.1 供试植物材料与菌株来源
供试植物为本氏烟,于本实验室保存。温度22 ℃,湿度70%,16 h光照,8 h黑暗培养。
辣椒疫霉效应因子RxLR19781来源于本实验室分离保存辣椒疫霉菌株SD33。农杆菌GV3101为本实验室保存。供试菌株均保存于山东农业大学植物保护学院真菌资源与利用研究室。
1.2 载体与质粒
本研究中所用到的载体包括:植物瞬时表达载体pBIN-GFP由南京农业大学窦道龙老师馈赠。烟草瞬时沉默载体p-TRV1、p-TRV2由清华大学刘玉乐老师馈赠。大肠杆菌感受态细胞Trans5α采购自北京全式金生物技术有限公司。
1.3 本氏烟RNA的提取及cDNA合成
选取3周大小的本氏烟,利用OMEGA植物总RNA提取试剂盒提取本氏烟总RNA,经琼脂糖核酸电泳检测,将质量完好的RNA通过诺维赞反转录试剂盒HiScriptII Q Select RT SuperMix for qPCR进行反转录,得到本氏烟cDNA。
1.4 NbOEE2基因的克隆及沉默载体的构建
通过本氏烟基因组网站http://sefapps02.qut.edu.au/blast/blast_link.cgi查找NbOEE2基因信息,设计引物,以本氏烟cDNA为模板,克隆NbOEE2基因。将NbOEE2基因连接到T3克隆载体上备用。NbOEE2基因全长1673 bp,分别设计位于该基因108~434 bp处和621~956 bp处的327 bp、336 bp核酸片段的引物,并在上下游引物的5’端加入限制性酶切位点Xba I和Sma I,并命名为OEE2-S1-F/R、OEE2-S2-F/R,引物序列分别为,OEE2-S1-F:TCTAGATATATTTATATTTGTATAATATTGGCTATAAATCAGAGA,OEE2-S1-R:CCCGGGACAGAACATGT,OEE2-S2-F:TCTAGAGGCGTTAAGCGGTTC,OEE2-S2-R: CCCGGGGGTGAAAGATCGAG。以NbOEE2-T3质粒为模板,扩增目的基因片段。通过跑胶验证回收提取目的片段后,用限制性内切酶Xba I和Sma I对带有限制性酶切位点的目的片段和p-TRV2载体进行双酶切,37 ℃酶切2 h。酶切回收后,将片段与载体按8:2的比例混合,通过takara的Solution I连接酶进行过夜连接,转大肠杆菌DH5α感受态,挑斑验证。测序正确后,得到沉默重组质粒pTRV2-OEE2-S1和pTRV-OEE2-S2。
1.5 本氏烟的沉默与验证
分别将pTRV1、pTRV2载体与两个重组质粒pTRV2-OEE2-S1、pTRV-OEE2-S2转到农杆菌GV3101中。验证转化成功后,挑取含pTRV1、pTRV2和两个重组质粒的农杆菌GV3101的单菌落,接种到含有Rif、Kana 50 µg/µL的LB液体培养基中,放置于28 ℃恒温摇床,220 r/min,培养12 h。室温4000 r/min离心5 min收集菌体;弃上清,10 mM MgCl2洗涤菌体3次;加入适量的10 mM MgCl2(含10 mM MES,200 µM As)溶液悬浮菌体,使悬浮液OD600值达到1.0。将pTRV1分别于pTRV2、pTRV2-OEE2-S1、pTRV2-OEE2-S2等比例混合接种三周大小的本氏烟叶片中。10 d后,采集接种植株的部分叶片,提取RNA,反转录合成cDNA,并运用Primier Quest Tool(http://sg.idtdna.com/Primer Quest/Home/Index)软设计NbOEE2特异性引物,以共接种pPRV1、pTRV2空载体植株作为对照,验证NbOEE2沉默效率。相比于对照,目的基因表达量低于40%即为沉默成功,证明该植株可作为供试植株作为下一步实验的材料。
1.6 在沉默的本氏烟植株上做游动孢子侵染实验
将pBIN-GFP空载体质粒和pBIN-19781质粒转到农杆菌GV3101中,挑斑摇菌并扩大培养。28 ℃恒温摇床,220 r/min,培养12 h后收集菌体并用10 mM MgCl2洗涤菌体3次,加入适量的10 mM MgCl2(含10 mM MES,200 µM As)溶液悬浮菌体,悬浮液OD600值调至0.3左右。在长满辣椒疫霉标准菌株LT1534的燕麦培养基平板上,用手术刀切除1 cm2大小的菌块3~4块,倒入山泉水清洗板上剩余菌丝,每隔30清洗1次,洗7-8次,14 ℃过夜培养,收集产出的游动孢子悬浮液。
分别在pTRV2空载体植株和pTRV2-OEE2-S1、pTRV2-OEE2-S2沉默植株的叶片上接种pBIN-GFP菌液和pBIN-19781菌液,24 h后采集叶片置于培养皿中,接种10 μL辣椒疫霉游动孢子。将接种后的本氏烟叶片放于25 ℃培养箱。2 d后观察差异,分别在日光灯、长波紫外灯下拍照,并进行台盼蓝染色、脱色后拍照。
2 结果与分析
2.1 本氏烟总RNA的提取与cDNA的合成
提取的本氏烟总RNA,通过紫外分光光度计检测分光广度值,OD260/OD280值处于1.9~2.0之间,说明所提取的总RNA纯度较高,较完整,RNA没有被降解且蛋白组污染程度较低。通过琼脂糖凝胶电泳对RNA进行进一步检测,总RNA的28S rRNA、18S r RNA两条带清晰(图1),表明RNA具有较好的完整性未出现降解,且无基因组DNA污染,可以进行下一步反转录实验。
通过反转录,将本氏烟总RNA反转录为高质量的cDNA,为下一步目的片段的扩增提供了模板。
2.2 在本氏烟中克隆效应因子互作蛋白NbOEE2
以本氏烟的cDNA为模板,对互作蛋白OEE2进行特异性扩增,琼脂糖凝胶电泳显示,仅在1600bp左右具有单一性条带,无其他杂带(图2)说明引物特异性高。

图 1 琼脂糖凝胶电泳检测本氏烟总RNA
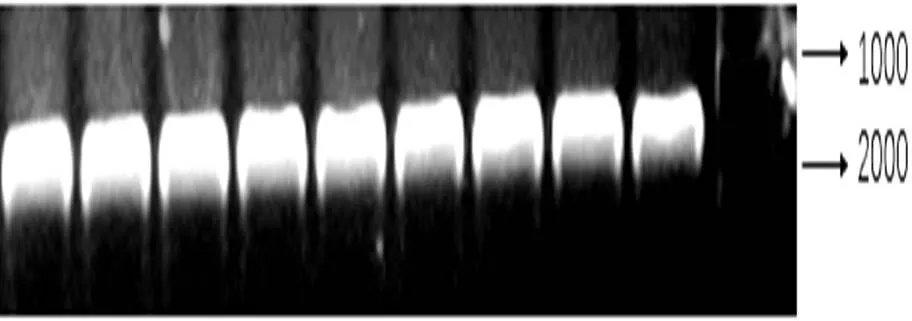
图 2 NbOEE2的克隆

图 3 琼脂糖凝胶验证重组质粒
2.3 沉默载体构建
菌液PCR验证(图3)分析表明,pTRV2-OEE2-S1、pTRV2-OEE2-S2重组质粒构建成功,送公司测序验证正确。
2.4 本氏烟的沉默与验证
通过qRT-PCR验证表明(图4),NbOEE2沉默效率达70%左右,已达到沉默标准,可作为沉默植株进行下一步实验
2.5 辣椒疫霉游动孢子侵染
结果表明,相比于NbOEE2非沉默植株,在NbOEE2非沉默本氏烟植株上,辣椒疫霉效应因子RxLR19781丧失了抑制游动孢子侵染的能力(图5)

图 4 qRT-PCR验证NbOEE2沉默效率

图 5 在沉默NbOEE2植株中RxLR19781不再抑制辣椒疫霉游动孢子侵染
3 讨论
研究表明,辣椒疫霉菌能够在侵染寄主的过程中外泌效应因子,进入到植物细胞中干扰植物自身的防卫反应促进或抑制自身侵染定殖[12,13],效应因子通过与宿主靶标蛋白互作,调控植物的信号通路及代谢活动从而实现自己的功能。因此,为了更好的防治由辣椒疫霉菌引起的辣椒疫病,我们需要对效应分子的互作靶标蛋白蛋白以及效应分子的致病机制进行更加深入的探究。
本研究以本氏烟cDNA为模板,对辣椒疫霉效应因子RxLR19781的互作蛋白NbOEE2进行特异性克隆。找到NbOEE2基因序列中的特异片段,选取300 bp左右,将该特异片段构建到pTRV2沉默载体中,配合pTRV1沉默辅助载体,借助农杆菌侵染系统,对本氏烟进行瞬时沉默,以达到在本氏烟中瞬时沉默NbOEE2的目的。以沉默NbOEE2后的本氏烟为供试植株,验证辣椒疫霉效应因子RxLR19781对游动孢子侵染的抑制作用。结果证明,在沉默NbOEE2的本氏烟中,效应因子RxLR19781不再抑制辣椒疫霉游动孢子侵染,丧失了其免疫活性。因此,我们推断效应因子RxLR19781对辣椒疫霉的抑制作用依赖于NbOEE2。这为我们进一步研究效应因子在寄主体内的作用机理、阐明基因功能通路打下坚实基础,也为研究其他效应因子的作用机理提供了可靠方法。
[1] 付丽.辣椒疫霉(Phytophthora capsica)果胶裂解酶基因克隆及功能研究[D].泰安:山东农业大学,2012:1-2
[2] 蒋玥.辣椒疫霉中3个RxLR效应子的功能研究[C].中国植物病理学会2017年学术年会论文集,2017:1
[3] Lamour KH, Stam R, Jupe J,. The oomycete broad-host-range pathogen[J].Moleclar Plant Pathology, 2012,13(4):329-337
[4] Yu D, Mpina MH, Birch PRJ,. Phytophthora infestans RxLR effector AVR1 interacts with exocyst component Sec 5 to manipulate plant immunity[J]. Plant Physiology, 2015,169(3):1975-1990
[5] 姜海滨,李京,许海青.辣椒疫霉菌效应因子RxLR23克隆与基因敲除体系建立[J].山东农业大学学报:自然科学 版,2017,48(4):491-496
[6] 宋震,李中安,周常勇.病毒诱导的基因沉默(VIGS)研究进展[J].园艺学报,2014,41(9):1885-1894
[7] Senthil-Kumar M, Mysore KS. Tobacco rattle virus-based virus-induced gene silencing in[J].Nature Protocols, 2014,9(7):1549-1562
[8] Ryu CM, Anand A, Li Kang,. Agrodrench: a novel and effective agroinoculation method for virus-induced gene silencing in roots and diverse[J]. The Plant Journal,2004,40(2):322-331
[9] Senthil-Kumar M, Hema R, Anand A,. A systematic study to determine the extent of gene silencing inand otherwhen heterologous gene sequences are used for virus-induced gene silencing [J]. New Phytologist, 2007,176(4):782-791
[10] Czosnek H, Eybishtz A, Sade D,. Discovering host genes involved in the infection by the tomato yellow leaf curl virus complex and in the establishment of resistance to the virus using tobacco rattle virus-based post transcriptional gene silencing[J]. Viruses, 2013,5(3):998-1022
[11] Burch-Smith TM, Schiff M, Liu Yule,. Efficient virus-in-duced gene silencing in Arabidopsis[J]. Plant Physiology, 2006,142(1):21-27
[12] Erbs G, Newman MA. The role of lipopolysaccharide and peptidoglycan, two glycosylated bacterial microbe-associated molecular patterns (MAMPs), in plant innate immunity[J]. Molecu Lar Plant Pathology, 2012,13(1):95-104
[13] Dou D, Kale SD, Wang X,. RXLR-mediated entry ofeffector Avr1b into soybean cell doesnot require pathogen-encoded machinery[J]. Plant Cell, 2008,20:1930-1947
Effect of Silencing Oxygen-enhancing Protein (OEE2) on Immune Function of Phytophthora capsici Effect Factor RxLR19781
LIANG Tao1, WANG Li-ying1, ZHU Tong-tong2, MA Yan-fei2, JIANG Wei-lin2, JI Rui-qing1*
1.130118,2.271018,
is a pathogenic oomycetes that has a wide range of parasites and is capable of producing a large number of RxLR effectors to synergistically infect host. The current information indicate that little is known about how theRxLR effector functions in plants. In this study, an effector molecule RxLR19781 was isolated and identified from. In order to preliminarily define the functional properties of RxLR19781, this study used the Tobacco rattle virus (TRV)-mediated gene silencing technology to interact with RxLR19781. The gene NbOEE2 was transiently silenced inNbOEE2 silenced plants were verified by qRT-PCR, and RxLR19781 was inoculated into the silencedplant and the function of the RxLR effector was verified. The results showed that RxLR19781 did not inhibit zoospores infection of Phytophthora capsici on NbOEE2 silenced plants. The results of this study indicate that OEE2 can effectively regulate the functional properties of RxLR19781, which lays a foundation for further research on the functional mechanism of Phytophthora capsici effector RxLR19781.
; effector; TRV; gene silencing
S436.418.1
A
1000-2324(2019)01-0040-04
10.3969/j.issn.1000-2324.2019.01.008
2018-03-12
2018-04-29
国家大宗蔬菜产业技术体系(CARS-25-03B)
梁涛(1993-),男,在读硕士研究生.研究方向:植物病原真菌学和真菌资源利用. E-mail:664318370@qq.com
Author for correspondence. E-mail:jiruiqingjrq@126.com

