输出蛋白5的表达与肝细胞癌患者临床病理特征及预后的关系
陈嘉飞,周武汉,王金桂
(福建省莆田市第一医院 肝胆胰脾外科,福建 莆田 351100)
肝细胞癌(hepatocellular carcinoma,HCC)是常见的致死性肿瘤,据报道每年有约750000新发HCC病例,过去几十年随着诊断技术和手术的进步,HCC患者的预后有一定提高,但5年生存率也仅有26%[1]。肝硬化及乙肝病毒导致的慢性炎症是导致HCC发生的主要因素[2]。目前,大部分HCC患者在确诊前已经发展为远处转移,只有少部分患者具有有效的治疗手段[3]。因此,研究HCC发生发展机制,寻找新的早期诊断和预后指标仍是研究的重点。
输出蛋白5(exportin 5,XPO5)是一类在大多数生物体内非编码小RNA前体(pre-miRNA)转运受体所必须的受体蛋白,主要负责转运premiRNA从细胞核进入到细胞质[4-5]。据报道[6],碳末端的突变引起XPO5蛋白失活导致包括结肠癌、胃癌和子宫内膜癌中微卫星不稳定性。有研究[7-9]表明XPO5基因3'端非翻译区的rs11077单核苷酸多态性会增加肾癌、结肠癌的患病风险,并与非小细胞肺癌患者预后显著相关。这些研究结果提示,XPO5基因可能参与调控肿瘤的发生发展。然而XPO5蛋白在HCC中的表达及其与临床病理特征间的关系尚不清楚。本文通过研究XPO5蛋白在HCC组织中的表达,探讨了XPO5蛋白表达与HCC患者临床病理因素间的关系及对预后的影响。
1 材料与方法
1.1 标本来源
收集2014年1月—2015年6月在我院手术切除的HCC患者标本。纳入标准:⑴ 具有详细完整的临床病例信息;⑵ 所有病例均由病理医师确诊为HCC;⑶ 术前未经放化疗;⑷ 所有患者均行切除术,且切缘为阴性。剔除标准:病例随访资料或临床病例信息不全者。手术后通过电话或门诊随访获得肿瘤复发和总生存时间,随访到2018年6月截止,共得到HCC标本92例。组织标本经手术切除后迅速分块,部分经过福尔马林固定后包埋于石蜡中,一部分放入-80 ℃冰箱保存备用。采用液氮研磨法提取标本中蛋白行Western blot实验。通过石蜡切片制作4 μm切片行免疫组化检测XPO5蛋白在组织样本中的表达。
1.2 主要试剂
总蛋白提取试剂RIPA裂解液、蛋白酶抑制剂、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒及电泳溶液、超敏ECL化学发光试剂盒均购自上海碧云天生物技术有限公司。GAPDH兔抗人单抗、XPO5兔抗人单抗、山羊抗兔HRP偶联标记的二抗均购于美国Cell Signaling Technology公司。免疫组化MaxVisionTM试剂盒购自福州迈新生物技术开发有限公司。
1.3 Western blot检测
-80 ℃冰箱冻存的组织标本经研磨后加入RIPA裂解液提取蛋白,采用BCA法测定蛋白浓度,取相同总量(30 μg)蛋白加入等体积2×电泳加样缓冲液煮沸10 min。经SDS-PAGE凝胶电泳分离后,浓缩胶50 min,分离胶1 h,转印到PVDF膜。5%脱脂奶粉封闭30 min后,加入XPO5(1:300)或者GAPDH(1:300)一抗4 ℃孵育过夜,室温下漂洗3次。37 ℃孵育辣根过氧化物酶(HRP)标记的二抗1 h,漂洗3次后,采用ECL化学发光试剂盒显影蛋白条带。
1.4 免疫组化检测
免疫组化实验步骤按免疫组化试剂盒说明书步骤进行。组织石蜡切片于67 ℃烘片2 h,经二甲苯和梯度酒精脱蜡至水。抗原修复方法采用柠檬酸盐缓冲液微波煮沸修复,自然冷却后加入阻断剂阻断内源性过氧化物酶活性,PBST清洗3次。3% BSA封闭1 h后直接滴加XPO5一抗稀释液(1:300),4 ℃孵育过夜,漂洗3次。37 ℃孵育二抗1 h,PBST清洗3次。DAB显色试剂显色,当目标蛋白出现显色且相对较弱时终止显色。根据阳性细胞百分比及显色深浅分级,表达强度用组织学评分(∑pi)表示:p代表同一染色强度细胞所占计数细胞百分数(即阳性细胞百分率),无细胞显色或阳性细胞百分数<5%为0,5%~35%细胞显色为1,36%~65%细胞显色为2,>66%细胞显色为3;i代表细胞浆显色深浅或染色强度,不显色或显色不清为0,浅黄色为1,棕黄色为2,深褐色为3。将所有HCC组织标本按评分高低分为高表达组及低表达组,即评分总和≤3分为低表达组,>3分为高表达组。
1.5 统计学处理
采用SPSS20.0统计软件,实验数据以均数±标准差(±s)表示,统计处理采用独立t检验对组间进行比较;计数资料采用χ2检验。患者总生存率和无瘤生存率均采用Kaplan-Meier分析,单因素和多因素分析采用Cox回归模型。P<0.05为差异有统计学意义。
2 结 果
2.1 Western blot检测XPO5在HCC组织中的表达
Western blot检测结果显示,XPO5蛋白在HCC组织中的表达量均高于其对应癌旁组织(图1)。

图1 Western blot检测XPO5蛋白表达 N:癌旁组织;T:HCC组织Figure1 XPO5 protein expression determined by Western blot N:Ajacent tissues; T:HCC tissue
2.2 免疫组化检测XPO5在HCC组织中的表达
免疫组化示,正常肝组织中XPO5表达强度低,其完全定位在细胞质中(图2A);在HCC组织中,XPO5整体表达高于正常组织。其中XPO5低表达组织其主要定位在细胞浆,少部分有细胞核表达(图2B);而在XPO5高表达组织,XPO5除了定位在细胞质中,细胞核也出现表达(图2C)。

图2 免疫组化XPO5蛋白表达(×100) A:正常肝组织;B:HCC组织XPO5低表达;C:HCC组织XPO5高表达Figure2 Immunohistochemistry staining for XPO5 protein expression (×100) A:Normal liver tissue; B:HCC tissue with low XPO5 expression; C:HCC tissue with high XPO5 expression
2.3 XPO5蛋白表达水平与HCC临床病理因素的关系
XPO5蛋白表达水平与患者性别、年龄、血清AFP水平、HbsAg及血管浸润、肿瘤部位和血管浸润无关(均P>0.05),与肿瘤大小、分化程度、临床分期、远处转移及肝硬化有关(均P<0.05)(表1)。
2.4 XPO5表达水平与HCC患者预后间的关系
XPO5低表达组1、5年无瘤生存率高于高表达组(78.5%vs.46.8%,37.4%vs.20.3%,均P<0.01);XPO5低表达组1、5年总生存率高于高表达组(91.2%vs.75.9%,58.8%vs.36.1%,均P<0.01)(图3)。
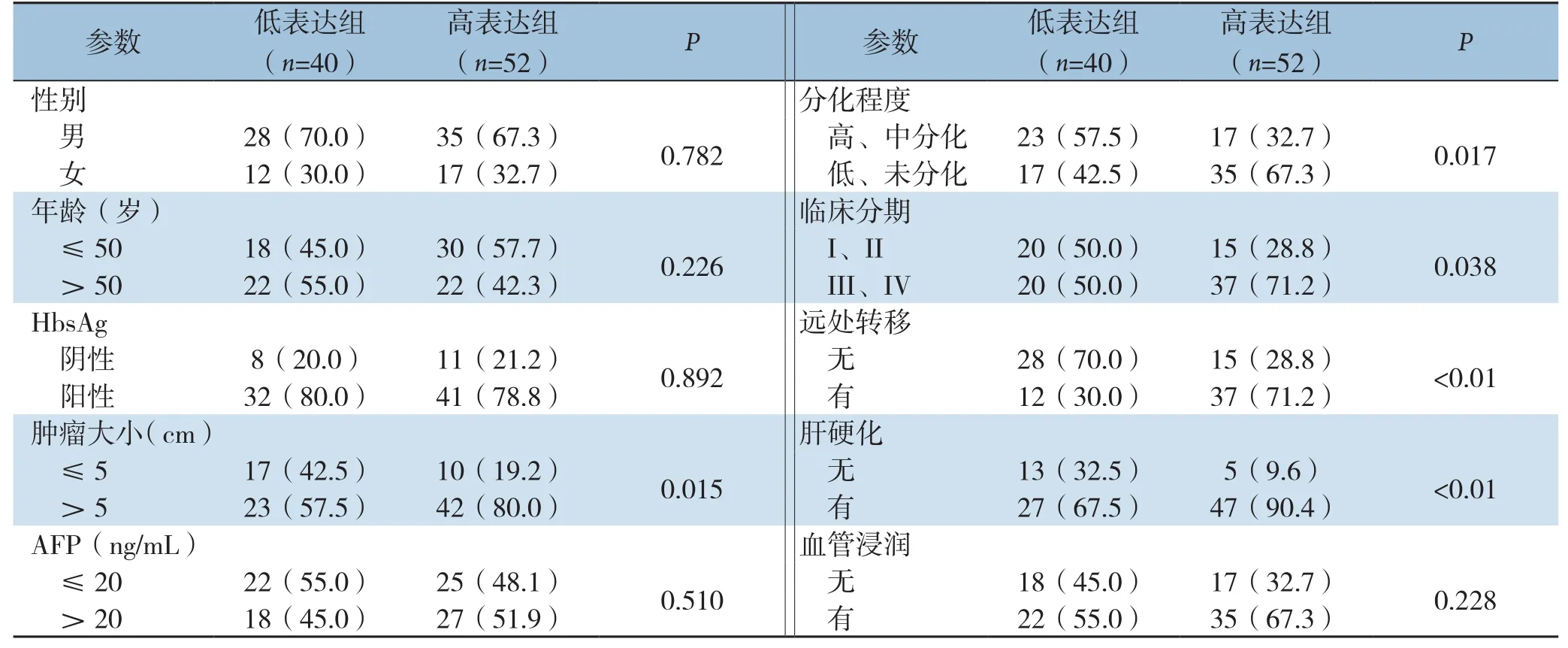
表1 XPO5表达与HCC患者临床病理特征的关系[n(%)]Table1 Relations of XP05 expression with clinicopathologic features of HCC patients [n (%)]
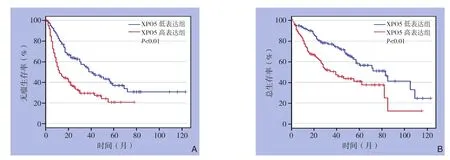
图3 不同XPO5表达水平HCC患者的生存曲线Figure3 The survival curves of HCC patients with different XPO5 expression levels
2.5 影响HCC患者无瘤生存及总生存的危险因素分析
单因素和多因素Cox风险回归模型分析示,血管浸润(P=0.032)、远处转移(P=0.025)及X P O 5表达(P=0.036)均是影响H C C患者无瘤生存的独立危险因素(表2);临床分期(P=0.012)、远处转移(P=0.028)及XPO5表达(P=0.013)是影响HCC患者总生存的独立危险因素(表3)。
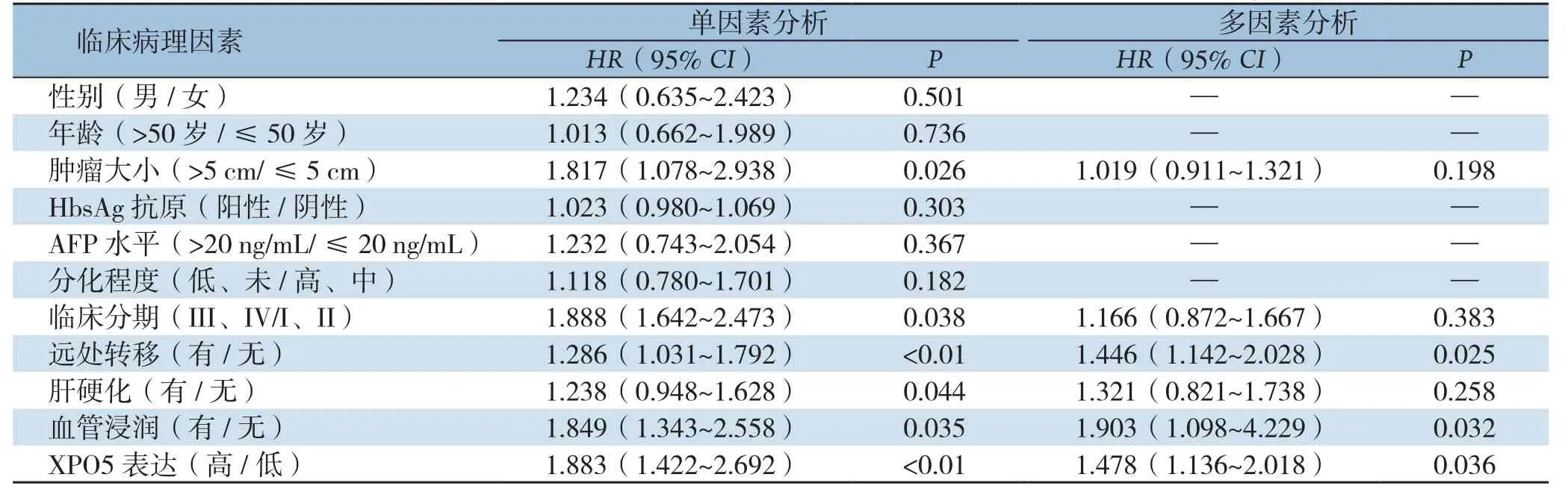
表2 单因素及多因素分析HCC患者无瘤生存期相关的危险因子Table2 Univariate and multivariate analysis of risk factors for disease-free survival in HCC patients

表3 单因素及多因素分析HCC患者总生存期相关的危险因子Table3 Univariate and multivariate analysis of risk factors for overall survival of HCC patients
3 讨 论
HCC的发病存在明显的地域差异,在东亚国家包括中国和南非发病率尤其高[10]。在过去几十年,HCC手术切除后5年复发率高达50%~70%,导致HCC患者生存率仍很低[11-12]。
miRNA是一类非编码蛋白质的RNA,通过结合靶基因的mRNA导致其降解从而抑制基因表达[13-14]。miRNA的生物学合成过程涉及到多个步骤,包括由RNA聚合酶II对原miRNA(primiRNA)的转录,Drosha对pri-miRNA的剪切成pre-miRNA,再由XPO5将pre-miRNA由细胞核转运到细胞质中,经过Dicer酶的加工形成成熟的miRNA发挥基因沉默功能[15]。XPO5属于核转运蛋白β家族成员,其主要功能是将pre-miRNA从细胞核转运到细胞质中;XPO5在多种底物的核浆运输中发挥重要功能[5]。在细胞周期中,XPO5通过依赖于磷脂酰肌醇3-激酶转录后机制迅速提高细胞整体miRNA水平,抑制XPO5导致细胞增殖受抑制[16]。除了转运pre-miRNA外,有研究[17-19]证明XPO5还涉及到一些RNA结合蛋白的转运,比如Staufen同系物2、白介素增强结合因子3及核糖体60s亚基的运输。Lee等[20]发现,当XPO5功能异常后,相比于正常细胞系和组织,在肿瘤细胞系和组织中存在大量miRNA基因转录成pre-miRNA,但并不能形成成熟的miRNA。XPO5在肿瘤中异常表达也有报道,比如Chiosea等[21]发现XPO5在前列腺癌中高表达,Varambally等[22]也同样发现XPO5高表达于前列腺癌组织中,并与肿瘤转移相关。本研究发现,XPO5在HCC组织中的表达显著高于癌旁组织,这与之前在其他肿瘤中的报道[8-9]一致。然而,也有文献[23]报道XPO5在支气管肺泡癌中呈低表达状态。这种在不同肿瘤中的表达差异可能跟肿瘤特异性有关。Shigeyasu等[24]也发现XPO5在结肠癌组织中表达量显著升高,且XPO5高表达与患者恶性临床病理特征和预后差显著相关。本研究结合临床病理特征分析也同样发现,高表达XPO5的HCC患者与恶性临床病理因素呈正相关。Cox风险比例回归模型单因素和多因素分析提示,XPO5可作为判断HCC患者术后肿瘤复发和预后不良的独立风险因子。
Sun等[25]研究发现细胞外调节蛋白激酶的激活能够磷酸化XPO5,磷酸化的XPO5其构象发生改变,转运pre-miRNA的能力下降,导致细胞整体miRNA的水平下降并促进肿瘤发生。本研究仅限于XPO5表达与HCC患者临床病理参数的关联性研究,根据本研究结果发现XPO5在HCC中起到促进肿瘤进展的作用。结合之前的报道我们推测,在HCC中XPO5过表达的原因和可能的促癌功能有下几点。首先,XPO5可能存在基因突变导致翻译的蛋白功能丧失,HCC细胞会通过高表达该基因企图来弥补这部分丧失的功能;其次,HCC细胞高表达XPO5导致合成转运的促进肿瘤发生发展的miRNA更快的生物合成,加速肿瘤进展。
综上,XPO5在HCC组织中呈高表达,并与患者恶性病理特征及预后差相关。XPO5蛋白表达水平可作为判断HCC患者术后肿瘤复发和不良预后的重要指标,进一步深入研究XPO5在HCC中的作用机制将有望为寻找新的治疗靶点提供理论基础。

