吴茱萸碱联合吉西他滨对舌鳞癌荷瘤裸鼠模型的抑制作用及其机制研究
刘延美,汪 静,李 月,赵家元,袁雪敏,祝静莉,王 静*
1镇江市口腔医院,镇江 212002; 2兰州大学口腔医学院,兰州 730000
舌鳞癌的发病率一直位居口腔颌面部癌之首。传统手术及放化疗等治疗舌癌带来的致残性和全身毒副反应等尚不能达到理想的治疗效果。吴茱萸碱(Evodiamine,Evo)是从吴茱萸果实中提取的一种重要的生物碱成分,已知具有血管舒张、镇痛、抗炎和抗肿瘤等药理作用。据报道它是通过抗增殖和诱导肿瘤细胞凋亡对癌症产生抑制作用[1-3]。尽管学者们对Evo的抗癌活性做了一些研究,但其作用机制到目前仍不完全清楚。
中西医结合法不仅能够增强抗癌疗效、减少毒副反应、延长生存期、提高生存质量、减少手术并发症,而且能提高机体的免疫力。Du等[4]研究结果显示,与小檗碱或Evo单独处理相比,小檗碱和Evo联合处理以时间依赖性方式协同抑制MCF-7细胞的增殖并使细胞处于G0 / G1期,表现为CDK抑制、p21和p27的表达水平增加,同时伴随着细胞周期关卡蛋白、细胞周期蛋白D1、细胞周期蛋白E、CDK4和CDK6的表达水平的降低。我们课题组前期体内外实验研究也已证实Evo联合放射线治疗能够增强胃癌SGC7901细胞的放射敏感性,抑制舌鳞癌Tca-8113 细胞及裸鼠移植瘤的生长[5-7]。为进一步了解Evo联合治疗的作用疗效,本研究首次将中药Evo联合西药吉西他滨(Gemcitabine,Gem)对舌鳞癌荷瘤裸鼠进行干预,观察联合治疗对裸鼠移植瘤的抑制作用,了解其毒副反应,并对诱导细胞凋亡的分子机制进行初步探讨,从而为Evo联合化疗药物在生物医学领域中的应用提供理论基础,为舌鳞癌的防治提供新的思路。
1 实验材料
1.1 肿瘤细胞
Cal-27舌鳞癌细胞由我实验室保存,培养于含体积分数10% 的胎牛血清的 DMEM 培养液中,在37 ℃、含5% CO2浓度的培养箱中培养,当细胞单层贴壁生长铺满瓶底70%~80% 时,0.25%胰蛋白酶消化并传代。
1.2 实验动物
BALB/C nu/nu裸小鼠,雄性,4~5周龄,18~22 g,购自北京维通利华实验动物有限公司(合格证书号:SCXK(京)2012-0001),饲养于甘肃中医药大学SPF级中心实验室,所用笼具、垫料、饲料、饮用水均经过高温高压蒸汽灭菌处理。
1.3 药物及试剂
吴茱萸碱(中国食品药品检定研究院,中国;质量分数>99%)使用前溶于蒸馏水中,吉西他滨(ELI LILLY公司,法国)使用前溶于0.9%氯化钠注射液中;高糖DMEM细胞培养基(GiBco公司,美国);二甲基亚砜(Sigma公司,美国);胎牛血清(浙江天杭生物科技股份有限公司,中国);Anti-P65抗体(Sigma公司,美国);Anti-Ik-βα抗体(Abbkine公司,美国);Anti-Bcl-2,Anti-Bcl-xl,Anti-Bax及Anti-β-actin 抗体(Immuno Way公司,美国);兔SP免疫组化试剂盒(北京中杉金桥生物技术有限公司,中国)。
2 实验方法
2.1 舌鳞癌荷瘤裸鼠模型建立
胰蛋白酶消化对数生长期Cal-27细胞,1 000 rpm离心5 min后将细胞重悬于不含血清的DMEM培养基中。0.2 mL/只注射于裸小鼠左腋侧皮下,每只裸鼠注射2×106个细胞。
2.2 实验分组及药物干预
移植瘤直径长至约5 mm时,将裸鼠按体重大小随机分为模型对照组(Control)、吴茱萸碱组(Evo)、吉西他滨组(Gem)和联合组(Evo+Gem),模型对照组腹腔注射0.2 mL生理盐水,吴茱萸碱组灌胃给予Evo(10 mg/kg/0.2 mL),吉西他滨组腹腔注射Gem(50 mg/kg/0.2 mL),联合组为灌胃给予Evo(10 mg/kg)和Gem(50 mg/kg)各0.2 mL,每3天一次,前后共用药10次,末次用药3天后颈椎脱臼法处死裸鼠。
2.3 生活指标观察
从分组当天开始,每3天测量一次裸鼠的进食量及进水量,每7天测量一次裸鼠对外界刺激反应频率并绘制折线图。
2.4 HE染色观察肿瘤及各脏器组织形态
瘤体用10%中性福尔马林溶液固定,石蜡包埋,制成4 μm切片,二甲苯脱蜡,经各级乙醇至水,苏木素染色,盐酸乙醇分化,返蓝,伊红染色,脱水,透明,封片,中性树脂封固,镜下观察。
2.5 透射电镜观察肿瘤细胞超微结构
肿瘤组织样品用2.5%戊二醛预固定,1/15M PBS液漂洗3次,10~15 min/次,1%四氧化锇后固定1.5 h,1/15M PBS液漂洗3次,10~15 min/次,乙醇梯度脱水,10~15 min /次,100%纯丙酮2次,20 min /次,包埋剂(1:1丙酮:EPON-812树脂(Shell Chemicals,Houston,TX))浸透1 h,包埋,35 ℃/24 h、45 ℃/24 h、68 ℃/24 h聚合,置LKB超薄切片机上作超薄切片,厚约50~70 nm,切片置于覆有200目的铜网上,枸橼酸铅、醋酸柚双染,透射电镜下观察。
2.6 免疫组织化学染色观察移植瘤组织中P65、Ik-βα、Bcl-2、Bax的表达。
石蜡切片烤片,脱蜡,经各级乙醇至水,修复液修复,依次加入内源性过氧化物酶阻断剂,封闭用正常山羊血清工作液,一抗(P65、Ik-βα、Bax、Bcl-2)室温下孵育过夜。滴加生物素标记山羊抗兔IgG,室温孵育15 min,滴加辣根酶标记链霉素卵白素工作液,室温孵育15 min。DAB显色,脱水,透明,封片,中性树脂封固,镜下观察。
2.7 Western blot分析Ik-βα及 Bax的蛋白表达
提取移植瘤组织蛋白,加SDS-PAGE蛋白上样缓冲液,95 ℃加热5 min使蛋白质变性,微量分光光度计测定蛋白含量,调整每个样品蛋白浓度。根据目的蛋白分子量大小配制分离胶、积层胶进行电泳、转膜,牛奶封闭,一抗(Anti- Ik-βα:1∶1 000; Anti- Bax:1∶1 000)孵育过夜,洗膜,二抗孵育,暗盒内曝光分析。
2.8 统计学处理
3 实验结果
3.1 吴茱萸碱联合吉西他滨显著抑制了裸鼠皮下移植瘤的生长
末次用药后3天处死动物获取肿瘤组织观察,干预组瘤体体积明显小于模型对照组,联合组体积最小。
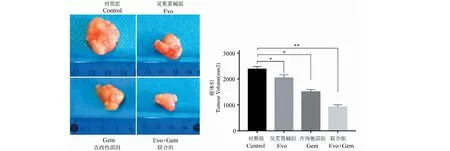
图1 裸鼠移植瘤代表性图像及瘤体积Fig.1 Representative images and tumor volumes of transplanted nude mice 注:与模型对照组比较,*P<0.05;**P<0.01。Note:compared with the model control group, *P<0.05;**P<0.01.
3.2 吴茱萸碱联合吉西他滨对舌鳞癌荷瘤裸鼠生活质量的影响
给药期间,各组裸鼠进食量、进水量、对外界刺激反应频率均有下降趋势,与模型对照组相比,药物干预组下降缓慢(P<0.05),联合组下降最慢(P<0.01),提示联合治疗提高了荷瘤鼠的生活质量。

图2 裸鼠进食、进水量及应激反应变化曲线图 Fig.2 Curve of feeding,water intake and stress response of nude mice 注:与模型对照组比较,*P<0.05;**P<0.01。Note:Compared with the model control group, *P<0.05;**P<0.01.
3.3 吴茱萸碱联合吉西他滨对舌鳞癌荷瘤裸鼠生物毒性影响
由图3可知,各组裸小鼠的心肌组织纤维排列致密,结构清晰,未见异常;肝小叶结构完整,肝细胞排列整齐,形态正常,未见明显病理改变;肺组织支气管、肺泡结构清晰,支气管上皮完整,肺泡结构连续,肺泡壁完整,肺泡间隔无充血水肿,肺泡腔无扩大,且未见明显渗出;脾脏组织的红髓、白髓及边缘界清晰,形态均未见异常;肾组织的肾小球、肾间质血管及肾小管上皮细胞正常,未见明显病理改变。
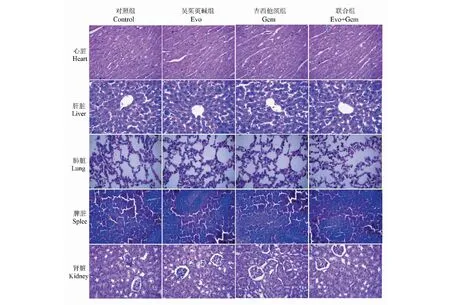
图3 HE染色观察脏器组织形态(×400)Fig.3 HE staining to observe the organ morphology (×400)

图4 移植瘤组织石蜡病理光学显微镜切片(×400) Fig.4 Paraffin pathological light microscopy (×400) of transplanted tumor tissue
3.4 肿瘤组织HE染色观察
模型对照组癌细胞丰富,生长旺盛,呈弥漫性生长,肿瘤细胞大小不一,形态各异,异型性明显,分化差,核浆比例大,染色较深,形态不规则,病理性核分裂像多见;Evo组肿瘤细胞排列较规则,数目减少、体积减小,异型性小,核固缩,核分裂像少;Gem组肿瘤细胞体积减小,异型性小,分化好,核固缩,核分裂像少;联合组中肿瘤细胞体积减小,异型性较小,分化较好,核固缩,核分裂像少见(图4)。
3.5 免疫组织化学检测分析结果
光学显微镜下观察,Bax蛋白阳性表达为胞质呈棕黄色颗粒,与模型组相比,Evo组、Gem组明显上调,差异有统计学意义(P<0.05),联合组Bax上调最明显(P<0.01)。Bcl-2蛋白阳性表达为胞质呈棕黄色颗粒,Evo组、Gem组表达量明显减少,与模型组比较差异有统计学意(P<0.05),联合组Bcl-2下调最明显(P<0.01)。P65蛋白阳性表达为胞质或(和)胞核呈棕黄色颗粒,Evo组、联合组表达量明显减少,与模型组比较差异有统计学意(P<0.05)。Ik-βα蛋白阳性表达为胞浆呈棕黄色颗粒,Evo组、联合组表达量明显增多,与模型组比较差异有统计学意义(P<0.05)。应用Image-Pro Plus 6.0 软件对蛋白阳性表达进行半定量分析(图5)。
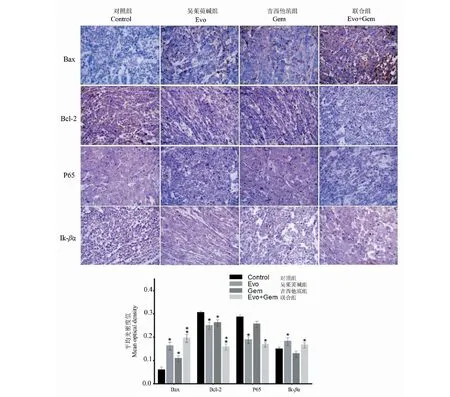
图5 免疫组织化学分析移植瘤组织中Bax、Bcl-2、P65和Ik-βα的蛋白表达 Fig.5 Immunohistochemical analysis of protein expression of Bax,Bcl-2,P65 and Ik-βα in transplanted tumor tissues注:与模型对照组比较,*P<0.05;**P<0.01。Note:compared with the model control group, *P<0.05;**P<0.01.
3.6 透射电镜下肿瘤细胞超微结构
透射电镜下观察模型组肿瘤细胞核体积较大,表面可见微绒毛,胞膜完整,形态不规则,染色质均匀,胞质内可见大量线粒体、游离核糖体及内质网等细胞器;Evo组、Gem组细胞体积变小,染色质边集,呈现高密度影像,微绒毛数量减少或消失,呈现早期凋亡特征;联合组核内异染色质碎裂,边集,浓缩成团块状,分部在核膜内侧,胞膜不完整,核固缩、碎裂,呈现晚期凋亡特征(图6)。
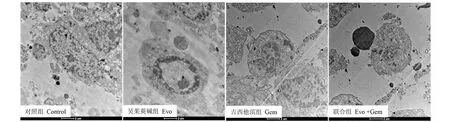
图6 透射电镜观察裸鼠皮下移植瘤肿瘤细胞形态(×6000)Fig.6 Transmission electron microscope observation of tumor cell morphology in nude mice subcutaneous xenografts (×6 000)
3.7 Western blot检测移植瘤组织中 Bax、Ik-βα蛋白表达
如图7所示,与模型对照组相比,Evo组和Gem组均能上调Bax(P<0.05)的表达,与单药组相比,联合组上调更为明显(P<0.01),与模型组相比,Evo组和联合组明显上调了Ik-βα(P<0.05)的表达。

图7 吴茱萸碱联合吉西他滨对移植瘤组织中Bax、Ik-βα蛋白表达的影响Fig.7 Effect of Evodiamine combined with Gemcitabine on expression of Bax and Ik-βα protein in transplanted tumor tissues注:与模型对照组比较,*P<0.05;**P<0.01。Note:compared with the model control group, *P<0.05;**P<0.01.
4 结论
近年来从天然植物中寻找抗癌成分成为学者们研究的热点。Hu等[8]研究结果显示Evo能使BGC-823细胞对放射治疗敏感并显著抑制异种移植瘤的生长。Zhang等[9]研究发现Evo可能通过mTOR/S6K1介导的Mcl-1下调诱导细胞凋亡并增强肿瘤坏死因子相关凋亡诱导配体(TRAIL)诱导的细胞凋亡。我们课题组前期的细胞学实验研究结果显示Evo联合Gem能显著抑制Cal-27舌鳞癌细胞的增殖。基于此,本研究首次将Evo与Gem联合对Cal-27舌鳞癌裸鼠进行药物干预,结果发现两种药物对皮下移植瘤的生长均具有抑制作用(P<0.05),联合应用时作用更为显著(P<0.01)。实验期间,联合组裸鼠进食量、进水量较模型组(P<0.01)及单药组(P<0.05)下降缓慢。实验期间,裸鼠对外界刺激反应频率逐渐减弱,联合组减弱速度最为缓慢(P<0.01)。HE染色观察联合组相比较单药组病理性核分裂像少见,证实两药联合具有协同抑制作用。实验结束时,4个组中无动物死亡,HE染色结果显示四组中五脏器形态结构正常,未见病理改变。以上结果提示吴茱萸碱及吉西他滨均具有抗舌鳞状细胞癌的作用,联合应用时抑制作用更明显,且无明显毒副作用,用药方法及剂量均在安全范围内。
Bcl-2、Bax 是Bcl-2家族中较为经典的抗凋亡及促凋亡蛋白,两者表达的增高和降低很大程度上反应了肿瘤细胞的凋亡水平。P65是NF-κB信号通路中最为典型的成员之一,而Ik-βα则是Ik-β中最典型的成员,也是NF-κB活化过程中最强的负反馈因子,它能与P65结合防止其入核,从而导致NF-κB活化过程的迅速开启和关闭。为了进一步探讨Evo、Gem联合作用的机制,我们检测了移植瘤组织中Bcl-2、Bax、P65,Ik-βα的表达。结果发现Evo组及联合组的P65蛋白表达下调,Ik-βα表达上调。药物干预组相比较模型对照组Bcl-2下调,Bax上调,联合组最为显著(P<0.01)。提示吴茱萸碱联合吉西他滨抑制舌鳞状细胞癌的生长可能与下调NF-κB/p65、Bcl-2,以及上调Ik-βα、Bax等蛋白表达相关。
中药联合化疗因具有增强疗效、减少毒副反应等优势备受大家的关注和重视。虽然吴茱萸碱的抗肿瘤作用已被多位学者证实,但其抗肿瘤发生发展的机制较为复杂,通常涉及多个信号通路。Hu等[10]研究发现WWOX在HepG2和Hepa1-6细胞中的敲除减弱了Evo对癌细胞的生长抑制效应,表明Evo通过WWOX依赖性途径诱导了抗癌活性。Evo可以通过诱导Akt介导的细胞凋亡发挥抗肝细胞癌(HCC)作用[11],或是通过抑制β-连环蛋白而对HCC产生抗肿瘤作用[12]。Lin等[13]研究结果发现,Evo显著降低A549细胞中AKT /核因子-κB(NF-κB)和Sonic hedgehog / GLI家族锌指1(SHH / GLI1)信号通路的活性。Sui等[14]研究首次提出Evo可以通过阻断人类结肠直肠癌中的p-NF-κB信号通路来减弱多药耐药性。Zhao等[15]研究结果表明,Evo通过下调PGI以抑制HCT-116人类结肠直肠癌细胞的迁移,通过失活JAK2 / STAT3途径来调节p53信号传导途径的活性以诱导细胞凋亡并下调MMP3表达。Liu等[16]等研究结果表明Evo在神经胶质瘤细胞中诱导细胞内钙/ JNK信号介导的自噬和钙/线粒体介导的细胞凋亡。Yang等[17]研究结果示:Evo通过诱导SHP-1阻断STAT3信号通路并在体外和体内对肝癌细胞发挥抗肿瘤效应。
吴茱萸碱尚未作为抗肿瘤药物在临床上应用,对其进一步的研究尤其是联合治疗的开发,抗肿瘤分子机制的研究仍然任重而道远。相信随着对吴茱萸碱研究的进一步深入,其抗肿瘤作用及联合作用的机制将逐渐被阐明,从而有一个更加清楚和全面的了解,为其应用开拓一片更广阔的天地。
——以吴茱萸为例

