IgG4相关性疾病合并肺腺癌一例
唐露,孔纯玉,戚务芳
IgG4相关性疾病(IgG4-related disease,IgG4-RD)是一种慢性进行性自身免疫病,可累及单一或多个器官,临床罕见,因其起病隐匿,临床表现缺乏特异性,与肿瘤难以区别,给临床诊疗带来了巨大挑战,近年关于IgG4-RD的报道逐渐增多[1],但关于IgG4-RD合并恶性肿瘤的病例国内外报道较少,本文报告1例病理诊断明确的IgG4-RD合并肺腺癌患者,具体情况如下。
1 病例报告
患者 男,42岁。主因发现左颌下肿物4个月,于2018年5月21日入院。患者4个月前无明显诱因出现左侧颌下腺区肿物,界限清楚,活动度可,无压痛,呈渐进性增长,约2 cm×2 cm大小,予抗感染治疗无明显好转,就诊于当地医院行颈深部肿物切除术,病理示:(左颌下区)IgG4相关性硬化性涎腺炎,今为求进一步诊治,门诊以“左颌下肿物”收入院。患者自发病以来,自觉包块部位肿胀、不痛、无瘙痒,无低热、无咳嗽、咳痰,无面瘫、唾液分泌异常,无吞咽困难、饮水呛咳、呼吸困难等,无口眼干燥、关节肿痛、口腔溃疡等症状。患者精神饮食可,睡眠可,二便如常,近1个月体质量减轻约10 kg。否认既往高血压病、糖尿病、冠状动脉粥样硬化性心脏病等病史,否认吸烟饮酒史及家族遗传病史,对青霉素过敏,个人史无特殊。体格检查:体温、脉搏、呼吸、血压均处于正常范围,左侧颌下可见约6 cm手术瘢痕,颈部可触及多发浅表淋巴结肿大,界限清晰,活动可,无压痛,余浅表淋巴结未触及肿大;余无特殊。辅助检查:外院颈深部肿物病理示(左颌下区)IgG4相关性硬化性涎腺炎,7枚淋巴结呈反应性增生,免疫组化示IgG4>50个/HP,IgG4/IgG>45%,CK(+),CD34(+),CD138(+)。入院后查血常规示:红细胞5.92×1012/L,嗜酸性粒细胞0.2×1012/L。血清肿瘤标志物示:角蛋白19片段2.44 μg/L,神经元烯醇化酶14.45 μg/L。IgG4亚型示:IgG1、IgG2、IgG3、IgG4分别为10 300、2 180、135、3 470 mg/L。肺CT示右肺中叶结节,建议进一步检查。18氟代脱氧葡萄糖(18F-Flurodeoxyglucose,18F-FDG)PET/CT检查示右肺中叶结节,直径约1 cm,边缘不光滑,可见多发毛刺,牵拉周围叶间胸膜,近端可见血管影进入,示踪剂浓集,最大标准摄取值(SUVmax)为4.0,考虑恶性可能性大;双侧咽旁间隙、双侧颈部Ⅳ区、左锁骨上窝增大淋巴结,示踪剂异常浓集,较大者短径约0.7 cm,SUVmax为7.09,双侧泪腺增厚,示踪剂异常浓集,SUVmax为5.57,以上病变考虑IgG4相关性疾病可能性大,见图1。结合患者病史及辅助检查,诊断:IgG4相关性疾病合并肺恶性肿瘤。转入我院胸外科行右肺肿物切除术,病理回报腺癌,见图2。免疫组化结果:TTF-1、Napsin A、EGFR(+);ALK、P40(-)。术后患者病情好转出院,出院后规律胸外科化疗,密切随访患者预后。
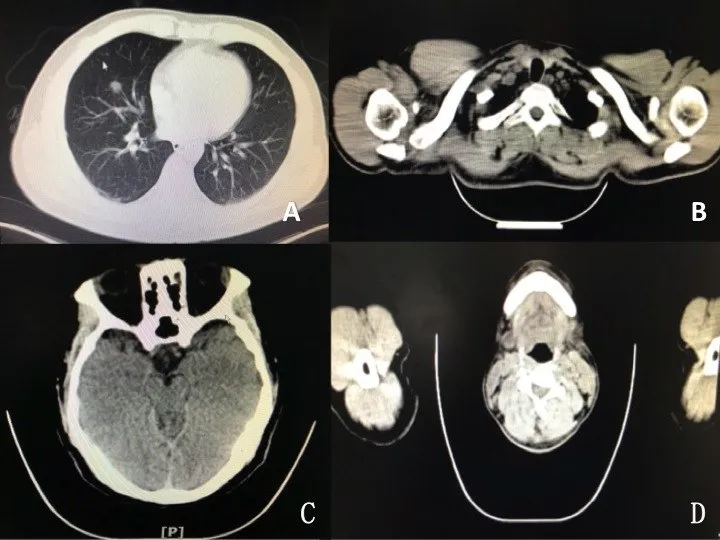
Fig.1 18F-FDG PET/CT images of the patient图1 患者18F-FDG PET/CT显像图

Fig.2 Picture showing the biopsy tissue of lower lobe of the right lung stained by hematoxylin eosin(HE staining,×100)图2 右肺肿物活检组织(HE染色,×100)
2 讨论
IgG4-RD是一种免疫介导的炎症伴纤维化疾病,以血清IgG4水平增高、病变组织见大量IgG4阳性浆细胞浸润为特征,临床表现异质性强,可累及全身多个器官与系统,可仅有一个器官被累及,亦可累及多个器官[1],常见疾病如自身免疫性胰腺炎、腹膜后纤维化、硬化性涎腺炎、硬化性胆管炎、IgG4相关性肾病等。
IgG4-RD多见于中老年人,发病率约(0.28~1.08)/10万[1],男性多于女性[2],国内尚未见流行病学研究。其临床症状因受累器官不同而表现各异,缺乏特异性,临床上极易误诊。目前多采用的是日本2011年制定的IgG4-RD诊断标准[3]:(1)单个或多个器官出现弥漫性或局限性肿大。(2)血清IgG4≥1.35 g/L。(3)组织病理学检查见①大量的淋巴细胞、浆细胞浸润和纤维化,②IgG4阳性浆细胞浸润(IgG4/IgG>40%且IgG4阳性浆细胞>10个/每高倍视野)。符合3条即可确诊,满足(1)和(3)者为可能诊断,满足(1)和(2)者为可疑诊断。如患者表现为单个器官受累,病理示IgG4阳性浆细胞浸润,同时满足以下任两条即可确诊:(1)弥漫性淋巴浆细胞浸润。(2)席纹状纤维化。(3)闭塞性静脉炎。结合本例患者病史及左颌下区肿物病理,IgG4-RD诊断明确。
近几年关于IgG4-RD合并恶性肿瘤的报道逐渐增多,有研究发现IgG4-RD患者的恶性肿瘤发病率是正常人群的3倍[4],两者可同时出现,也可相继出现,该研究指出恶性肿瘤的发生部位与IgG4-RD累及部位不同,本例患者IgG4-RD累及颈部及以上部位,而恶性肿瘤发生在肺部,与上述观点相符,但该观点在国际上尚存在争议[5]。IgG分为4个亚类,IgG4是其中最小的亚群,约占IgG总数的3%~6%。IgG4是具有独特的结构跟功能的抗体,其分子间的二硫键不稳定,带有不同抗原结合位点的IgG4分子之间可发生Fab臂交换(FAE)形成双特异性抗体,无法与抗原交联,不能形成免疫复合物,抗原长期暴露所致的免疫失衡及自身抗体的形成可诱发IgG4-RD的产生。而FAE使得IgG4抗体具有更强的抗体亲和力,在其他IgG亚型的竞争中占优势,IgG4与抑制性Fc受体结合后抑制固有免疫和获得性免疫[6],破坏人体的抗肿瘤免疫,导致肿瘤的发生发展,因此,IgG4-RD患者的恶性肿瘤发病率高于正常人群[4]。还有一种学说指出,恶性肿瘤患者体内的肿瘤细胞发生基因突变,其表达的特殊抗原,可破坏机体免疫平衡,诱导自身免疫疾病如IgG4-RD的发生[7]。
IgG4-RD多表现为受累器官弥漫或局限性肿大,其中IgG4-RD肺部病变可累及肺实质、胸膜、纵隔及气管,临床表现与恶性肿瘤相似,可表现为咳嗽、咳痰甚至咯血,影像学可表现为实性结节型、多发圆形磨玻璃影型、肺泡间质型、支气管血管束型4种形态,各形态可单独存在,亦可并存,本例患者胸部CT示右肺中叶结节,从影像上与肺占位性病变难以区别,需结合血清IgG4水平及组织病理进行鉴别。患者血清IgG水平明显升高,但IgG4水平升高不仅见于IgG4-RD,还可见于恶性肿瘤、哮喘、过敏性皮炎、Castleman病等[3],因此血清IgG4水平是否能作为IgG4-RD的诊断依据目前尚存在争议[8]。目前普遍认为血清IgG4水平与疾病严重程度相关,与受累器官数量呈正相关,是临床上常用于评估疗效的重要指标。因此,血清IgG4水平并不能作为鉴别IgG4-RD与恶性肿瘤的依据。
PET/CT可将解剖结构影像与功能代谢影像相结合,广泛应用于肿瘤及炎症病变等的诊断及鉴别,在IgG-RD与恶性肿瘤疾病的鉴别上具有明显的诊断优势,临床上最常用的显像剂是18F-FDG。IgG4-RD的病理表现为大量炎性细胞浸润,导致病变部位糖酵解增加,在PET/CT上表现为均匀18F-FDG高摄取,SUVmax为 3.4~14[9],其主要优势是不仅可以发现临床症状为导向的局部病灶,还可以发现其他部位的受累病灶,提高IgG4-RD诊断的准确率。本例患者PET/CT示双侧咽旁间隙、双侧颈部Ⅳ区、左锁骨上窝多发小结节影,示踪剂异常浓集,形态规则,未见明显血管影,属于良性病变,符合IgG4-RD常见累及部位及SUVmax值范围,考虑IgG4-RD可能;右肺中叶可见直径约1 cm的结节,边缘可见多发毛刺,近端可见血管影进入,SUVmax为4.0,考虑恶性可能性大,经病理组织活检诊断为腺癌。本病例提示当IgG4-RD与恶性肿瘤在PET/CT上均表现为高代谢时,则需综合其SUVmax、受累部位、形态学及血供情况进行判断,对于难以鉴别的病例,2015年《IgG4-RD管理和治疗的国际共识指南》推荐,建议行组织活检鉴别与IgG4-RD类似的疾病及肿瘤性病变[10]。
IgG4-RD与恶性肿瘤在发病过程中存在微妙的联系,临床易误诊误治,近几年关于IgG4-RD合并恶性肿瘤的报道逐渐增多[4],一旦误诊,有导致病情延误甚至恶化的风险,因此尽早明确诊断对临床工作有重要的指导作用,可结合血清IgG4水平及PET/CT等影像学检查方法进行鉴别,确诊依赖病理,诊断时需警惕2种疾病并存的情况。IgG4-RD与恶性肿瘤间的确切关系及分子机制仍需长时间大样本的临床研究来证实及进一步探索。

