四逆散通过MAPKs/NF-κB途径保护脂多糖致Raw264.7的细胞炎症
范慧婕, 谭章斌, 赵晓山, 梁红峰, 刘彬, 周迎春
(1. 南方医科大学 中医药学院, 广东 广州 510515; 2.阳江市人民医院中医科, 广东 阳江 529500; 3.广州医科大学 附属第二医院中医科, 广东 广州 510150)
动脉粥样硬化 (atherosclerosis,AS)是多种心脑血管疾病共同的病理基础,近年来随着AS发病率的增高,心血管、脑血管急性事件的发生率也不断增加,严重威胁人类的身心健康.AS主要是在大、中动脉发生的慢性炎症,以血管壁内脂质沉积和炎症细胞的积聚为特点,炎症反应贯穿于其发生和发展进程中,故抗炎是治疗AS的一个重要手段[1].虽然目前他汀类是治疗AS的主流,但由于长期服用他汀类容易出现肝损伤等不良反应,故临床上仍在积极探索新的防治AS发生发展的药物.中医药作为一个巨大的宝库,经典方剂里面多种中草药的活性成分相辅相成,可从多靶点多环节参与到临床疾病治疗中.故寻找安全有效的中医治疗手段,对AS的临床治疗具有重要意义.
四逆散(Si Ni San, SNS)出自《伤寒论》第318条,“少阴病,四逆,其人或咳,或悸,或小便不利,或腹中痛,或泄利下重者,四逆散主之”,由柴胡、枳实、白芍、炙甘草等量组成,具有透邪解郁,疏肝理脾之功效.既往研究表明四逆散可改善免疫诱导肝纤维化大鼠的肝功能[2],降低高脂血症小鼠的血清总胆固醇[3],改善特应性皮炎小鼠的炎症反应[4]等药理作用.在本研究使用脂多糖(lipopolysaccharide, LPS)诱导的小鼠单核巨噬细胞(Raw264.7)细胞,构建AS的体外细胞炎症模型,通过检测SNS对LPS诱导的Raw264.7细胞炎症因子释放,及对MAPKs/NF-κB途径的影响,初步探讨SNS对AS的作用和潜在的作用机制,为临床AS治疗研究提供实验依据.
1 材料与方法
1.1 实验细胞
小鼠单核巨噬细胞(Raw264.7)细胞购买自中国科学院上海细胞库.
1.2 实验材料
SNS中的柴胡、芍药、枳实、炙甘草由广州致信药业股份有限公司生产,其质量满足2010版《中国药典》的规定.LPS由上海源叶生物科技有限公司提供.胎牛血清(FBS)、高糖DMEM、青链霉素溶液、质量分数为0.25%含有EDTA的胰酶等常规细胞培养试剂皆购买自Gibco生物科技有限公司.白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)试剂盒购买自瑞博奥生物科技有限公司.实验中使用到的抗体(P-ERK/ERK、P-p38/P38、P-JNK/JNK、P-p65/P65、P-IKβ-α、GAPDH,Lamin B)皆从美国Cell Signaling公司购买.Fluorescent Conjugates of Lipopolysaccharides (LPS) 488 购买自美国Thermo科技有限公司.
1.3 实验方法
1.3.1 Raw264.7细胞炎症模型的构建
用含有质量分数为10%胎牛血清(fatal bovine serum,FBS)的高糖DMEM培养基在含有体积分数为5% CO2,37 ℃的培养箱中培养Raw264.7细胞,待细胞生长到80%左右即可传代,光镜下观察细胞形态,状态稳定后用于实验.不同质量浓度SNS干预细胞24 h后加入LPS刺激24 h,检测各组细胞炎症因子释放水平;或不同质量浓度SNS干预细胞24 h后加入LPS刺激30 min,检测各组细胞MAPKs/NF-κB信号通路的磷酸化改变.
1.3.2 SNS的准备
柴胡10 g,芍药10 g,枳实10 g,炙甘草10 g, 共40 g.加纯净水没过药面大概2 cm, 浸泡30 min,随后武火加热煮沸,换文火继续煎煮,大概约30 min.把汤剂盛出后,继续加入等量的纯净水同样方法煎煮,重复2 次.最后把全部所得的汤剂混合,并加热浓缩,直到剩余100 mL,再用 0.45 μm 的滤嘴过滤药液,分装后放于-20 ℃保存.
1.3.3 实验分组
实验分为5个组,空白组(Control组)、模型组(LPS组)、SNS低、中、高质量浓度组.空白组用普通的全培培养.模型组(LPS组)加入100 ng/mL的LPS培养.SNS低、中、高质量浓度组分给予含有终质量浓度为10, 20及40 μg/mL的SNS培养基培养.
1.3.4 观察指标
(1)光镜下观察SNS对LPS诱导的细胞分化作用:取对数生长期,状态良好的Raw264.7细胞,接种到24孔板中,接种时细胞密度约在5×104细胞/mL,SNS低、中、高浓度组分给予含有终质量浓度为 10, 20, 40 μg/mL 的SNS培养基培养24 h,随后SNS各质量浓度组及模型组加入LPS(终质量浓度为 100 ng/mL)继续培养24 h.最后在倒置光学显微镜下观察各组细胞形态的变化.
(2)Elisa检SNS对LPS诱导的IL-6、TNF-α炎症因子释放影响:将细胞培养在12孔板中,细胞分组和培养方法同上,给药组给予不同质量浓度SNS干预24 h后,SNS各质量浓度组及模型组加入LPS(终质量浓度为 100 ng/mL)继续培养24 h.最后使用Elisa检测试剂盒检测各组培养基上清的IL-6、TNF-α的含量.
(3)Western-blot检测SNS对LPS活化MAPKS/NF-κB途径的作用:将细胞培养在直径6 cm的培养皿中,细胞分组和培养方法同上,给药组给予不同质量浓度SNS干预48 h后,SNS各质量浓度组及模型组加入LPS(终质量浓度为 100 ng/mL)继续培养30 min.按照试剂盒的方法提取细胞总蛋白/核蛋白、BCA法检测蛋白浓度、加热蛋白使其变性、配胶、上样、电泳、转膜、封闭、孵育一抗、二抗等步骤后,加入曝光液曝光,以GAPDH或Lamin B作为内参, 最后用Image J 分析和比较各组不同条带的灰度值.
(4)免疫荧光检测SNS对NF-κB(p65)转录入核的影响:将细胞培养在6孔板中,种板前培养板中先置入圆形的玻片以便细胞爬片.细胞分组和培养方法同上,给药组给予质量浓度40 μg/mL的SNS干预48 h后,于SNS组及模型组加入LPS(终质量浓度为 100 ng/mL)继续培养1 h,随后PBS清洗3次,质量分数为4%多聚甲醛固定30 min后继续PBS清洗3次,依次加入破膜液、室温孵育、PBS清洗、封闭、孵育NF-κB(p65)一抗、PBS清洗、孵育二抗、PBS清洗、孵育DAPI染液、PBS清洗,实验荧光显微镜进行观察与拍照.
(5)免疫荧光检测SNS对LPS binding 荧光的作用:将细胞培养在6孔板中,种板前培养板中先置入圆形的玻片以便细胞爬片.细胞分为LPS组、四逆散低、中、高质量浓度组,培养方法同上,给药组给予不同质量浓度的SNS干预40 h后,于SNS组及模型组加入10 μL的 LPS binding染色剂,刺激 8 h,随后用PBS清洗3次,孵育DAPI染液 10 min,再使用PBS清洗3次,使用正置激光共聚焦显微镜观察与拍照.
1.4 统计学分析
2 结果
2.1 SNS对LPS诱导的细胞分化作用
图1 光镜下的结果显示,模型组中LPS刺激可诱导Raw264.7细胞分化,与空白组细胞的形态相比,细胞的伪足增加,细胞由透亮的圆形分化为星形、多角形、梭形等,而不同浓度SNS预处理组的细胞形态较LPS组好转,细胞的多形性降低,并呈质量浓度依赖性.
2.2 SNS对LPS诱导的IL-6、TNF-α炎症因子释放影响
图2所示,与空白组相比,LPS干预Raw264.7细胞24 h后,细胞上清中IL-6、TNF-α炎症因子含量增加(P<0.01);而与LPS组相比,SNS干预组的IL-6、TNF-α炎症因子降低,呈质量浓度依赖性(P<0.01).
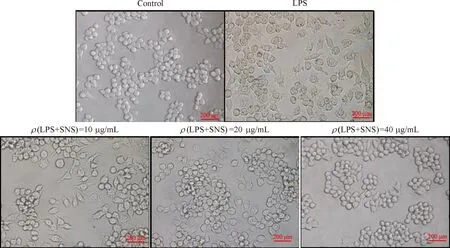
图1 SNS对LPS诱导的细胞分化作用(×400)
Fig.1 SNS inhibited the differentiation of Raw264.7 cells induced by LPS

1)与LPS组相比P<0.01.
2.3 SNS对LPS活化MAPKs家族蛋白的影响
图3所示,本组使用Western-blot的方法对MAPKs家族蛋白中的P-ERK/ERK、P-p38/P38、P-JNK/JNK进行了分析.结果提示:与空白组相比,LPS干预Raw264.7细胞30 min后, MAPKs家族蛋白磷酸化受到激活,P-ERK、P-p38、P-JNK含量增加(P<0.01);同时,与LPS组相比,SNS干预组的P-ERK、P-p38、P-JNK含量降低,呈质量浓度依赖性(P<0.01).
2.4 SNS对LPS活化NF-κB (p65)途径的影响
图4结果显示,与空白组相比,LPS组的IKβ-α和p65的磷酸化上调(P<0.01);与LPS组相比,在SNS预给药48 h后,LPS刺激的IKβ-α和p65磷酸化受抑制(P<0.01),且呈质量浓度依赖性. 图4-C的结果显示空白组Raw264.7细胞核中p65含量较低,但使用LPS刺激60 min后,p65核

1)与LPS组相比,P<0.01.
内表达增加 (P<0.01).与 LPS 组相比,在SNS预处理48 h后,使用LPS干预Raw264.7细胞60 min,p65核中表达受抑制(P<0.01),并呈浓度依赖性.
2.5 SNS对NF-κB (p65)转录入核的影响
图5所示空白组在无LPS干预的条件下,NF-κB (p65, 红色荧光)主要存在于胞浆内,细胞核内含量很少.质量浓度为100 ng/mL的LPS 干预Raw264.7细胞1 h 后,在细胞核中可见到大量的红色荧光,而用质量浓度为40 μg/mL的SNS提前干预细胞,发现细胞核中,由 LPS 诱导的红色荧光大大减少,提示 NF-κB (p65)核转位受到抑制,说明SNS可明显抑制NF-κB (p65)的活化.

1)与LPS组相比,P<0.05; 2)与LPS组相比,P<0.01.
图4 SNS对LPS活化NF-κB (p65)途径的影响
Fig.4 Effects of SNS on NF-κB (p65) pathway phosphorylation induced by LPS
2.6 SNS对LPS binding与Raw264.7细胞膜结合的作用
图6所示,与LPS组相比,提前使用SNS干预细胞后,再用同样浓度的LPS 488作用于Raw264.细胞,Raw264.7细胞的绿色荧光大大减少,说明SNS可质量浓度依赖性地抑制LPS与Raw264.7细胞膜结合,故SNS组绿色荧光强度降低.

图5 SNS对NF-κB (p65)转录入核的影响
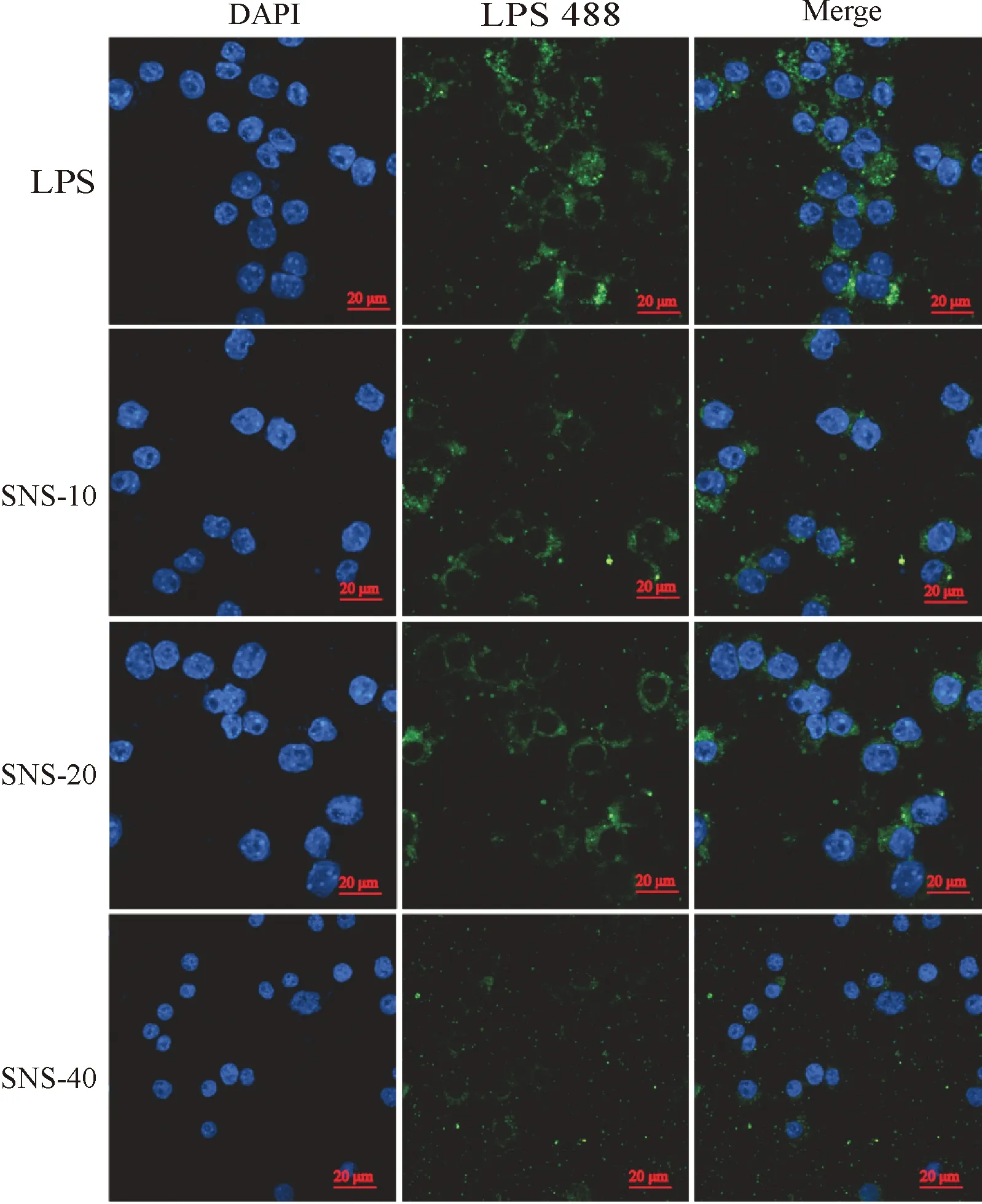
图6 SNS对LPS binding与细胞膜结合的作用
3 讨论
AS是心血管疾病的病理基础,是心血管疾病相关死亡的重要原因[5]. “中国心血管疾病报告”(2014年)显示,中国心血管疾病患病率持续上升; 2014年,中国有大约0.29亿心血管疾病患者,据报道每5个成年人中就有1人患有心血管疾病[6].因此,AS的有效预防和治疗对预防心血管疾病的发生具有重要意义.慢性炎症是AS的核心病理机制,血管的炎症与AS并发症的发生密切相关,目前用于治疗AS的大部分药物具有抗炎作用,包括一些非特异性抗感染药,磷脂酶抑制剂,抗白三烯药物等[7].据文献报道,巨噬细胞是AS发生发展中的一个关键因素,巨噬细胞可分泌炎症细胞因子,促进AS斑块的病变,进一步导致斑块的破裂和血栓的形成[8].故抗感染治疗是一种治疗AS的主流手段,而Raw264.7细胞是研究AS的常用细胞模型[9],可在体外实验中用于探讨AS的药理学研究.丝裂原活化蛋白激酶(MAPKs)家族和核因子(NF-κB)信号传导途径可通过调节炎性细胞因子介导的炎症参与AS的形成[10].因此,通过调节炎症信号传导途径来预防和治疗AS可以被认为是控制炎症反应的新策略,并且通过稳定斑块有效地延迟斑块形成或防止斑块破裂.
既往研究表明四逆散可以干预实验性溃疡性结肠炎,机制可能与下调NF-κB活性从而阻断炎症反应相关[11].四逆散中含有柴胡、白芍、枳实、炙甘草,近年来对这几味中药的药理研究亦越来越深入,柴胡抗血小板聚集、镇痛、抗氧化[12],白芍抗炎、减轻变态反应[13],甘草抗炎、调节免疫[14],枳实抗肿瘤、调节脂质代谢、抗氧化[15],这些研究提示四逆散对炎症可能有着很好的调节作用,但目前尚未见四逆散对AS的作用报道.
在本研究使用LPS诱导Raw264.7巨噬细胞来构建AS体外炎症模型.研究结果表明,SNS可有效减轻LPS诱导的Raw264.7炎症反应,其作用机制可能与其抑制MAPKs/NF-κB通路磷酸化相关.MAPKs具有双重磷酸化的功能,在细胞凋亡、免疫反应、炎症应答等多个病理生理过程的调节中皆起到重要作用[16].本组Western-blot提示,LPS诱导Raw264.7细胞30 min后, MAPKs家族蛋白中的ERK, JNK, p38磷酸化水平上调,与既往报道一致[17].同时,MAPKs家族蛋白的磷酸化TNF-α等炎症因子的释放密切相关,TNF-α等炎症因子的释放反过来又可进一步促进MAPKs家族蛋白级联式磷酸化反应,最终诱导细胞产生大量的炎症因子,形成一个瀑布式的正反馈环路[18]. 此外,研究表明,NF-κB作为一种经典的转录因子,与细胞生存、分化、增殖、凋亡相关,同时可调控细胞的免疫反应,NF-κB的磷酸化促使TNF-α,IL-6,IL-1β等炎症细胞因子释放[19].从本研究的结果上看,四逆散可质量浓度依赖性阻止LPS与Raw264.7结合,进一步抑制LPS诱导的MAPKs和NF-κB磷酸化,最终导致炎症因子的分泌减少.故推测,四逆散可能具有抗AS作用,抑制MAPKs/NFκB的磷酸化可能是其潜在的作用机制.

