急性呼吸窘迫综合征小鼠肺组织MIP-2、IL-8 mRNA表达及支气管肺泡灌洗液中性粒细胞百分比观察
干瑶,范绍辉 ,陈艳琳,程海飞,王红嫚
(遵义医学院第五附属(珠海)医院,广东珠海 519100)
急性肺损伤(ALI)是由各种病因导致的急性弥漫性肺泡毛细血管损伤的一种临床综合征,是呼吸系统危重症之一,其发病率和病死率均较高,急性呼吸窘迫综合征(ARDS)是该病的严重阶段。2012年ARDS新的诊断标准(柏林定义)中取消了ALI命名,将ARDS的氧合状态涵盖ALI的范畴。有研究[1]表明,大部分ALI患者在住院2~5 d发生。目前,临床治疗ARDS的常规措施是治疗原发病、机械通气和对症支持治疗。虽有研究发现神经肌肉阻滞剂、糖皮质激素、他汀药物及基因与间充质干细胞治疗等对改善ARDS病情有帮助[2],但仍未得到广泛认可。由于ARDS病因多样、发病机制复杂,尚无特效药物治疗该病,所以探索针对ARDS的特异性药物显得尤为重要。失控的炎症反应是现今公认的ARDS发病机制,中性粒细胞(PMNs)是ARDS主要效应细胞,在炎症反应中PMNs首先被招募到炎症部位,参与抵御病原微生物[3],而过量PMNs被激活、迁移、聚集到肺泡腔和肺间质是ARDS发生发展的关键,且PMNs数量与病情严重程度呈正相关[4]。PMNs从血管转移到炎症部位要经历滚动、黏附、趋化等过程,而趋化作用显得尤为重要[5]。巨噬细胞炎症蛋白-2(MIP-2)和白介素-8(IL-8)属于趋化因子成员,与PMNs募集到炎症部位密切相关。本研究观察了ARDS小鼠肺组织MIP-2、IL-8 mRNA表达及支气管肺泡灌洗液(BALF)中PMNs百分比,现将结果报告如下。
1 材料与方法
1.1 实验动物及主要试剂 健康C57BL/6小鼠64只,周龄8~10周,体质量18~22 g,购于广东省医学实验动物中心。脂多糖[6,7]购于美国Sigma公司,TRIzol购于美国Invitrogen公司,SYBR®Premix Ex TaqTM(Tli RNaseH Plus)和Reverse Transcriptase M-MLV(RNase H-)购于日本TaKaTa公司。
1.2 实验动物分组、ARDS模型制备及肺组织取材 将64只C57BL/6小鼠随机分为观察组40只和对照组24只。观察组小鼠经鼻滴入50 μL脂多糖(20 mg/mL),对照组滴入等量PBS溶液。通过观察小鼠一般情况、肺组织病理损伤、肺湿/干(W/D)重比值来判断肺损伤程度、肺水肿情况。观察组造模后12、24、48、72 h各取10只小鼠,对照组上述时点各取6只小鼠,经异氟烷(100 mg/kg)吸入麻醉,取肺组织。
1.3 肺组织MIP-2、IL-8 mRNA检测 采用qPCR法。采用TRIzol法提取RNA,取50~100 mg肺组织加入1 mL的TRIzol试剂在冰上研磨,提取总RNA;微量分光光度计测定OD值,OD260/OD280值在1.8~2.0,为所需RNA纯度,再将RNA反转录为cDNA;qPCR检测4个时间点各样本MIP-2、IL-8 mRNA,反应条件: 95 ℃、30 s,95 ℃、5 s,60 ℃、34 s,72 ℃、30 s,总共40个循环。以GAPDH为内参,每组设置3个复孔,重复3次,反应结束后,分析各基因实时扩增曲线和溶解曲线,获得各样本的循环阈值(Ct),采用2-ΔΔCt相对定量法计算结果。用PRIMER5软件/NCBI在线设计MIP-2特异性引物,上游引物5′-GCTGTCCCTCAACGGAAGAA-3′,下游引物5′-CAGGTACGATCCAGGCTTCC-3′,扩增片段为72 bp;IL-8特异性引物,上游引物5′-GGGTGGGGAGTTCGTGTAGA-3′,下游引物5′-CTACTACACAGGGATCAGGGC-3′,扩增片段为85 bp。
1.4 BALF中PMNs百分比测算 取1 mL生理盐水灌洗双侧肺组织,反复灌洗3次,每次回抽率达70%~80%。将收集的BALF用冰冻离心机以1 200 r/min的速度在4 ℃环境下离心10 min,弃上清液,吸取细胞沉渣涂于细胞计数板,瑞氏染色,光学显微镜下计数,分别计算出总白细胞数和总PMNs数,最后求出PMNs百分比。
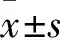
2 结果
2.1 两组不同时点肺组织MIP-2、IL-8 mRNA相对表达量比较 结果见表1。

表1 两组不同时点肺组织MIP-2、IL-8 mRNA相对表达量比较
注:与对照组比较,*P<0.05。
2.2 两组BALF中PMNs百分比比较 结果见表2。

表2 两组BALF中PMNs百分比比较
注:与对照组比较,*P<0.05。
3 讨论
ARDS是一种起病迅速,病情凶险疾病,其主要病理特征为肺微血管通透性增高,大量富含蛋白质液体和炎症细胞渗出到肺泡腔和间质聚集,肺泡壁逐渐增厚及肺微血管充血、出血[8]。ARDS病理生理表现为肺不张、肺顺应性降低及严重的通气/血流失衡,临床表现为顽固性低氧和呼吸窘迫。随着ARDS诊断标准和技术的不断完善,使临床上ARDS确诊率不断提高,但病死率仍居高不下。失控的炎症反应被认为是ARDS最有可能的发病机制,但当前仍缺乏有效治疗ARDS药物,而细胞、分子水平是现今研究ARDS机制热点。
趋化因子在炎症条件下可调节细胞的转移和活性,根据其分子结构不同分为CXC、CC、C、CX3C四个亚家族[9],其中CXC亚家族在内毒素诱导的ARDS中,将PMNs募集到肺组织扮演着重要的角色,尤其是成员CXCL2(MIP-2)和CXCL8(IL-8)[10,11]。MIP-2是一种强效的中性粒细胞趋化因子,在IL-1β、TNF-α等刺激下主要由巨噬细胞产生,它的产生能引发PMNs募集,促进炎症进一步发展[12]。在炎症反应中,MIP-2能激活PMNs增加其细胞表面黏附分子CD11b的表达[13],促进PMNs对血管内皮细胞黏附,利于PMNs从血管内渗出、聚集到炎症部位。MIP-2对PMNs作用受P38MAPK信号通路的调节,抑制P38MAPK可减弱MIP-2的作用[14]。有研究[15]发现,使用抗MIP-2抗体可以抑制CD11b表达和PMNs在肺内的聚集,减轻肺水肿。本研究显示,与对照组比较,观察组12、24、48、72 h的MIP-2 mRNA相对表达量增加。说明MIP-2在ARDS肺组织存在高表达,炎症早期即开始表达。
IL-8由多种炎症细胞分泌,是一种高选择性的促炎性趋化因子,在人类和动物中的各种炎症性疾病中均有升高[11],被认为是典型的中性粒细胞趋化因子[16],对PMNs具有趋化和激活作用。曾有研究认为,IL-8在ARDS中参与了至少70%PMNs趋化活动[17]。正常生理情况下,PMNs在循环系统中半衰期较短(6~8 h),细胞程序性凋亡可去除衰老细胞。有研究发现,PMNs凋亡在SIRS、脓毒血症和ARDS中有所减少,PMNs寿命延长会加重组织损伤[4]。因为PMNs凋亡有减轻炎症反应作用,故可能会对ARDS有抑制作用[4,18]。有研究发现,在ARDS患者BALF中可检测出抗-IL-8自身抗体,其与IL-8结合形成抗-IL-8:IL-8抗体复合物,该复合物有延长PMNs寿命作用,可能对PMNs凋亡有抑制作用[19],故IL-8不仅可以趋化、激活PMNs,还参与了抑制PMNs凋亡作用。本研究显示,与对照组比较,观察组12、24、48、72 h的IL-8 mRNA相对表达量增加。说明IL-8 mRNA在ARDS肺组织存在高表达,参与早期炎症反应。有研究[20]发现,在兔ARDS模型中使用人抗IL-8抗体后,可阻止PMNs在肺组织渗出浸润,改善ARDS疾病的临床症状。
PMNs是炎症反应重要组成部分,活化的PMNs在肺泡腔和肺间质中不断累积是导致ARDS早期的关键环节[21];消除PMNs可显着降低动物模型中急性肺损伤的严重程度[22]。本研究对小鼠鼻内缓慢滴入脂多糖溶液造成肺部直接损伤。进入机体的脂多糖与巨噬细胞细胞和内皮细胞等炎症细胞表面的Toll样受体4、CD14、髓样分化蛋白-2组成的复合物受体识别、结合,使下游的NF-κB和MAPK信号通路激活,导致IL-1β、TNF-α等炎症介质的释放[23]进而激活大量PMNs,使其在炎症部位渗出浸润,释放氧自由基、蛋白水解酶及多种炎症介质造成肺泡上皮细胞和肺毛细血管内皮细胞损伤,同时释放出的炎症介质再反过来作用于巨噬细胞、内皮细胞和PMNs等未激活的炎症细胞,最终形成一种瀑布式样的炎症反应,对机体造成广泛地致命性伤害。可见PMNs在ARDS疾病进展中的重要性。本研究显示,与对照组比较,观察组12、24、48、72 h的PMNs百分比增加。随着造模时间延长,PMNs百分比值与MIP-2和IL-8 mRNA表达水平呈同步增减的关系,PMNs的激活、肺内聚集可能受这两种趋化因子调节, 同时MIP-2和IL-8可能在维持炎症进展中起重要作用。
总之,MIP-2、IL-8在ARDS小鼠中存在高表达,在小鼠ARDS炎症早期即开始参与反应,可能对PMNs有趋化和激活作用,同时亦可能在维持炎症进展中起重要作用。有研究发现使用抗MIP-2和抗IL-8抗体可减少PMNs在肺组织中聚集,改善 ARDS病情。

