血清IL-6、SAA及PSA检测对前列腺癌的诊断价值
陶小枫,王晓希,刘 维,董建清,刘会静
(1唐山市人民医院泌尿外一科,唐山 063000;2唐山市人民医院骨软科;3唐山市人民医院儿科;4唐山市人民医院神经外科)
前列腺癌为泌尿系统最常见的恶性肿瘤之一,是男性癌症的第二大杀手[1],严重威胁着男性人群的生命健康。前列腺癌的发病率和死亡率,呈逐年上升的趋势[2,3]。PSA等肿瘤标记物由于其敏感度和特异度均不理想,单独检测难以作为前列腺癌可靠的一线诊断依据[4]。前列腺癌早期可无症状,出现症状就诊时约70%的前列腺癌患者已发生了远处转移,其中骨骼转移是最常见的转移部位。在前列腺癌患者中早期发现骨转移对于治疗方案的选择、预后的判断及并发症的预防均具有重要意义。近年来对炎性介质IL-6和SAA的研究发现,两者能有效预测肿瘤转移和评估肿瘤预后,有较好的临床应用前景。本研究对SAA、IL-6和PSA与TNM分期的关系进行研究,并分析它们之间的相关性,以探讨其对前列腺癌的诊断价值,报告如下。
1 资料与方法
1.1 一般资料
收集2016-01~2017-10在唐山市人民医院泌尿外科经病理确诊的前列腺癌患者54例,年龄45-87岁,平均年龄(67.5±4.9)岁;其中经放射性核素骨显像确诊的前列腺癌骨转移患者20例,年龄58-80岁,平均年龄(69.4±5.2)岁;前列腺癌无转移组34例,年龄56-82岁,平均年龄(68.1±5.4)岁。所有患者近期未行放化疗和手术治疗,未服用激素,并排除其他系统肿瘤史。另外选取经直肠指检或临床诊断为前列腺增生患者35例,年龄49-78岁,平均年龄(64.6±5.7)岁;并选取同期在本院健康体检的男性30例作为对照组,年龄42-82岁,平均年龄(62.4±6.7)岁,心、肝、肾和胰脏功能正常,无其他恶性肿瘤,所有研究病例均排除慢性前列腺炎病史。
1.2 肿瘤分级和分期
前列腺癌54例,肿瘤分期依据2002年AJCC的TNM分期标准,其中Ⅰ、Ⅱ期、Ⅲ期和Ⅳ期分别为15,20,19例。病理分级依据2003年WHO前列腺癌病理组织学分类Gleason评分标准,病理分级按照Gleason评分标准2-4分为高分化癌共12例,5-7分为中分化癌共25例,8-10分为低分化癌共17例。本研究得到医院伦理委员会批准,所有对象均知情同意。
1.3 仪器和试剂
采用美国贝克曼DXI800化学发光仪测定PSA的含量,原装配套试剂,严格按照说明书操作。采用ELISA法测定SAA、IL-6的含量,试剂为上海复兴公司提供。酶标仪为美国Thermo公司生产。
1.4 方法
取所有受检者术前晨起空腹静脉血3 ml于有分离胶的试管中,混合5-10 min后,3 000 r/min离心15 min左右,尽快分离血浆与血清。血清采用美国Thermo全自动酶标仪用ELISA法测定SAA、IL-6的含量,试剂由上海圆创生物技术有限公司提供,具体操作严格按说明书进行。用化学发光法测定PSA的含量,仪器为美国贝克曼DXI800化学发光分析仪,配套贝克曼原装试剂。
1.5 统计学处理

2 结果
2.1 各组受试对象年龄的比较
前列腺癌骨转移组、前列腺癌无转移组、前列腺增生组、健康对照组四组间年龄的比较采用方差分析,各组间差异无统计学意义(F=1.087,P>0.05,见表1)。
表1各组受试对象年龄的比较
Table1Comparisonofagesofsubjectsamongdifferentgroups

组别n年龄(岁)年龄范围(岁)前列腺癌骨转移组2069.4±5.258-80前列腺癌无转移组3468.1±5.456-82前列腺增生组3064.6±5.749-78正常对照组3062.4±6.742-82
2.2 前列腺癌患者与正常对照SAA、PSA、IL-6的水平比较
由表2可以看出,前列腺癌组SAA、PSA、IL-6水平显著高于前列腺增生组和正常对照组,差异有统计学意义(P<0.05)。前列腺增生组SAA、PSA、IL-6水平均高于正常对照组,差异有统计学意义(P<0.05)。
2.3 前列腺癌不同临床分期的SAA、PSA、IL-6的水平比较
前列腺癌组SAA、PSA、IL-6水平随着临床分期的升高而递增,各期之间两两比较,PSA水平在Ⅱ期与I期之间差异无统计学意义(P=0.85),PSA水平在Ⅲ、Ⅳ期的水平显著高于Ⅱ期和I期,差异有统计学意义(P<0.05);SAA、IL-6的水平随着前列腺癌分期程度的增加而增加,差异均有统计学意义(P<0.05,见表3)。
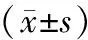


分组nPSA(ng/ml)SAA(mg/L)IL-6(pg/ml)前列腺癌组5425.8±12.7∗#32.1±17.4∗#138.5±48.9∗#前列腺增生组3512.6±7.3∗ 6.4±3.9∗114.6±35.4∗正常对照组30 1.8±1.2 4.2±2.6101.8±26.7 F2.65 4.02 4.53 P0.0340.0280.022
与对照组比较,*P<0.05;与前列腺增生组比较,#P<0.05
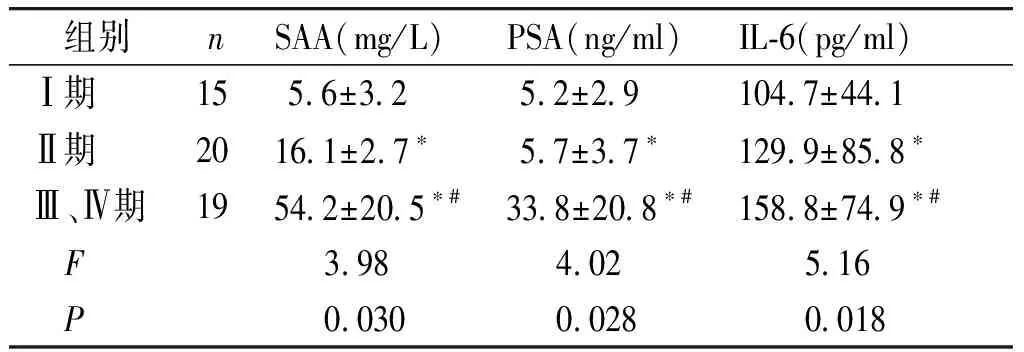
组别nSAA(mg/L)PSA(ng/ml)IL-6(pg/ml)Ⅰ期15 5.6±3.2 5.2±2.9104.7±44.1Ⅱ期2016.1±2.7∗ 5.7±3.7∗129.9±85.8∗Ⅲ、Ⅳ期1954.2±20.5∗#33.8±20.8∗#158.8±74.9∗# F3.98 4.02 5.16 P0.0300.0280.018
与Ⅰ期比较,*P<0.05;与Ⅱ期比较,#P<0.05
2.4 前列腺癌不同病理分级的SAA、PSA、IL-6的水平比较
表4显示,随着前列腺癌分化程度的降低,SAA、PSA、IL-6的水平呈现增高趋势,各分级之间两两比较,SAA、PSA、IL-6在各级之间差异均有统计学意义(P<0.05),三者与病理分级呈负相关。
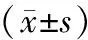
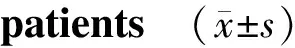
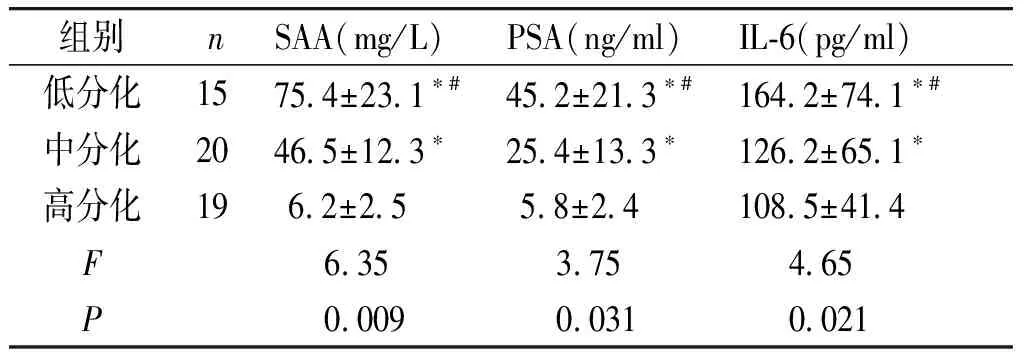
组别nSAA(mg/L)PSA(ng/ml)IL-6(pg/ml)低分化1575.4±23.1∗#45.2±21.3∗#164.2±74.1∗#中分化2046.5±12.3∗25.4±13.3∗126.2±65.1∗高分化19 6.2±2.5 5.8±2.4108.5±41.4F6.35 3.75 4.65 P0.0090.0310.021
与高分化组比较,*P<0.05;与中分化组比较,#P<0.05
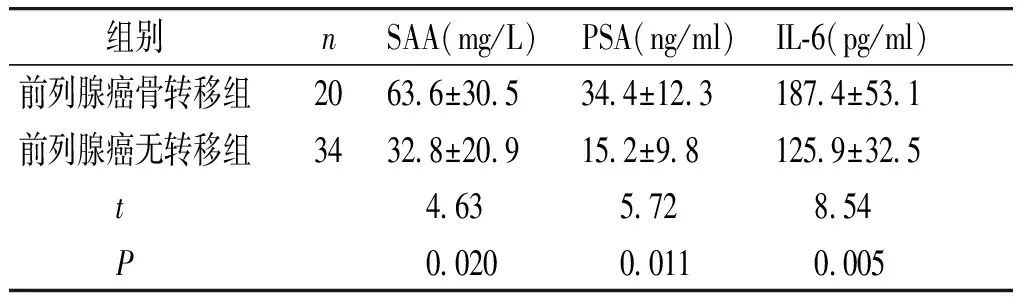
2.5 前列腺癌骨转移组与不伴转移组SAA、PSA、IL-6的水平变化
前列腺癌骨转移组SAA、PSA、IL-6水平均比无骨转移组显著升高,差异有统计学意义(P<0.05,见表5)。
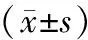
组别nSAA(mg/L)PSA(ng/ml)IL-6(pg/ml)前列腺癌骨转移组2063.6±30.534.4±12.3187.4±53.1前列腺癌无转移组3432.8±20.915.2±9.8125.9±32.5 t4.63 5.72 8.54 P0.0200.0110.005
2.6 SAA、IL-6、PSA诊断前列腺癌的ROC曲线分析
图4和表6显示,PSA在ROC曲线下面积为0.700,SAA检测在ROC曲线下面积为0.821,IL-6检测在ROC曲线下面积为0.747,PSA+IL-6+SAA三者联合检测在ROC曲线下面积为0.958。PSA+IL-6+SAA联合检测诊断价值最高,高于PSA、IL-6、SAA两两联合检测。
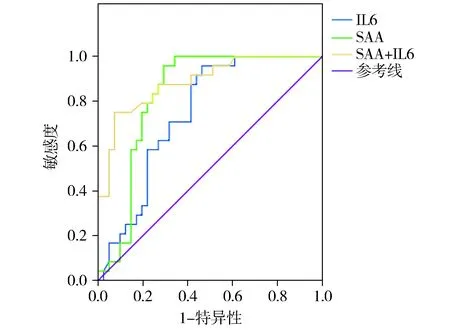
图1 SAA和IL-6联合检测前列腺癌的ROC曲线分析Figure 1 ROC curves of SAA, IL-6 and their combination in detection for prostate cancer
2.7 SAA、PSA和IL-6的相关性分析
前列腺癌组血清SAA水平与IL-6浓度呈正相关,SAA与PSA呈正相关(r=0.69,P=0.025;r=0.45,P=0.037)。IL-6水平与PSA无线性关系(r=1.56,P=0.136)。
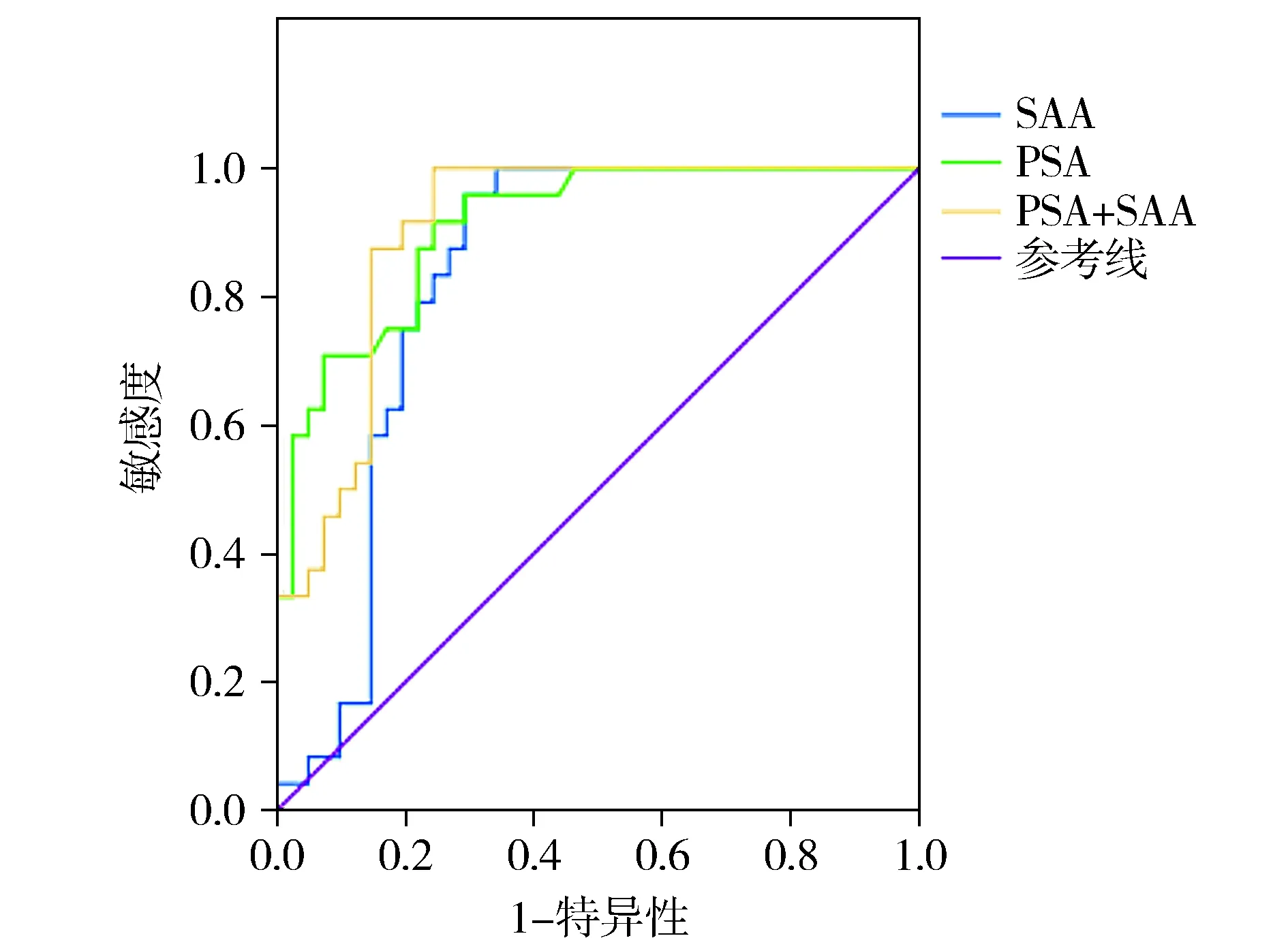
图2 SAA和PSA联合检测前列腺癌的ROC曲线分析Figure 2 ROC curves of combined SAA and PSA in detection of prostate cancer
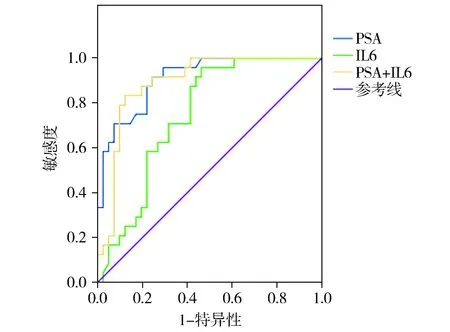
图3 IL-6和PSA联合检测前列腺癌的ROC曲线分析Figure 3 ROC curves of IL-6 and PSA in detection of prostate cancer

图4 三者联合检测前列腺癌的ROC曲线分析Figure 4 ROC curves of SAA,IL-6 and PSA combined detection for prostate cancer
表6前列腺癌SAA、IL-6、PSA联合检测的ROC曲线分析
Table6TheresultsofROCcurvesofcombineddetectionofSAA,IL-6andPSAforprostatecancer
3 讨论
前列腺癌是常见的男性泌尿生殖系统恶性肿瘤。肿瘤的发生、发展是多种因素参与、多步骤的复杂过程。PSA用于筛查前列腺癌已应用多年,但PSA是前列腺特异性抗原,而不是前列腺癌的特异性抗原,一些非肿瘤患者如前列腺增生患者也可增高[5,6],其检测前列腺癌的敏感度和特异度较差。本研究中,PSA诊断前列腺癌的ROC曲线表明敏感度为64.2%,特异性62.1%。前列腺癌发病隐匿,进展缓慢,早期可无症状,出现症状就诊时大部分就已出现转移,其中以骨转移多见。前列腺癌导致的骨转移常表现为溶骨性或成骨性病变[7]。越来越多证据表明,肿瘤的发生和炎症关系密切,炎症的存在可以促进肿瘤的发生发展[8]。SAA是在IL-1、IL-6及TNF的诱导下由肝脏合成的蛋白质,参与了多种恶性肿瘤发生发展[9]。SAA在炎症发生和发展的过程中被认为是早期的生物标志物。研究表明,SAA的浓度和肿瘤的阶段密切相关,这说明SAA可以作为一种监测癌症进程以及癌症种类的生物标志物[10]。SAA在正常人血清中含量很低,在多数癌症中会升高。本研究表明,前列腺癌患者的SAA水平显著高于前列腺增生患者和正常对照组的水平,提示SAA水平在鉴别前列腺良、恶性疾病具有一定的参考价值。有专家研究指出SAA在多种恶性肿瘤患者中显著增高,且晚期肿瘤的SAA水平明显高于早期肿瘤的水平[11]。本研究表明SAA随着临床分期的升高而递增,也证明了这一点。
IL-6是调节机体损伤和炎症反应的重要淋巴因子,当机体发生炎症时,血清中的含量会迅速升高[12]。在肿瘤发生损伤、坏死或者炎症时,IL-6的水平也会升高。因此,IL-6的血清值可以作为早期诊断肿瘤炎症反应程度的一个指标,研究证实,前列腺癌细胞能够分泌IL-6,IL-6在前列腺癌患者血清中的表达水平明显升高,在前列腺癌伴骨转移患者血清中的表达水平比未发生转移者高[13]。本研究也显示,IL-6在前列腺癌组显著高于前列腺增生组和对照组,且前列腺癌骨转移组高于无转移组,随着疾病的进展,IL-6有逐渐增高的趋势,也印证了前人研究成果。同时,IL-6可刺激肝脏生成SAA,进而导致SAA的升高,二者呈正相关。本研究还表明,IL-6、SAA与前列腺癌的病程、病情相关,病情越严重,IL-6、SAA水平越高,炎性反应程度越高,肿瘤越容易发生转移。
本研究对前列腺癌的诊断中,以PSA+IL-6+SAA联合检测具有较高的敏感度和特异性,分别为96.4%,93.8%,高于单一项目检测。
综上所述,SAA、IL-6是前列腺癌早期诊断的较好标志物,可用于前列腺癌的辅助诊断和预后判断,可以避免过度诊断。监测前列腺癌患者外周血的PSA、IL-6、SAA变化可早期预测前列腺癌分期,并可早期发现骨转移,对于病情评估、病程监测,预防转移和复发有非常重要的价值,在延长生存时间和提高生活质量方面也有很高的应用价值。

