茶用菊品种金丝皇菊对盐胁迫的响应
,,,,
(河南农业大学 林学院,河南 郑州 450002)
盐胁迫严重影响植物生长发育过程中的各个代谢路径,导致细胞膜结构被破坏、植物抗氧化系统失去平衡、植物光合作用和呼吸作用受到抑制,植物的新陈代谢发生紊乱[1]。光系统对逆境胁迫非常敏感,研究发现,盐胁迫对植物光合作用具有抑制作用,并随着盐浓度和胁迫时间的增加,抑制作用更加明显,盐胁迫下植物的PSⅡ反应中心活性受到影响[2]。WANG等[3]发现盐敏感品种水稻的光抑制作用比非敏感品种明显。BRUNING等[2]认为,盐胁迫会抑制PSⅡ的反应,最大光化学效率(Fv/Fm)、光化学猝灭系数(qP)呈下降趋势,非光化学猝灭系数(NPQ)呈上升趋势,而且NPQ比qP的反应更加敏感。盐胁迫下,光合过程的电子传递和光合速率受到抑制,植株内活性氧大量积累,活性氧清除系统通过清除植物体内的氧自由基、过氧化氢等活性氧,减少活性氧的积累,增强植物的抗盐性。植物产生大量活性氧,抗氧化酶活性增加,减少活性氧积累,提升植物的抗盐性[4]。超氧化物歧化酶(SOD)是植物体内抗氧化酶防御体系中的首道防护线,盐胁迫下,SOD能够与其他抗氧化酶共同抵抗外界逆境胁迫[5]。盐胁迫下,大量的活性氧导致膜脂过氧化,丙二醛(MDA)大量聚集。植物可以通过细胞膜吸收无机盐离子维持细胞渗透势[6-7],也可以通过合成可溶性糖、蛋白质以及氨基酸等保持细胞内水分和细胞完整性[8-9],从而提高抗盐性。
脂肪酸各组分的比例能够影响膜的稳定性。目前针对植物脂肪酸的研究主要集中在温度胁迫方面,有关盐胁迫的报道相对较少[10]。有研究发现,盐胁迫致使小麦根系膜脂不饱和指数下降[11],不饱和脂肪酸可提升光合作用的耐盐性和受损后的修复能力,同时减少逆境胁迫下活性氧伤害[12]。脂肪酸去饱和酶基因在不饱和脂肪酸的合成中具有重要的调控作用,此类酶主要有脂酰-ACP(Acyl-ACP)去饱和酶和脂酰-酯(Acyl-lipid)去饱和酶两大类。Acyl-ACP去饱和酶(Stearoyl-ACP desaturase,SAD)能够对饱和脂肪酸起到催化作用,最终产生单不饱和脂肪酸。此前已有学者从不同植物里克隆出了Acyl-ACP去饱和酶基因[13]。Acyl-ACP去饱和酶包含了ω-6和ω-3两种酶,通过催化作用与甘油结合的脂肪酸产生双键,调节膜脂不饱和度。CmFAD2基因是影响ω-6脂肪酸去饱和酶催化途径的关键基因,ω-3脂肪酸去饱和酶基因包含FAD3、FAD7和FAD8三大类基因。现已经从许多植物中克隆得到ω-6和ω-3基因,相关转基因和表达模式的研究也有较多报道。在对烟草的研究中发现,过量表达ω-3基因引起耐盐性有所增强[14]。
菊花(Chrysanthemunmorifolium)有着悠久的栽培历史,茶用菊是以茶用为主的菊花种类,具有较高的观赏和经济价值。目前茶用菊与农作物之间的栽培用地之争愈发严重,研究茶用菊的抗盐性机制,可以有效地筛选抗盐性品种,为盐渍化土地的茶用菊生产提供新思路[15]。目前菊类植物的盐胁迫探究主要集中在菊芋、药用菊、野菊以及菊花近缘属种[16],有关盐胁迫下茶用菊的脂肪酸组分变化及抗性机制需要深入探讨。前期针对菊花脂肪酸含量及脂肪酸去饱和酶基因表达开展了基础性研究工作[17-19],本试验以茶用菊品种金丝皇菊作为研究对象,通过对NaCl胁迫下其叶片光合特性、抗氧化酶活性与脂肪酸含量,以及3种脂肪酸去饱和酶基因表达量进行测定,分析茶用菊盐胁迫下的生理响应,为阐明茶用菊的相关抗性机制提供理论基础,为盐渍化土地茶用菊的生产提供理论参考。
1 材料和方法
1.1 材料培养和处理
供试材料为茶用菊品种金丝皇菊,选取生长健壮均匀的植株,盆栽基质配比为V(草炭)∶V(蛭石)∶V(珍珠岩)=1∶1∶1,每盆栽种1株。待株高为(25±2)cm,叶片数为(15±1)时,开始进行试验处理。
试验共设4个NaCl浓度梯度:0[以清水为对照(CK)]、50、100、200 mmol/L,为避免过高浓度的盐溶液带来冲击效应,NaCl胁迫采取渐进式(对照组除外),NaCl胁迫浓度以每日50 mmol/L的浓度增加,在同一时间达到不同浓度[15]。达到设定浓度当天为胁迫0 d,在处理的0、3、6、9 d选取植物上部第4~6片完全展开叶完成多个指标的测定,每组重复3次,每重复3盆。
1.2 测定指标和方法
1.2.1 生理指标的测定 叶绿素含量采用乙醇提取法和分光光度计测定,MDA含量用硫代巴比妥酸反应法测定,SOD活性采用氮蓝四唑(NBT)显色法测定,过氧化物酶(POD)活性采用愈创木酚法测定,可溶性糖含量采用蒽酮比色法测定,可溶性蛋白含量采用Bradford法测定,游离脯氨酸含量采用磺基水杨酸法测定[20-21]。
1.2.2 叶绿素荧光参数的测定 在取样当天8:00—10:00采用荧光成像仪Fluor Cam对各处理下受光相同的第4~6片完全展开叶进行测定。检测时将整株菊花放入暗室中暗反应20 min,然后检测每片叶的最小初始荧光(Fo)、最大荧光(Fm)、qP和NPQ。
1.2.3 叶片中脂肪酸组分的测定 脂肪酸组分参照李永华等[17]使用外标法进行测定。新鲜叶片于105 ℃杀青5 min,之后50 ℃烘干。称量样品0.2 g,加入100 mL磨口锥形瓶里,加入10%(V/V)硫酸甲醇溶液10 mL,70 ℃水浴中放置30 min。转移到分液漏斗中,加入20 mL蒸馏水,用正己烷5 mL进行萃取,重复3次,加一定量的无水硫酸钠进行干燥,过滤膜作为气相样品,运用DB-WAXFTLP柱进行气相检测(岛津气相)。
测定过程:氮气作为载气,流动速度1 mL/min,柱温140 ℃,维持2 min,然后以每分钟5 ℃提升温度至200 ℃,持续1 min,随后以每分钟5 ℃提升温度至220 ℃,持续20 min,将样品与脂肪酸标品(Nu-CheckPrep,Elysian,MN,USA)反应进行对比,样品进样温度225 ℃,检测器温度275 ℃。
1.2.4 脂肪酸去饱和酶基因表达量的测定 使用CTAB改良方法得到总RNA,运用电泳和分光光度仪检测RNA的质量。选取高质量样品,使用大连宝生物有限公司(TaKaRa)生产的反转录试剂盒(Prime Script TM RT reagent Kit with gDNA Erser)进行反转录合成cDNA。实验室前期研究表明,CmSAD、CmFAD2以及CmFAD7是调控同一途径上的3种脂肪酸去饱和酶基因,且这3种脂肪酸去饱和酶所调控的反应是连续的。本研究根据实验室得到的基因序列,运用Primer Premier 5.0确定实时PCR引物,具体的序列如下:
SAD-F1:5′-TCTGCCAACCTACCAAAC-3′
SAD-R1:5′-TGTCTTCTGAATCTGCCTC-3′
FAD7-F1:5′-AAACCATCAGCTTTGCGGTC-3′
FAD7-R1:5′-CGCAGCTCGAATATCAGCCA-3′
FAD2-F1:5′-TACTTCCTCGCAAACAC-3′
FAD2-R1:5′-TGACCAATGACCCATAA-3′
18S-rRNA-F1:5′-CTCATGGGATGTGGCTTCTT-3′
18S-rRNA-R1:5′-GCGTTCAAAAACTCGATGGT-3′
qRT-PCR操作参照张华奥等[22]的方法进行。
1.3 数据处理
数据分析采用Microsoft Excel进行数据录入和作图,应用SPSS 24软件进行方差和相关性分析。
2 结果与分析
2.1 盐胁迫对菊花叶片叶绿素荧光参数的影响
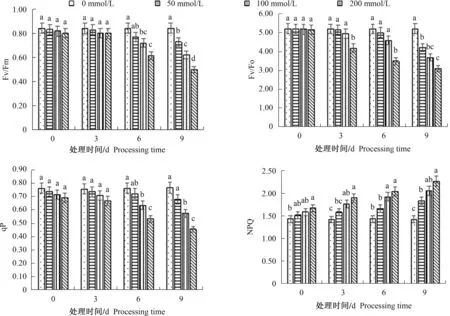
如图1所示,与对照组相比,随着盐处理时间的推移,Fv/Fo、Fv/Fm和qP均有不同程度的降低。处理6 d以后,50、100、200 mmol/L处理组的Fv/Fo、Fv/Fm和qP与对照组均呈现显著差异,处理9 d时,各处理组Fv/Fo较对照组分别下降19.0%、29.5%和40.7%,Fv/Fm较对照组分别下降13.2%、26.0%和40.3%,qP较对照组分别下降11.0%、24.9%和40.4%;NPQ随着处理时间的增加开始上升,同时处理浓度越大相应的上升幅度越大,各处理组在9 d时达到峰值,较对照组分别增加28.6%、44.0%和58.4%。
植物光系统对盐逆境胁迫最敏感。盐胁迫下菊花的光系统受到影响,NPQ呈现上升的趋势,菊花的PSⅡ功能已经受到影响。菊花通过提高热散耗能力、减少激发能的产生保护自身光合系统不受损,提高抵御盐胁迫的能力。盐胁迫下,植物光合过程中电子传递和光合速率受到抑制,植株内活性氧大量积累,各种抗氧化酶活性发生变化。
2.2 盐胁迫对菊花叶片抗氧化酶活性和MDA含量的影响
如图2所示,与对照组相比,盐处理后POD和CAT活性提高;处理9 d时,50、100、200 mmol/L处理组中POD活性较对照组分别增长94.6%、121.1%和258.9%,CAT活性较对照组分别增长88.0%、93.9%和137.6%。不同处理下SOD活性表现具有差异性,50 mmol/L和100 mmol/L处理组中,SOD活性明显增大;200 mmol/L 处理组中SOD活性先上升后下降。各处理组菊花叶片MDA含量不断上升,处理9 d时,各处理组较对照组分别增长了17.8%、58.5%、73.0%。可见,菊花可以通过提高叶片内抗氧化酶的活性来适应外界的盐胁迫环境,当盐浓度过高时,膜脂过氧化产物MDA开始大量聚集,并表现显著性提高。
同一时间下不同小写字母表示处理间差异显著(P<0.05),下同
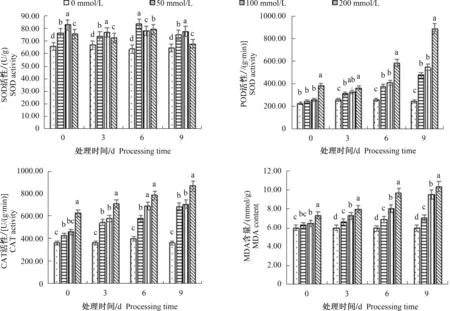
图2 NaCl胁迫对菊花叶片抗氧化酶和MDA含量的影响Fig.2 Effects of NaCl stress on the contents of antioxidant enzymes and malondialdehyde in chrysanthemum leaves
2.3 盐胁迫对菊花叶片可溶性物质及叶绿素含量的影响
由图3A可知,随着处理时间的增加,50 mmol/L处理组中可溶性糖含量不断增加;100 mmol/L处理组先增加然后减少,处理6 d时较对照组增加115.3%,此时处于峰值,然后开始降低;200 mmol/L处理组呈不断下降的趋势,处理9 d时较对照组下降46.4%;图3B中,可溶性蛋白含量在50、200 mmol/L处理组中先增加后减小,3 d时达到峰值,9 d时达到最低点,较对照组分别下降30.0%和48.9%;在100 mmol/L处理组中不断下降,处理9 d时较对照组下降37.7%;由图3C可知,50、100、200 mmol/L处理组中,脯氨酸含量不断上升,处理9 d时,较对照组分别上升60.3%、73.9%和123.9%。由图3D可知,处理0~6 d内,100 mmol/L处理组中叶绿素含量先下降后上升,6 d时叶绿素含量较对照组增加13.5%,9 d时叶绿素含量开始出现下降趋势。
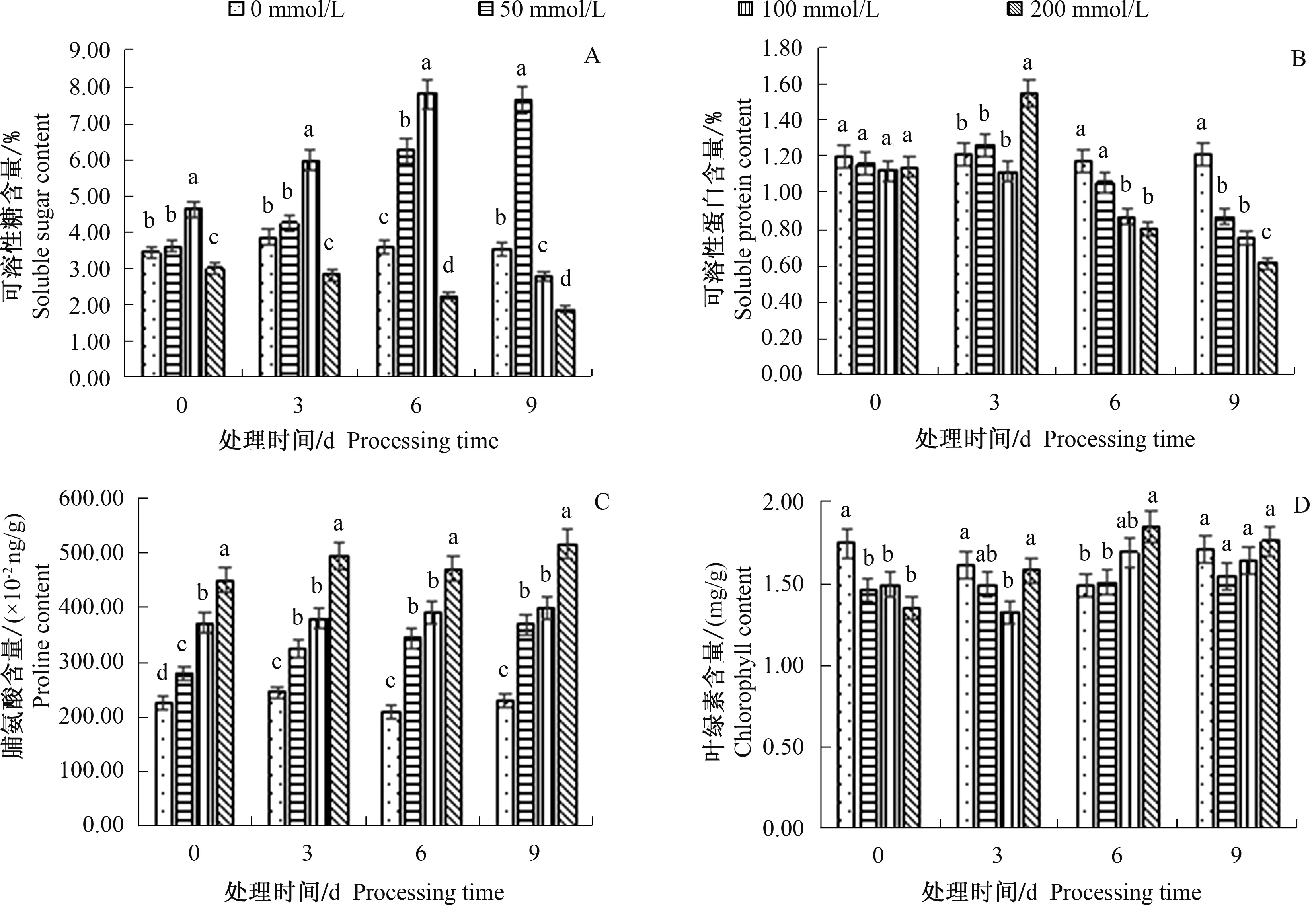
图3 NaCl胁迫对菊花叶片可溶性物质和叶绿素含量的影响Fig.3 Effects of NaCl stress on the contents of soluble matter and chlorophyll in chrysanthemum leaves
2.4 盐胁迫对菊花叶片脂肪酸的影响
如表1所示,随着处理时间的增加,处理组中棕榈酸和硬脂酸含量逐渐下降;50、100 mmol/L处理组中亚麻酸和亚油酸含量不断增加,处理9 d时,亚麻酸含量较对照组分别增长4.5%和25.6%,亚油酸含量分别增长21.7%和39.5%;50 mmol/L处理组中的油酸含量升高,6 d后趋于平稳;100 mmol/L处理组中的油酸含量不断增加,9 d时较对照组增加26.4%;200 mmol/L处理组中的油酸、亚油酸和亚麻酸3种物质的水平变化基本一致,均呈现先升高后降低的趋势。
如图4所示,随着处理时间的增加,处理组中饱和脂肪酸含量不断下降;50、100 mmol/L处理组中不饱和脂肪酸含量不断增加,9 d时,较对照组分别上升12.4%和31.4%;200 mmol/L处理组中不饱和脂肪酸先增加后减少,3 d时达到最大值,增幅为23.6%,9 d时下降18.3%。100 mmol/L和200 mmol/L处理组中不饱和脂肪酸与饱和脂肪酸的比率(USFA/SFA)逐渐增大,9 d时较对照组分别增长202.7%和195.9%;脂肪酸不饱和指数(IUFA)也呈现出不断升高的趋势,200 mmol/L处理组中IUFA先升高后降低,处理3 d时上升22.9%,达到峰值,随后开始下降,9 d时较对照组下降16.4%。
以上结果说明低浓度盐处理下,植物脂肪酸进行适应性调整,调节脂肪酸组分,增加不饱和脂肪酸的含量,增强细胞膜体系的稳定性。盐浓度过高时,受植物细胞内活性氧影响,不饱和脂肪酸被分解,细胞膜相发生改变。
2.5 盐胁迫对菊花叶片脂肪酸去饱和酶关键基因表达量的影响
在课题组前期研究基础上,选取CmSAD、CmFAD2以及CmFAD7三个脂肪酸去饱和酶关键基因进行分析。CmSAD在50 mmol/L和100 mmol/L处理组中的表达量不断上升,9 d时分别达到对照组的2.8倍和8.2倍;200 mmol/L处理组中CmSAD的表达量先增加后减小,处理6 d时最高,是对照组的5.7倍,随后开始降低(图5A)。处理0 d时,CmFAD2的表达量随着处理浓度的增加逐渐降低。随着处理时间的延长,50 mmol/L和100 mmol/L处理组中基因表达量逐渐上升,处理9 d时分别达到对照组的1.3倍和1.9倍;200 mmol/L处理组中,3 d时数值最大,与对照组比较,是其1.4倍,6 d时表达量出现骤降,9 d时几乎不表达(图5B)。CmFAD7在50 mmol/L处理组中表达量不断升高,9 d时是对照组的5.6倍;100 mmol/L和200 mmol/L处理组中的表达量均先升高后降低,100 mmol/L处理组在6 d达到峰值,是对照组的7.2倍,随后开始降低,处理9 d时表达量只有对照组的59.0%;200 mmol/L处理组在3 d数值最高,是对照组的6.1倍,随后开始下降,处理9 d时几乎不表达(图5C)。

表1 NaCl胁迫下菊花叶片脂肪酸组分及含量Tab.1 Fatty acid components in chrysanthemum leaves under NaCl stress %
注:同一时间下不同小写字母表示处理间差异显著(P<0.05);* 为同一浓度处理组下该类脂肪酸最大含量,**为同一浓度处理组下该类脂肪酸最低含量。
Note:There were significant differences between different lowercase letters at the same time(P<0.05);*represents the maximum content of such fatty acids in the same concentration treatment group,** represents the lowest content of such fatty acids in the same concentration treatment group.

图4 NaCl胁迫对菊花叶片脂肪酸含量的影响Fig.4 Effects of NaCl stress on the content of fatty acids in chrysanthemum leaves
结合脂肪酸组分变化分析可知,50、100 mmol/L处理组的基因表达量与叶片中不饱和脂肪酸含量变化均呈现先上升后下降的趋势,200 mmol/L处理组中CmFAD7的表达量与不饱和脂肪酸含量同时在6 d时下降,CmFAD2表达量的下降则出现在9 d时,较不饱和脂肪酸含量的下降有滞后性。

图5 NaCl胁迫对菊花叶片脂肪酸去饱和酶基因表达量的影响Fig.5 Effects of NaCl stress on expression of fatty acid desaturase gene in chrysanthemum leaves
3 结论与讨论
本试验结果表明,盐胁迫下,菊花叶片的qP、Fv/Fm和Fv/Fo不断减小,NPQ不断增大。盐胁迫下菊花PSⅡ反应中心活性受到抑制,通过提高热散耗能力、减少激发能产生以保护自身光合中心,提高自身抵御盐胁迫的能力。在不同植物的试验中均发现盐胁迫下Fv/Fm、Fv/Fo降低,PSⅡ中心活性受到影响[23-24],与本试验结果相似。
盐浓度较低时,SOD、CAT、POD活性逐渐上升,高浓度下,SOD活性减小,MDA开始积累,此时植物的活性氧清除力开始下降。在胁迫浓度阈值内,活性氧清除系统能够迅速反应,对菊花的各种代谢机构产生一定的保护作用,超出胁迫浓度阈值后,活性氧聚集,膜脂过氧化严重,MDA大量积累,对各种代谢机构产生影响。在盐胁迫下,菊花叶中的可溶性糖、蛋白质和脯氨酸含量增大,用以增强植物细胞的保水能力;超出了菊花自身耐受能力后,细胞膜结构受损严重,可溶性糖、蛋白质和脯氨酸的合成能力受到影响,含量开始降低,细胞失水。AHMED等[25]在对橄榄树幼苗的研究中指出,脯氨酸可以提高抗氧化酶活性,这一关系在菊花中有待进一步验证。
本课题组前期试验表明,菊花叶片总膜脂脂肪酸中棕榈酸、硬脂酸、油酸、亚油酸、亚麻酸5种占有率在95%以上[17]。随着处理时间的增加,低浓度盐处理下不饱和脂肪酸含量逐渐增加,膜的流动性得以保持;当胁迫浓度和时间超出菊花的耐受力时,不饱和脂肪酸含量减少,膜相发生改变。脂肪酸的去饱和途径是不饱和脂肪酸合成的一个重要环节,CmSAD、CmFAD2、CmFAD7是不饱和脂肪酸合成中关键的限速酶基因。低浓度盐处理下,不饱和脂肪酸以及CmSAD、CmFAD2、CmFAD7三个基因的表达量均呈现不断上升的趋势;高浓度下,基因表达出现滞后性。这种滞后性可能是由于植物在盐胁迫下膜结构受到损伤,导致基因表达与转录受到影响,也可能是光抑制过程中过量的活性氧引起不饱和脂肪酸含量下降所致。
本试验结果表明,盐胁迫下金丝皇菊通过抗氧化酶、渗透调节物质的改变以及脂肪酸去饱和基因的表达,保护光合系统的正常运转,调节脂肪酸组分的变化以保护膜系统,提高自身抗盐性。当胁迫程度超过自身的调节能力时,光合机构受到损伤,PSⅡ光合效率下降,活性氧大量积累对膜结构造成不可逆的伤害,导致不饱和脂肪酸含量与去饱和酶基因表达量下降。此外,还发现在100 mmol/L盐胁迫处理中细胞内理化指标有明显变化,在后期试验中可以作为一个重要的参考指标。在接下来的研究中,将通过对比不同类型菊花的抗盐性,为盐碱地菊花种植提供科学依据。

