依维莫司在结节性硬化相关肾血管平滑肌脂肪瘤术前新辅助治疗中的应用(单中心5例报道)
郭刚 陈文政 张帆 张旭
1中国人民解放军总医院泌尿外科100853北京
结 节 性 硬 化(tuberous sclerosis complex,TSC)是一组常染色体显性遗传引发的复合性发育不良综合征。特征性临床表现为面部血管纤维瘤、癫痫、智力低下三联征,病变随年龄增长逐渐进展。此外可见皮肤、脑、肾、肝、肺、眼、骨及心脏等多发肿瘤性损害,合并肾脏损害者占48%~80%,主要表现为肾血管平滑肌脂肪瘤(angiomyolipoma,AML),也可有良性囊肿及肾细胞癌。该病的主要治疗办法包括:手术切除、栓塞及药物治疗[1-2]。近年来,国外学者应用mTOR抑制剂治疗该病取得良好的临床效果,并被国内外指南推荐为一线治疗选择。我们借鉴分子靶向药物在肾癌术前新辅助治疗中的应用经验[3],尝试应用依维莫司对经选择的TSC相关肾脏AML患者进行手术前的新辅助治疗,取得良好临床效果,现报告如下。
1 资料与方法
1.1 临床资料
2014年5月-2017年12月中国人民解放军总医院收治5例TSC合并肾AML患者,男1例,女4例,平均年龄35岁(27~50岁)。均符合2012版结节性硬化诊断标准[4],其中2例既往有癫痫发作史,2例有遗传史。所有患者均行磁共振和超声检查,均为双侧多发AML,肿瘤平均直径2.7 cm(1.2~12.5 cm),所有患者均只有1个瘤体直径超过4 cm(5.6~15.0 cm),其中左侧3例,右侧2例。2例患者曾因肿瘤破裂出血曾行高选择性肾血管栓塞,1例患者曾行肾部分切除术。术前常规评估均未见明确手术禁忌证。所有患者均行TSC1/2基因的高通量二代测序[5],其中4例患者存在致病性TSC2基因突变(图1)。患者基本信息见表1。
1.2 新辅助治疗及手术
5例患者术前均给予依维莫司10 mg口服Qd,连续服用3个月,分别于治疗后第1个月和第3个月行CT、血尿常规、血生化及胸片检查评价药物疗效及安全性。3个月治疗结束时进行术前全面评估,排除明确手术禁忌证。5例患者均在停用依维莫司7 d后接受手术治疗,均采用气管插管全身麻醉,健侧卧位,行经后腹腔镜肾部分切除术完整切除靶病灶,1例因肿瘤体积较大术中中转开放手术。
1.3 资料收集
药物治疗前所有患者均采用螺旋CT或者MRI测定肿瘤病灶,以肿瘤最大径线>4 cm作为靶病灶,其他病灶作为非靶病灶。疗效判定应用实体瘤评价标准(RECIST)[6]。不良反应评价按照《国立癌症研究所不良事件通用术语标准》(NCI CTCAR 3.0版2006年8月)进行分级[7]。收集所有患者的临床资料,治疗前后的影像学资料;药物治疗的剂量、时间、疗效及不良反应发生情况;手术时间、术中情况、术中出血量、术后引流量,围手术期并发症;术后病理学特征及后续治疗情况。

表1 患者基本临床信息
2 结果
本组5例患者术前接受依维莫司治疗时间均为3个月。依维莫司治疗1个月后,肿瘤体积平均缩小47.5%(40%~65%),最大肿瘤直径平均缩小2.45 cm(1.0~4.5 cm);用药3个月疗效评估,肿瘤体积平均缩小49.4%(41%~68%),最大肿瘤直径平均缩小2.74 cm(1.0~5.0 cm)(图2,3,4);主要不良反应包括:口腔黏膜炎4例,月经失调2例,泌尿系感染1例,均为1~2级,用药期间所有患者均未停药或减量,给予对症处理后均可缓解。术前停药1周,重新评估患者一般情况,排除手术禁忌证,4例患者在全麻下行腹腔镜左肾部分切除术,其中1例患者因瘤体较大中转开放,另有1例患者行机器人腹腔镜肾脏部分切除术,术中肿瘤局部轻度粘连,与既往未接受药物治疗患者无显著差异。平均手术时间106 min(80~130 min),平均热缺血时间28 min(20~40 min),平均术中出血量144 mL(50~400 mL),均未给予输血,术后平均住院6.5 d(5~7 d),所有患者均痊愈出院,术后病理结果:4例为肾AML,1例为肾脏上皮样AML。术后平均随访20.5个月(6~36个月),1例术后病理为肾脏上皮样AML的患者于术后6个月出现局部复发伴腹腔多发转移,给予依维莫司治疗后缓解,目前继续使用药物治疗;其余4例均未出现直径超过4 cm肿瘤,且目前均未接受药物治疗。
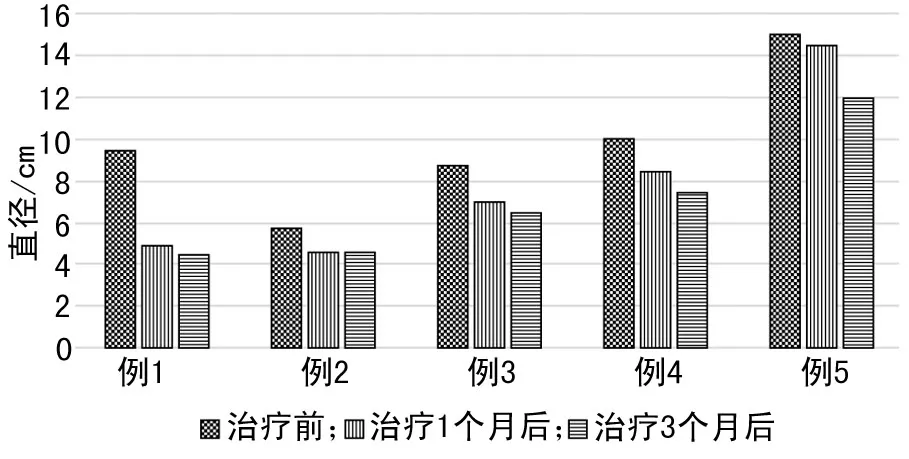
图2 术前新辅助治疗肿瘤直径变化

图3 治疗前可见左肾腹侧近肾门处肿瘤
3 讨论
肾AML是成年TSC患者最常见的合并症和最主要的致死原因,包括肿瘤的破裂出血及肾功能衰竭等。大部分TSC合并肾AML的患者并没有肾脏相关的临床症状,其症状出现与病变瘤体大小相关,肿瘤体积较小时少有临床不适症状。文献报道瘤体直径<4 cm者增长较缓慢,也较少需要手术或选择性介入动脉栓塞等有创治疗;而肿瘤直径>4 cm者则易出现腰痛、血尿及腹部肿块等不适。腰痛主要由于AML增大后压迫周围组织或形成血管瘤样改变后出血导致[8-9]。有文献提示>4 cm者82%~94%可出现临床不适症状,而50%~60%可以自发性出血,如果肿瘤中的动脉瘤直径>5 mm以上也容易增加出血风险[10]。肾AML如压迫正常的肾组织可出现肾素依赖的高血压病及肾功能不全甚至诱发急性肾功能衰竭,故治疗TSC相关病变时应注意监测肾功能变化,避免加重肾脏负担。
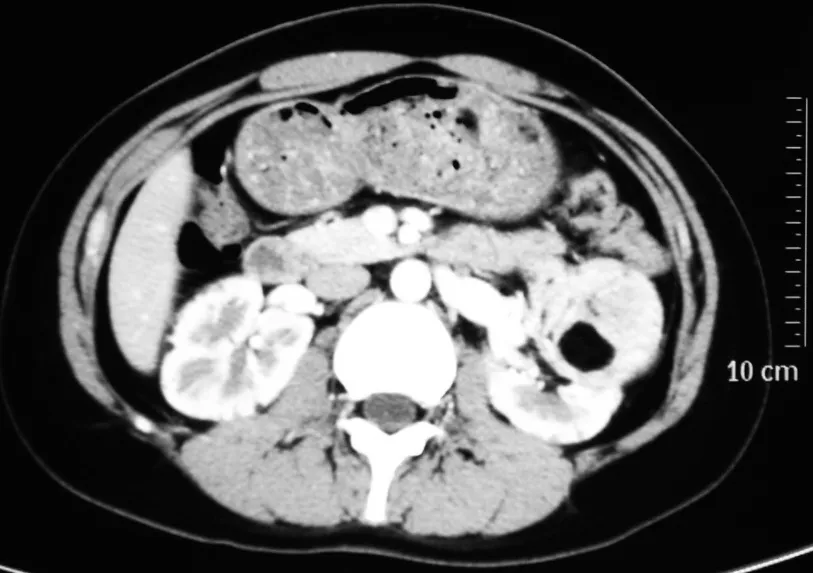
图4 依维莫司治疗3个月后肿瘤体积明显缩小。
目前对于散发性肾AML和TSC相关AML的基本治疗原则都是尽可能地保留肾单位,保护肾功能,防止出血及肾功能衰竭等并发症的出现。对于肿瘤直径<4 cm且无症状者均可选择等待观察。当出现进展性增长、肿瘤直径>4 cm或出现腰痛、血尿、腹部可触及肿块时,散发性AML首选保留肾单位的肿瘤切除术[11-12];而对于TSC相关肾脏AML患者,mTOR抑制剂成为首选的治疗方案。选择行介入动脉栓塞术使用于AML急性出血、无法手术的有症状的AML患者及预防性治疗无症状的AML病变。根治性肾切除术仅在无功能肾、肿瘤浸润周围组织、肾静脉瘤栓、强烈证据提示恶性肿瘤等情况的患者中推荐。对于TSC相关AML患者来说,上述侵入性治疗仍存在很多局限性,任何侵入性干预手段都可能导致肾功能损伤,手术或栓塞并未干预肿瘤的发病机制,无法延缓肿瘤的进展,一些TSC合并AML病灶无法进行手术切除或栓塞,较高比例的患者需要二次手术或者栓塞,这些都限制了外科手术在该疾病治疗中的应用价值[13-14]。
近年来对TSC的遗传及分子生物学层面的研究进展使雷帕霉素或依维莫司(everolimus)成为可选的药物治疗方法[15]。雷帕霉素或依维莫司可直接抑制mTOR活性,使肾AML停止增长或体积缩小。在EXIST 2研究中,依维莫司组有42%的患者AML病灶体积缩小>50%[16]。尽管疗效显著,但长期用药所带来的不良反应及经济负担等问题仍使大部分患者无法接受,因此一些学者开始尝试将药物治疗与手术相结合,对选择性的病例进行及时药物干预以缩小瘤体,使后续治疗成为可能。Staehler等[17]最早尝试应用雷帕霉素后使肾AML体积缩小38%~95%,可作为保留肾单位切除术的新辅助治疗。Thierry等[18]在近期报道了1例TSC相关AML患者接受西罗莫司3 mg Qd治疗12个月后,肿瘤体积显著缩小并成功实施射频消融治疗。本组选取的5例患者共同点是均只有1个瘤体直径超过4 cm,肿瘤成分主要是血管及平滑肌,既往文献报道这类乏脂肪的AML对药物治疗有更好的缩瘤效果[19],本组患者治疗1个月后瘤体缩小47.5%,3个月时缩小达49.4%,这些都为成功实施保留肾单位手术提供了保障,术后平均随访20.5个月,除1例病理诊断为上皮样AML的患者出现复发外,其余4例患者均未见复发,未接受药物治疗。本组患者依维莫司治疗相关不良事件与既往文献报道相近,均为1~2级不良反应,给予对症处理后均可缓解。使用mTOR抑制剂可在TSC疾病早期控制肾AML生长,降低出血或肾衰竭风险。对于较大的肿瘤,mTOR抑制剂治疗可以缩小肿瘤体积、减少肿瘤血供,或可争取到手术机会、降低手术风险、保留肾功能。
总之,对于TSC合并肾脏AML的治疗,应根据肿瘤大小、位置和并发症情况的不同,选择肾部分切除术、高选择性动脉栓塞或者依维莫司单独或联合治疗。其治疗模式正在从过去被动等待和手术干预,向mTOR抑制剂与外科积极干预联合的治疗方式转变。mTOR抑制剂已成为手术等常规治疗之外的重要选择,其在TSC合并AML以及散发性AML术前新辅助治疗中的应用价值,也值得临床医生的关注。