急性胰腺炎患者血清MCP-1、IL-6水平变化及临床意义
胡 静,孙少华,潘朝辉,李晓高,伟 芳,张 莉
(石家庄市第一医院消化内科,河北石家庄 050011)
急性胰腺炎(AP)是临床消化内科常见的急腹症,是由饮食节律变化以及外伤等多种原因引起胰腺内胰酶激活,导致胰腺组织自我消化、水肿、出血,甚至坏死所致[1]。据报道显示[2],AP全球发病率约为17.5/10万~73.4/10万,随着我国居民饮食结构的改变,其发病率呈逐年上升趋势。AP临床表现主要有恶心呕吐、上腹部持续性锐痛或者钝痛等,根据病情严重程度可分为轻症AP(MAP)和重症AP(SAP),有10%~20%的MAP患者病情未得到有效控制可演变为全身炎性反应综合征,并进一步形成SAP,SAP发病急且凶险,致死率高[3]。早期评估AP病情严重程度及判断预后,对采取针对性干预措施有重要意义。病理学结果证实,AP的发病及病情进展与炎性反应及免疫调节过程密切相关,细胞炎症因子参与了AP的发生、发展过程[4]。单核细胞趋化因子蛋白(MCP-1)是重要的单核细胞趋化和激活因子,白细胞介素-6(IL-6)是由单核/巨噬细胞、B淋巴细胞、T淋巴细胞等合并并分泌的细胞因子,研究发现[5-6],MCP-1、IL-6参与了机体的炎性反应和免疫调节过程。本研究通过检测AP患者血清MCP-1及IL-6水平,旨在探讨其在AP发生发展过程中的临床意义。现报道如下。
1 资料与方法
1.1一般资料 收集2016年6月至2017年12月本院收治的103例AP患者为病例组,纳入标准:(1)急性腹痛、腹胀,并伴有恶心、呕吐等临床症状,胰腺彩色多普勒超声、CT检查发现胰腺周围组织浸润,胰腺肿大,入院实验室检查结果提示尿淀粉酶和血清淀粉酶水平显著升高;(2)符合中华医学会消化病学分会胰腺疾病学组制定的《中国急性胰腺炎诊治指南(2013年版)》[7];(3)首次急性发作,发病后入院时间<24 h。排除标准:(1)孕产妇及哺乳期的妇女;(2)心脏功能不全者;(3)肝、肾功能障碍者;(4)细菌所致全身炎症性疾病,创伤、严重烧伤等所致的非感染性炎性反应,真菌感染所致非细菌性感染性疾病;(5)自身免疫性疾病;(6)消化系统恶性肿瘤患者;(7)进入研究前1个月内服用过可能影响MCP-1、IL-6水平的抗炎药物。根据中国AP诊治指南标准将其分为MAP组和SAP组[7],其中MAP组62例,男35例,女27例;年龄39~77岁,平均(52.3±8.5)岁;疾病类型:特发性17例,饮食性20例,酒精性16例,混合性9例。SAP组41例,男23例,女18例;年龄43~79岁,平均(51.9±9.3)岁;疾病类型:特发性10例,饮食性13例,酒精性12例,混合性6例。并于同期随机选取40例健康体检者为对照组,男22例,女18例;年龄37~76岁,平均(52.9±8.5)岁。3组的性别构成比、年龄比较,差异无统计学意义(P>0.05)。本研究获得医院伦理委员会的批准,研究对象在知情同意书上签字。
1.2方法
1.2.1AP治疗 两组患者入院后均给予对症支持治疗,如早期禁食、导泻、抑制胰酶活性以及胰腺分泌,补液、全胃肠外营养支持治疗等,并根据病情采取针对性治疗方案,如内镜治疗、胰腺切除等手术治疗。
1.2.2血清MAP、SAP水平测定 MAP与SAP患者于入院第1、3、7天,对照组患者于入院体检时采取肘静脉血3 mL,在室温环境下静置30 min,以3 000 r/min的速度离心10 min,留取上清液在-80 ℃环境下保存,留待检测。采用放射免疫试剂盒(美国,LINCO)测量各组血清MCP-1、IL-6水平,检测仪器为CM570801(先进技术工业公司提供),严格按照试剂盒上的说明进行相关操作。
1.2.3急性生理与慢性健康状况评分Ⅱ(APACHEⅡ) 参考文献[8],采用APACHE Ⅱ评分对AP患者病情进行评价,得分越高则AP病情越严重。
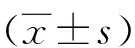
2 结 果
2.1各组血清MCP-1、IL-6水平及APACHE Ⅱ评分比较 MAP组、SAP组入院第1天血清MCP-1、IL-6水平及APACHE Ⅱ评分均高于对照组,差异有统计学意义(P<0.05);MAP组、SAP组患者入院第3、7天血清MCP-1、IL-6水平及APACHE Ⅱ评分均高于第1天,入院第7天血清MCP-1、IL-6水平及APACHE Ⅱ评分均低于第3天,差异均有统计学意义(P<0.05);SAP组患者入院第1、3、7天血清MCP-1、IL-6水平及APACHE Ⅱ评分均高于MAP组,差异有统计学意义(P<0.05)。见表1。
2.2AP患者血清MCP-1、IL-6水平与APACHE Ⅱ评分的相关性分析 AP患者血清MCP-1水平与APACHE Ⅱ评分呈正相关(P<0.05),其中入院第3天,MCP-1与APACHE Ⅱ评分相关性最强;IL-6水平与APACHE Ⅱ评分呈不同程度正相关性(P<0.05),其中入院第3天,IL-6水平与APACHE Ⅱ评分相关性最强。见表2。

表1 各组血清MCP-1、IL-6水平及APACHE Ⅱ评分比较

表2 AP患者血清MCP-1、IL-6与APACHE Ⅱ评分的相关性
2.3MCP-1、IL-6对MAP、SAP的诊断价值 以AP患者第3天的血清MCP-1、IL-6水平绘制ROC曲线,当血清MCP-1临界值为31.6 pg/mL时,ROC曲线下面积最大,为0.852(95%CI:0.812,0.893),此时MCP-1诊断MAP、SAP的灵敏度、特异度分别为0.87、0.82,准确性为0.85;当血清IL-6临界值为35.9 ng/L时,ROC曲线下面积最大,为0.876(95%CI:0.827,0.906),此时IL-6诊断MAP、SAP的灵敏度、特异度分别为0.91、0.85,准确性为0.87。见图1。
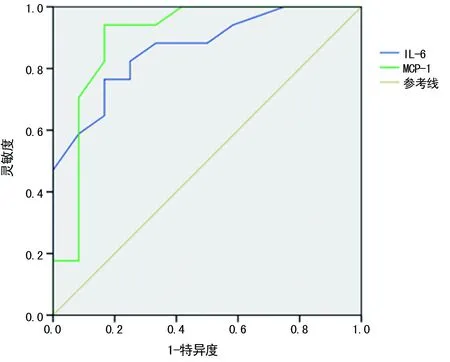
图1 MCP-1、IL-6对MAP、SAP的诊断价值
3 讨 论
随着人们生活节奏的加快以及饮食习惯的改变,AP发病率呈逐年上升趋势,严重威胁患者的健康和生命质量。MAP主要以胰腺水肿为主,属于自限性疾病,在一定时期内即可自愈且预后良好,病死率低于5%;SAP病情较为严重,可呈明显的胰腺出血性坏死,当胰腺消化自身组织时常伴发多器官功能障碍综合征、全身炎性反应综合征,以及不同程度感染性坏死等局部并发症,预后较差,病死率超过20%[9-10]。准确判断AP患者病情严重程度及评估预后,对指导临床针对性治疗具有重要意义。
关于AP的发病机制,目前尚无统一定论,但有研究发现[11],AP发病激活了胰腺间质中的白细胞,促进了炎症细胞因子的合成及释放,进一步增强细胞因子的级联反应而加重炎性反应,最终损伤胰腺等脏器,并诱发多器官功能综合征。可见,炎症因子介导了AP的发生发展过程,炎症介质的级联反应诱导了多器官功能障碍综合征及全身炎性反应综合征[12]。寻找灵敏度高、特异性好的炎症细胞因子早期辅助诊断AP及其病情严重程度,并评估预后,对提高临床治疗效果,改善预后显得尤为重要。
MCP-1属于趋化因子家族中的CC家族,是由MCP-1基因编码的蛋白,具有吸引单核细胞但不吸引淋巴细胞和中性粒细胞的功能。研究表明,炎性反应激活MCP-1表达可使单核细胞、巨噬细胞等局部白细胞浸润聚集,进一步促进并释放炎症介质,从而加重炎性反应的发生[13-14]。已有研究证实,MCP-1参与了阿尔茨海默病[15]、冠状动脉综合征等炎性反应的发生[16]。IL-6是由成纤维细胞、内皮细胞、单核巨噬细胞等多种细胞在炎性反应的刺激下所合成并分泌的急性时相炎症细胞因子。研究显示,IL-6可直接激活炎性细胞和血管内皮细胞,也可间接通过肝脏合成C反应蛋白,并且IL-6还能放大炎性反应速度,加重其程度而损伤组织器官[17]。王治伟等[18]发现IL-6在AP发病后24 h内异常升高,并且参与了AP病情的进展过程。
本研究结果显示,MAP组、SAP组患者入院第1天的血清MCP-1、IL-6水平均高于健康体检者,表明血清MCP-1和IL-6通过介导炎性反应过程而参与了AP的发病过程。同时,MAP组、SAP组患者入院第3、7天的血清MCP-1和IL-6水平均高于第1天,并且入院第7天的血清MCP-1和IL-6水平低于第3天。AP患者发病后血清炎症因子MCP-1、IL-6水平升高,炎性反应急剧加重,但治疗后,患者第7天的炎性反应逐渐下降,但是仍较入院第1天严重,提示动态检测AP患者血清MCP-1和IL-6水平对评估AP病情有重要价值。SAP组患者入院第1、3、7天血清MCP-1和IL-6水平均高于MAP组,提示MCP、IL-6水平可作为诊断AP病情严重程度的重要指标,与有关研究结果一致[14]。APACHE Ⅱ评分是评估AP患者生理病理性评分的重要指标,能有效反映AP病情严重程度,本研究结果显示MAP和SAP患者入院后APACHE Ⅱ评分快速升高,在入院第3天达到高点,随后逐渐下降。Pearson积矩相关分析发现,AP患者发病后不同时点血清MCP-1、IL-6与APACHE Ⅱ评分均呈不同程度正相关性,并且在入院后第3天相关性最强,进一步说明MCP-1、IL-6水平与AP病情严重程度密切相关,是动态反映AP病情发生、发展过程及严重程度的血清学指标。因入院最第3天,血清MCP-1和IL-6水平最高,因此以第3天的血清MCP-1和IL-6水平绘制ROC曲线评估其对MAP和SAP的诊断价值,结果表明,当血清MCP-1、IL-6临界值分别为31.6 pg/mL、35.9 ng/L时,ROC曲线下面积分别为0.852、0.876,提示MCP-1、IL-6对鉴别诊断MAP、SAP具有较高价值。
4 结 论
综上所述,血清MCP-1、IL-6在AP发生、发展过程中异常改变,并且与病情进展及严重程度密切相关,早期动态监测血清MCP-1和IL-6对诊断AP病情严重程度及评估预后,对指导临床开展针对性治疗有重要价值。

