精心设疑,在高三复习中培养和发展学生的化学核心素养
文/佛山市顺德区龙江中学 温 坚
高中化学课程标注修订组提出了五个新的高中化学核心素养,如何在平时的高中化学教学工作中落实培养和发展学生的化学核心素养,是每一个高中化学教师必须思考和实践的首要任务。本文以“高三盐类水解的原理及影响因素复习”为例,探究如何精心设疑,在高三复习中培养和发展学生的化学核心素养。
一、案例主题
本节课首先对盐类水解的基础知识进行快速梳理,然后进行三个重点问题的讨论。先引导学生 自己推导出电离常数和水解常数的数学关系式,教师从水解原理的角度加以解释,并据此通过计算解决三个经典问题。然后分别从定性和定量两个角度讨论解释越弱越水解和越稀越水解,并讨论解释等浓度的碳酸钠和碳酸氢钠溶液的碱性强弱。最后以碳酸的一二级电离常数为切入点,通过计算碳酸氢根的水解常数,比较碳酸氢根的电离常数和水解常数,得出有关弱酸酸式根离子溶液酸碱性的一般规律。
二、教学设计
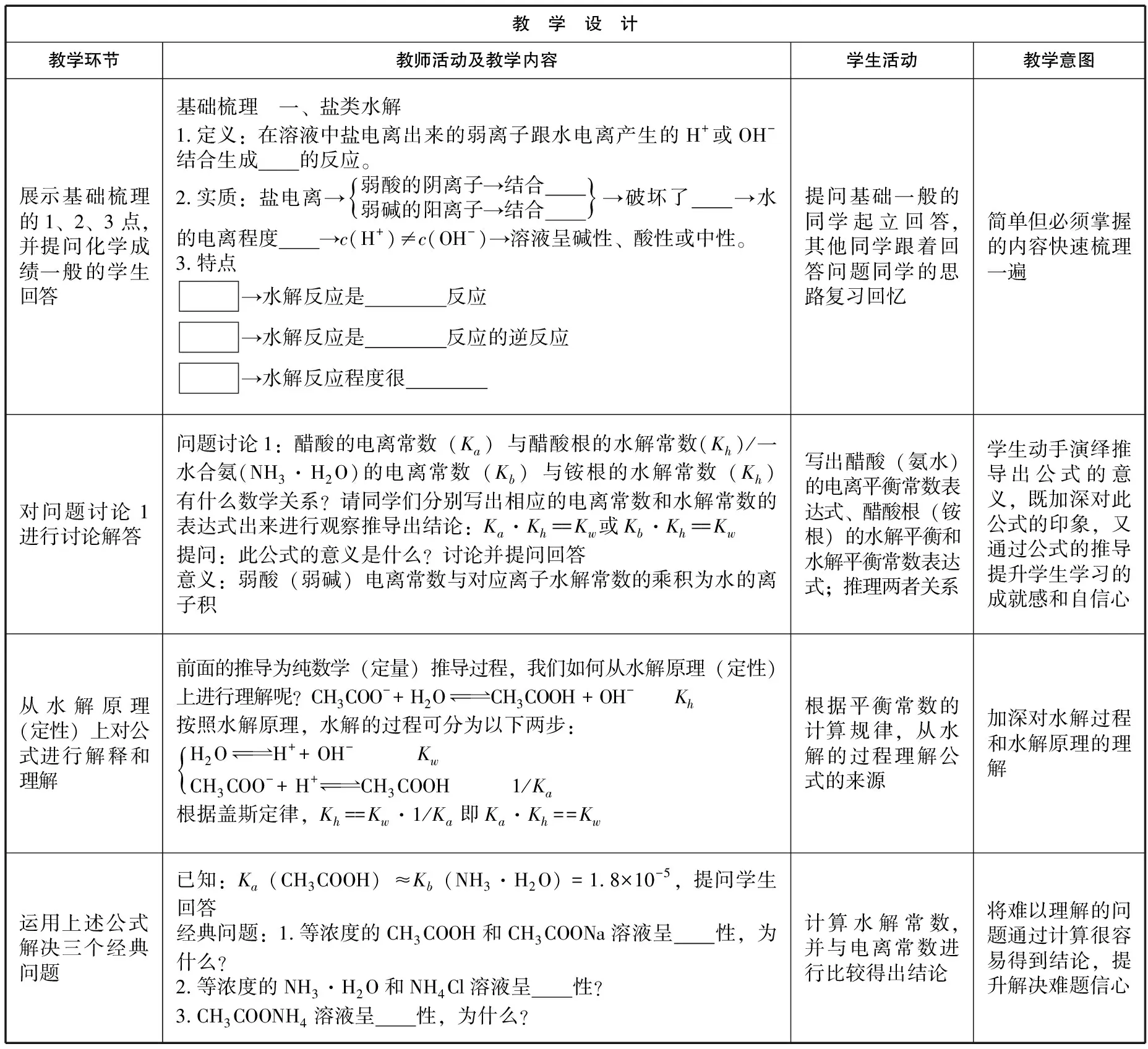
教 学 设 计教学环节教师活动及教学内容学生活动教学意图展示基础梳理的1、2、3点,并提问化学成绩一般的学生回答基础梳理 一、盐类水解1.定义:在溶液中盐电离出来的弱离子跟水电离产生的H+或OH-结合生成的反应。 2.实质:盐电离→弱酸的阴离子→结合弱碱的阳离子→结合{}→破坏了→水的电离程度→c(H+)≠c(OH-)→溶液呈碱性、酸性或中性。3.特点→水解反应是反应→水解反应是反应的逆反应→水解反应程度很提问基础一般的同学起立回答,其他同学跟着回答问题同学的思路复习回忆简单但必须掌握的内容快速梳理一遍对问题讨论1进行讨论解答问题讨论1:醋酸的电离常数(Ka)与醋酸根的水解常数(Kh)/一水合氨(NH3·H2O)的电离常数(Kb)与铵根的水解常数(Kh)有什么数学关系?请同学们分别写出相应的电离常数和水解常数的表达式出来进行观察推导出结论:Ka·Kh==Kw 或Kb·Kh==Kw提问:此公式的意义是什么?讨论并提问回答意义:弱酸(弱碱)电离常数与对应离子水解常数的乘积为水的离子积写出醋酸(氨水)的电离平衡常数表达式、醋酸根(铵根)的水解平衡和水解平衡常数表达式;推理两者关系学生动手演绎推导出公式的意义,既加深对此公式的印象,又通过公式的推导提升学生学习的成就感和自信心从水解原理(定性)上对公式进行解释和理解前面的推导为纯数学(定量)推导过程,我们如何从水解原理(定性)上进行理解呢?CH3COO-+ H2OCH3COOH + OH- Kh按照水解原理,水解的过程可分为以下两步:H2OH+ + OH- KwCH3COO-+ H+CH3COOH 1/Ka{根据盖斯定律,Kh==Kw·1/Ka即Ka·Kh==Kw根据平衡常数的计算规律,从水解的过程理解公式的来源加深对水解过程和水解原理的理解运用上述公式解决三个经典问题已知:Ka(CH3COOH)≈Kb(NH3·H2O) =1.8×10-5,提问学生回答经典问题:1.等浓度的CH3COOH和CH3COONa溶液呈性,为什么?2.等浓度的NH3·H2O和NH4Cl溶液呈性?3.CH3COONH4溶液呈性,为什么?计算水解常数,并与电离常数进行比较得出结论将难以理解的问题通过计算很容易得到结论,提升解决难题信心
(续上表)

教 学 设 计教学环节教师活动及教学内容学生活动教学意图对问题讨论2盐类水解的影响因素进行思考讨论解答,并运用刚才问题讨论2:影响盐类水解平衡的因素 内因:“越弱越水解”怎样从定性和定量两个角度理解这个规律呢?从定性(弱酸电离)的角度进行分析:正向程度越小逆向反应程度越大从定量(电离水解常数)的角度进行分析:Ka·Kh==Kw Ka越小则Kh越大熟读越弱越水解的含义,并从定性的角度如何解释,然后由公式进行推导运用刚才推导的公式,从定性和定量的角度加深对越弱越水解的规律的理解对问题4进行讨论解答,加深对越弱越水解的理解和应用经典问题4:同浓度Na2CO3(aq)、NaHCO3(aq)的碱性强弱同学们相互讨论后,提问一名同学回答,强调对应酸的酸性强弱因为CO32-对应酸是HCO3-,HCO3-对应酸是H2CO3,酸性HCO3- 课堂小结:本节课推导了弱酸(弱碱)的电离常数与其对应离子水解常数的关系式:Ka(Kb)·Kh=Kw,应用公式定性理解及定量推导盐类水解的影响因素(越弱、越热、越稀越水解)和弱酸酸式根离子的电离程度与水解程度的比较。 教学实施过程中,以弱酸(弱碱)的电离常数与其对应离子水解常数的关系式Ka(Kb)·Kh=Kw的推导和解释为引领,从定性和定量两个角度进行解释和相应的定量计算,使学生对盐类水解的规律及影响因素有了更深入的理解。同时,在此过程中也培养了学生的计算能力和利用新公式新信息解决问题的能力。从课堂情况看,本节课很好地体现教学设计思想并很好地完成了教学设计,学生对公式的推导和解释以及后续讨论的三个问题的学习积极性很高,课堂探究的气氛很浓厚,能紧跟老师上课的进程积极思考和计算。从学生的反馈来看,学生对Ka·Kh==Kw的推导和运用、水解的影响因素等重点知识掌握得很不错,有效完成了本节的教学目标,学生的学习状态表现良好,在复习过程培养学生的高中化学核心素养。三、教学反思

