HMGB1和HIF1a在乳头状甲状腺癌中的表达及意义
龚龙,易春华,周明,郑建伟
(1.华中科技大学同济医学院附属荆州医院,湖北 荆州 434020;2.华中科技大学同济医学院附属同济医院,湖北 武汉 430030)
乳头状甲状腺癌(papillary thyroid carcinoma,PTC)是最常见的甲状腺癌,肿瘤细胞分化程度和有无淋巴结转移是PTC预后的重要因素[1-2]。肿瘤微环境是肿瘤生长和转移的重要影响因素,而缺氧是众多实体肿瘤微环境的显著特点[3]。本研究采用免疫组织化学法检测PTC组织及其癌旁组织中缺氧诱导因 子 1a(hypoxia-inducible factor 1-alpha, HIF1a) 和高迁移率族蛋白 1(high mobility group box-1 protein,HMGB1)表达情况,分析HIF-1α和HMGB1与PTC临床病理特征的关系,旨在为进一步研究HMGB1和缺氧在PTC细胞发生、发展过程中的作用和机制提供临床证据。
1 资料与方法
1.1 一般资料
选取2008年1月—2017年10月经华中科技大学同济医学院附属荆州医院甲状腺外科术后确诊的120例患者的癌组织及相应癌旁组织石蜡标本,所有标本经HE染色证实为PTC。其中,男性36例,女性84例;年龄31~76岁,平均46.9岁。患者术前均未行放化疗,统计淋巴结转移及甲状腺癌临床分期情况。其中,有淋巴结转移38例,无淋巴结转移82例。按照国际抗癌协会联盟的TNM分期:Ⅰ、Ⅱ期77例,Ⅲ、Ⅳ期43例。
1.2 试剂
兔抗人HMGB1及HIF-1α多克隆抗体购自英国ABCAM公司,兔SP免疫组织化学试剂盒[北京中杉金桥生物技术有限公司(SP-9001)],DAB显示剂(武汉博士德生物工程有限公司)。
1.3 免疫组织化学
切取石蜡切片,每张切片厚约5μm,采用SP法检测PTC组织及相应癌旁组织中HIF-1α、HMGB1蛋白的表达(HIF1a一抗工作浓度为1∶100;HMGB1一抗工作浓度为1∶100)。所有操作步骤严格按照试剂盒说明书进行,以PBS替代一抗作为阴性对照,试剂公司提供的阳性着色图片作为阳性对照。
1.4 结果判定
根据REMMELE等[4]提出的免疫反应评分(immunoreactive score, IRS)进行染色反应的评价:IRS=染色强度×阳性细胞百分率。染色强度0为阴性,1为弱,2为中度,3为强。阳性细胞百分率0%为阴性,>0%~10%为1;>10%~50%为2;>50%~80%为3;>80%为4。IRS评分0~12分,评分>4分定义为蛋白阳性表达。
1.5 统计学方法
数据分析采用SPSS 16.0统计软件。计数资料以率(%)表示,比较用χ2检验;变量之间的相互关系采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 HIF-1α和HMGB1蛋白在PTC及其癌旁组织中的表达
免疫组织化学染色显示,PTC组织中,HMGB1阳性呈棕色或褐色,主要定位于细胞核和细胞质(见附图A)。而癌旁组织中,HMGB1主要表达于细胞核中,表达较PTC组织减少,且染色减弱(见附图B)。同样地,PTC组织中HIF1a阳性呈棕色或褐色颗粒,主要定位于细胞核和细胞质(见附图C)。而癌旁组织中,HIF1a主要表达于细胞核中,表达较PTC组织减少,且染色减弱(见附图D)。

附图 HMGB1、HIF1a在PTC及其癌旁组织中的表达 (SP法×200)
2.2 PTC组织中HMGB1与HIF1a表达的相关性
HMGB1在PTC组织及癌旁组织中的阳性表达率分别为65.0%和35.0%,经χ2检验,差异有统计学意义(χ2=8.067,P=0.005),PTC组织阳性表达率高于癌旁组织;HIF1a在PTC组织及癌旁组织中的阳性表达率分别为59.2%和40.8%,经χ2检验,差异有统计学意义(χ2=9.630,P=0.002),PTC组织阳性表达率高于癌旁组织。相关性分析显示,PTC组织标本中HMGB1与HIF1a的表达呈正相关(P<0.05)。见表1。
2.3 PTC组织中HMGB1、HIF1a表达水平与临床病理特征的关系
HIF1a和HMGB1在不同肿瘤直径、肿瘤数量、淋巴结转移情况及临床分期方面比较,差异有统计学意义(P<0.05)。见表 2。

表1 PTC组织中HMGB1与HIF1a表达的相关性 例
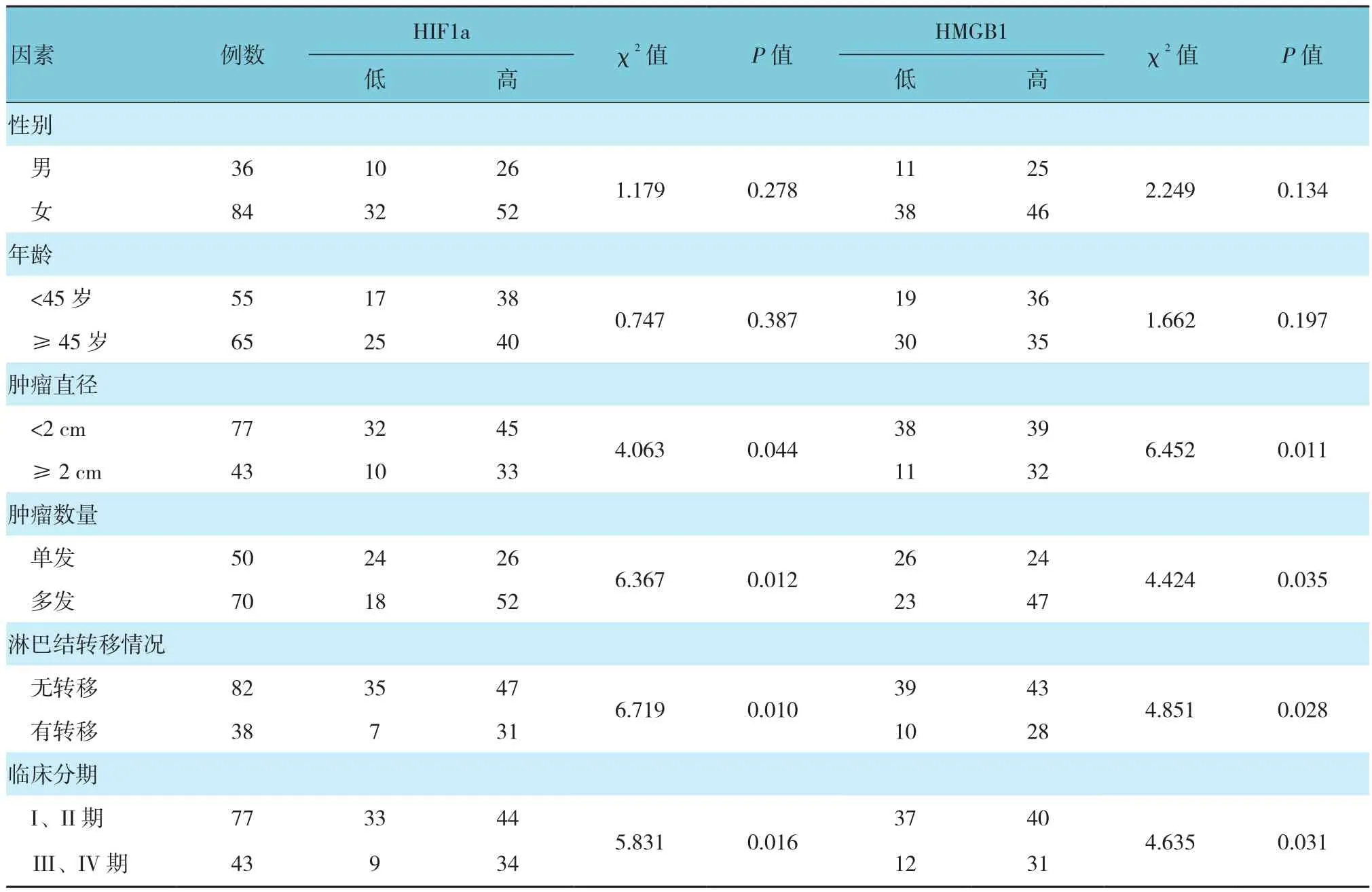
表2 PTC组织中HMGB1、HIF1a表达水平与临床病理特征的关系 例
3 讨论
组织缺氧是多数实体肿瘤常见的病理生理特征,越来越多人认识到其在肿瘤进展的不同阶段中起关键作用[5]。肿瘤对缺氧的适应主要受缺氧诱导因子(HIF-1α和HIF-2α)的调节,HIF-1α与肿瘤启动子有关,被认为是一个促肿瘤因子,而HIF-2α则被证实是肿瘤抑制基因[6]。迄今为止,已有多项研究发现HIF-1α在卵巢、食管、头颈部、乳腺癌、前列腺癌、膀胱癌及口腔上皮等肿瘤中过表达[7-11]。此外,最近一些研究检测了甲状腺癌组织中HIF-1α的表达[12-13]。然而,HIF-1α与炎症效应因子在PTC的发生、发展中的关系研究甚少,其相关机制有待进一步研究。
HMGB1蛋白是一种丰富的非组蛋白染色体结合蛋白。其能稳定核小体结构并参与DNA的复制、转录及修饰[11]。在非恶性细胞中,HMGB1主要存在于细胞核内。在肿瘤细胞中,HMGB1表达增多,且可转位至细胞质和细胞外空间中[14]。HMGB1参与炎症因子的表达和释放,以及肿瘤的发生、发展,而HIF-1α可能是HMGB1表达及细胞亚定位的重要调节因子[15]。QIU等[16]发现缺氧诱导HMGB1表达,进而通过ERK/JNK信号通路调控成骨细胞上皮间质转化。CHENG等[17]还发现缺氧诱导HMGB1转为的释放,进而通过TLRs促进促炎细胞因子产生。而PTC中缺氧与HMGB1的相互表达及作用方式还未见报道。
在本研究中,笔者通过免疫组织化学法检测HIF-1α、HMGB1在PTC及癌旁组织中的表达,发现这两者在PTC中表达升高,主要定位于细胞核和细胞质。进一步分析发现,HMGB1和HIF1a在PTC组织中的表达与肿瘤直径、肿瘤个数、淋巴转移及临床分期有关。提示两者可能参与PTC发生、发展过程。通过相关性分析显示,PTC组织标本中HMGB1与HIF1a的表达呈正相关,提示HIF1a可能调控PTC细胞中HMGB1的表达,进而参与PTC的恶性过程。
尽管笔者在PTC临床样本中研究了HIF-1α与HMGB1的表达及其相关性,但还需要更多的细胞学实验来深入研究两者的调节机制及可能的信号通路。同时进一步研究两者如何参与PTC的发生、发展,如肿瘤的增殖、血管生成、迁移及转移等,以期为以HMGB1为PTC诊断及治疗的分子靶点提供更进一步的理论基础。

