远期恐惧记忆再巩固更新机制的线索选择性特点*
胡静初 张蔚欣 陈小婷 王文清 王子洁 庄楚群 冯 彪 郑希付
远期恐惧记忆再巩固更新机制的线索选择性特点
胡静初张蔚欣陈小婷王文清王子洁庄楚群冯 彪郑希付
(华南师范大学心理学院;华南师范大学生命科学学院, 广州 510631) (中山纪念中学, 广东 中山 528400)
已有动物和人类研究均表明, 通过记忆的再巩固更新机制能有效削弱新形成的条件性恐惧记忆(1天), 并且存在线索选择性特点。然而创伤后应激障碍(PTSD)往往在形成相当一段时间后才能得到治疗, 且现实生活中人们通常一次习得对多个线索的恐惧。因此找到针对多线索创伤记忆的有效治疗方法显得尤为重要。目前未有人研究远期恐惧记忆的再巩固更新机制是否存在线索选择性特点。为探究远期恐惧记忆(>7天)的再巩固更新机制是否同样存在线索选择性特点, 本研究采用被试内实验设计, 以皮肤电作为恐惧反应指标, 多个线索作为条件刺激进行恐惧习得, 习得14天后给被试单独呈现一个线索进行恐惧记忆提取, 10分钟后进行消退训练, 24小时后对不同线索进行自发恢复测试。结果显示:未提取线索的自发恢复程度显著高于提取线索。说明远期记忆(14天)的再巩固更新机制同样存在线索选择性特点, 并确认了提取消退作为一种行为手段对远期恐惧记忆再巩固进行干预的有效性, 对临床干预具有一定指导意义。
远期记忆再巩固; 线索选择性; 条件性恐惧; 提取消退
1 前言
恐惧记忆的形成通常以经典巴甫洛夫恐惧条件化模型为原理, 该模型认为, 一个原本不具备引发个体恐惧情绪的中性刺激CS (条件刺激, Conditioned Stimulus, 如一个声音), 多次伴随一个恐怖或者厌恶刺激US (无条件刺激, Unconditioned Stimulus, 如电击)出现之后, 个体会逐渐习得对这个中性刺激的条件恐惧反应。当这个中性刺激CS单独出现时, 个体会对其产生恐惧反应(Mineka & Zinbarg, 2006)。同时, 条件性恐惧也可以消退, 当条件刺激继续出现而恐惧刺激不再出现时, 已经习得的条件恐惧反应则会逐渐消退。在临床实践中, 往往使用基于消退训练原理的暴露疗法治疗与恐惧有关的情绪障碍(Barlow, Allen, & Choate, 2016)。然而, 消退训练一段时间后, 恐惧常常会以各种形式返回, 如:自发恢复、续新、重建, 训练效果不佳。这是因为消退训练使个体产生了一种新的抑制记忆, 与原来的CS-US恐惧记忆进行竞争, 并未减弱原来的恐惧记忆, 而是产生了一种新的CS-no US的联结(Bouton, 2002)。
传统记忆巩固理论认为, 记忆一旦巩固形成, 则无法改变。近年来这个观点受到挑战, 研究者们认为已巩固的记忆可以经过提取重新进入不稳定状态, 经过一段时间后再次巩固稳定下来, 这个过程称为记忆的再巩固(Alberini, 2005; Dudai, 2004; Nader, 2003)。通过记忆的再巩固更新机制, 可削弱恐惧记忆, 有效阻止恐惧的返回。动物研究中, 在提取激活新形成的恐惧记忆后立刻注射蛋白质合成抑制剂(茴香霉素, anisomycin), 大鼠在之后的测试中表现出恐惧反应显著减少(Nader, Schafe, & Le, 2000)。随后Doyère, Debiec, Monfils, Schafe和Ledoux等人(2007)发现, 大鼠新形成的恐惧记忆再巩固存在线索选择性特点, 即:运用再巩固更新机制只能选择性地削弱提取了的特定线索的恐惧记忆, 并且这种线索选择性特点是通过提取以选择性地改变个体杏仁核的突触可塑性来达成的。由于药物对人类存在副作用, 研究者们随后提出了行为干预恐惧记忆再巩固的提取消退范式, 即在记忆提取后, 在记忆的再巩固时间窗内进行消退训练以削弱原始恐惧记忆。Monfils, Cowansage, Klann和Ledoux (2009)首次验证提取消退范式的有效性, 记忆提取后在再巩固时间窗内进行消退训练, 有效地削弱了大鼠的新形成的恐惧记忆, 而Schiller等人(2010)则首次使用提取消退范式成功干预了人类新形成的恐惧记忆再巩固, 并且证实了人类恐惧记忆再巩固同样存在线索选择性特点。
如果运用记忆再巩固更新机制能够削弱恐惧记忆, 这对创伤后应激障碍的治疗将有重大意义。然而, 创伤后应激障碍患者很难在创伤记忆形成后立即得到治疗, 临床中需要干预的大多是远期记忆。远期恐惧记忆被证明与新形成的恐惧记忆有着不同的特点。一些大鼠的研究表明, 相较于近期记忆, 远期记忆更不容易受到提取的干扰(Milekic & Alberini, 2002; Suzuki et al., 2004)。Suzuki等人(2004)的结果表明在小鼠习得条件性恐惧反应56天后, 使用茴香霉素干扰记忆再巩固, 发现未出现药物对远期记忆再巩固的干扰效果。这是由于远期恐惧记忆与新形成的恐惧记忆有着不同的神经机制, 新的恐惧记忆的编码和存储更依赖于海马, 而远期记忆的存储更依赖于新皮层(Anagnostaras, Maren, & Fanselow, 1999; Eichenbaum, Otto, & Cohen, 1994; Frankland, O'Brien, Ohno, Kirkwood, & Silva, 2001; Kim & Fanselow, 1992; LeDoux, 1999; Mcclelland, Mcnaughton, & O'Reilly, 1995; McGaugh, 2000; Quevedo et al., 1999; Squire & Alvarez, 1995; Rie, Hotaka, Frankland, & Satoshi, 2016), 因此, 提取激活远期记忆需要激活皮层区域, 而不仅是海马。由于大脑皮层区域广泛, 所以更难达到激活(Bontempi, Laurent-Demir, Destrade, & Jaffard, 1999; McClelland et al., 1995)。
目前, 大部分人类恐惧记忆再巩固研究都集中在新形成(1天)的恐惧记忆, 没有人研究过大于7天的恐惧记忆。然而真实生活中的创伤记忆往往是远期恐惧记忆, 而且常伴随多个习得线索。因此, 多线索远期恐惧记忆再巩固是否可以被成功干预, 以及是否同样存在线索选择性特点, 成为了关键问题。
为探究远期恐惧记忆再巩固更新机制是否存在线索选择性特点, 以及再巩固更新机制是否对人类远期恐惧记忆同样有效, 我们使用Schiller等人(2010)的提取消退范式, 被试在第一天习得恐惧记忆, 14天后进行提取, 提取后在再巩固时间窗内进行消退训练, 后一天进行自发恢复测试, 探究14天的条件性恐惧记忆是否能被干预, 以及干预是否存在线索选择性特点, 以推进记忆再巩固更新机制在心理治疗中的临床应用。
2 对象与方法
2.1 被试
被试为28名在校大学生(其中男生15名, 女生13名), 通过自愿报名的方式参加, 年龄范围为18~23岁(= 23.34,= 1.18)。对于本研究所涉及到的被试采用如下选择方法:在大学里发布招募通知, 在报名的大学生中先通过电话询问其是否有精神障碍史、最近是否有服用过精神类药品等问题, 选择右利手、无躯体疾病和精神障碍、视力或矫正视力正常、无色盲及色弱且之前没有参加过类似实验的被试。
正式实验前首先向被试说明:本实验是一个恐惧情绪实验, 实验过程中将在左手食指和无名指的末端指腹上连接电极以记录皮肤电, 在右手手腕处施加一个轻微电击, 由于每个人的感觉阈限有所不同, 正式实验前首先会进行电击强度的评定, 电击仪器的使用是经过科学评定的, 绝不会对您造成任何伤害, 如果在实验过程中有任何不适, 可随时提出终止实验, 三天实验结束后给您支付相应的报酬。接着, 被试需签署实验知情同意书, 并填写《状态−特质焦虑量表》。被试状态焦虑(= 38.21,= 1.32)和特质焦虑(= 38.90,= 2.29)均在正常范围之内。
在实验设备准备好后, 进一步确认被试是否能看清电脑屏幕, 能否听清实验员的指导语等, 在得到确认答复后才开始正式实验。
一个乐于“嚼舌根”的人,常常是一个成功度不高、渴望友谊但又难获真正友谊的人。人活着,总需要一点存在感。有些人为了证明存在的价值,完全不顾他人感受,像钟女士就是这样。
2.2 实验刺激
条件刺激(CS):采用图片作为条件刺激, 图片分别为黄色正方形、蓝色正方形和绿色的正方形。其中两种颜色的正方形会跟随US, 作为CSa+、CSb+, 另一种颜色的正方形始终不会跟随US, 作为CS− (如图1所示)。为避免被试对不同颜色的偏好和顺序效应, 刺激颜色和呈现顺序已进行平衡。三个图片均为标准色, 具有相同的大小和亮度, 呈现时间为4 s, 背景为标准白色。为平衡不同颜色的正方形在不同被试间的影响, 三种颜色的图形有相同的概率充当CS+。

图1 远期恐惧记忆再巩固实验的刺激材料
非条件刺激(US):参考Schiller等人(2010)的研究, 本实验采用腕部电击作为非条件刺激(US)来诱发被试的恐惧情绪, 电击持续时间为200 ms。考虑到个体之间感觉阈限会存在差异, 在正式实验前会让被试对电击强度进行评定, 被试需要自行决定让其感到极度不舒服但可以忍受的电击强度。
2.3 实验流程
电击强度评定:在正式实验之前先对每个被试所能接受的电击强度进行评定, 这个强度能让被试感到极度不舒服但可以忍受。评定先从较微弱的10 V开始, 之后每次增大10 V, 并在每次增大电击强度之后询问被试的感受, 直到被试报告强度已达到让其感到极度不舒服但可以忍受的程度(电击强度最高不超50 V)。每次电击持续时间为200 ms, 电流为每秒50脉冲。在接下来的各个实验环节中被试的电击强度不再改变。
实验分为3天, 分别为第1天的习得阶段、第15天的提取−消退阶段、第16天的自发恢复测试阶段(如图2所示)。正式实验开始前, 先向被试详细解释指导语, 确保被试明白指导语的意思后, 进入第一天的习得阶段。
第1天习得阶段:CSa+、CSb+分别呈现13次(每个CS不会超过两次连续出现), 每次呈现4 s, 试次之间的时间间隔(ITI)为12~18 s, 其中有38% (5次) CSa+、38% (5次) CSb+伴随电击。CS−呈现8次, 均不伴随电击。
第15天提取消退阶段:先给被试单独呈现一次CSa+, 呈现时间为4 s, 以提取激活习得的恐惧记忆。接着被试休息10 min, 休息之后进行消退训练。消退过程中CSa+、CSb+和CS−各随机呈现11次, 共呈现33次, 每次呈现4 s, ITI为12~18 s, 均不跟随电击。
第16天自发恢复测试阶段:自发恢复测试过程CSa+、CSb+、CS−各随机呈现11次, 共呈现33次, 每次呈现4 s, 均不跟随电击, ITI为12~18 s。
所有实验刺激都通过Eprime 2.0 编程呈现。首先在屏幕中央呈现红色注视点“+”, 呈现时间为1000 ms, 注视点后呈现条件刺激CS, 呈现时间为4 s, 随后跟随非条件刺激US或者白屏, 呈现时间均为200 ms (如图3所示)。实验过程中被试不需要做任何按键反应。
2.4 测量指标
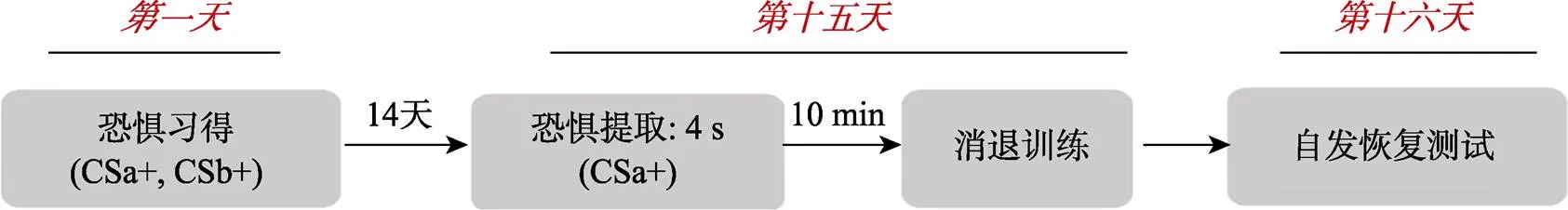
图2 实验流程
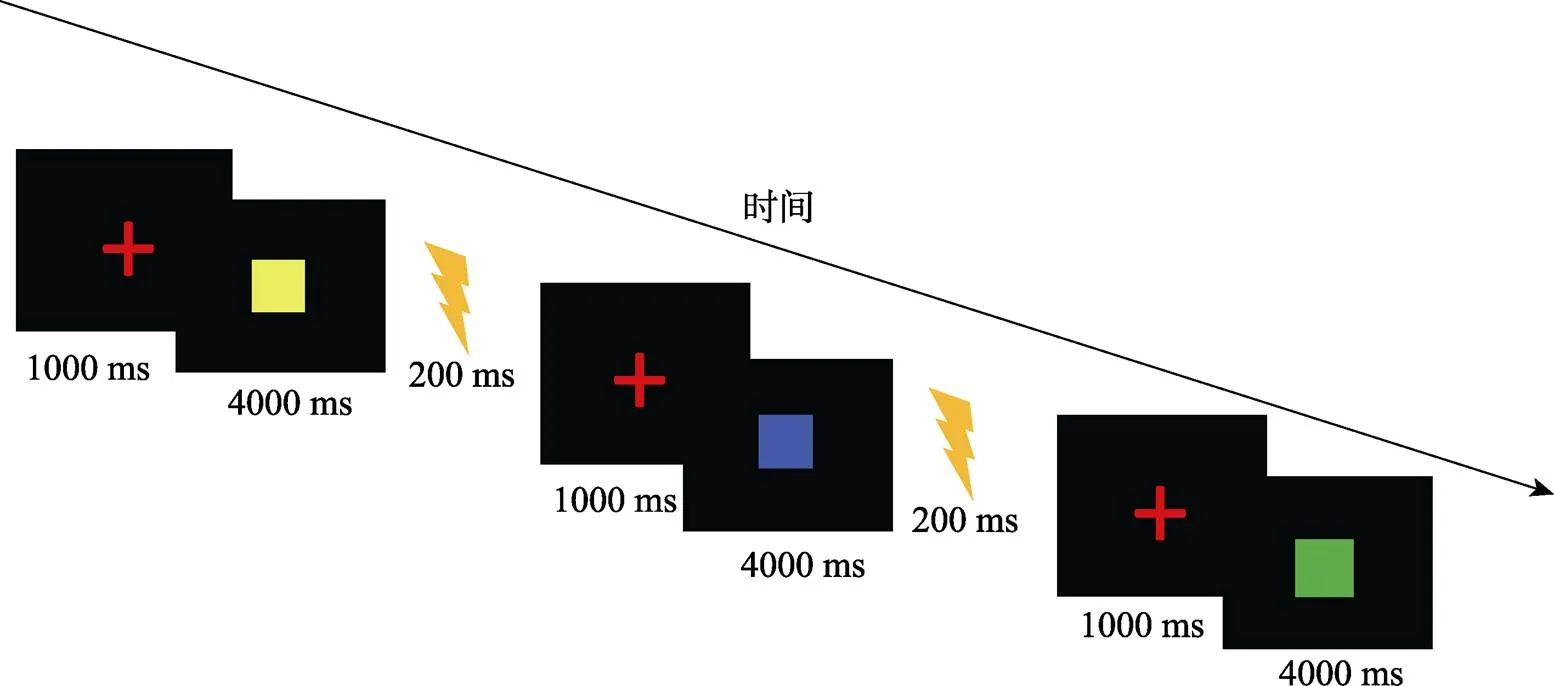
图3 实验刺激呈现示意图
本实验的数据均使用SPSS 17.0进行统计分析。分别对各个阶段(恐惧学习阶段, 恐惧消退阶段, 恐惧自发恢复阶段)的皮肤电进行刺激类型(CSa+, CSb+, CS−) × 阶段(早期, 晚期)的重复方差测量分析, 并采用Bonferroni法进行事后检验或配对样本t检验对不同阶段的不同刺激类型的差异进行比较。
3 实验结果
3.1 习得阶段
以刺激类型(CSa+, CSb+, CS−)和实验阶段(习得早期:习得阶段前4个试次; 习得晚期:习得阶段后4个试次)为被试内因素做重复测量方差分析, 结果显示:刺激类型的主效应显著,(2, 56) = 9.79,< 0.001, η2 p= 0.26; 实验阶段的主效应显著,(1, 28) = 18.70,< 0.001, η2 p= 0.40; 刺激类型和实验阶段的交互作用显著,(2, 56) = 3.89,< 0.05, η2 p= 0.12。
采用Bonferroni法进行事后检验发现CSa+, CSb+, CS−在习得早期均不存在显著差异(1.00,0.45,0.37), 而到了习得晚期, CSa+与CS−, CSb+与CS−出现了显著差异(0.001,< 0.01), 而CSa+与CSb+仍然不存在显著差异(0.30)。
分别对习得晚期的皮电均值进行刺激类型(CSa+, CS−)与(CSb+, CS−)的配对样本t检验, 结果发现在恐惧习得晚期被试对CSa+, CSb+的皮肤电反应均显著高于CS− [CSa+,(28) = 6.07,< 0.001, Cohen’s= 1.25; CSb+,(28) = 3.95,< 0.001, Cohen’s= 0.83], 而对CSa+和CSb+的皮肤电反应却不存在显著差异,(28) = 1.70,= 0.10, Cohen’s= 0.32。
总体来看, 在习得的早期阶段, 被试对CSa+, CSb+与CS−的差异并不显著, 意味着被试在习得早期对三种刺激类型的恐惧程度一致, 但随着实验阶段进行到习得晚期, 被试对CSa+, CSb+的反应显著的高于了CS−, 而对CSa+和CSb+的差异仍然不显著。这意味着随着实验的进行, 被试在习得晚期对CSa+和CSb+产生了显著高于CS−的恐惧, 并且对CSa+和CSb+的恐惧程度仍然趋向一致(如图4、图5所示)。
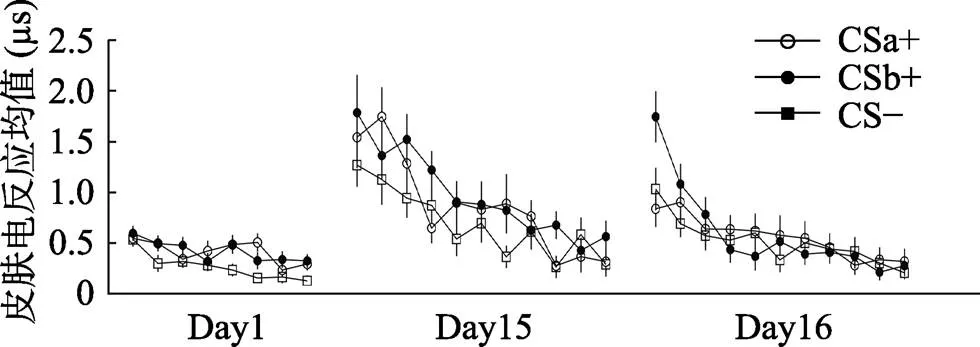
图4 各阶段不同刺激类型的皮电反应值变化
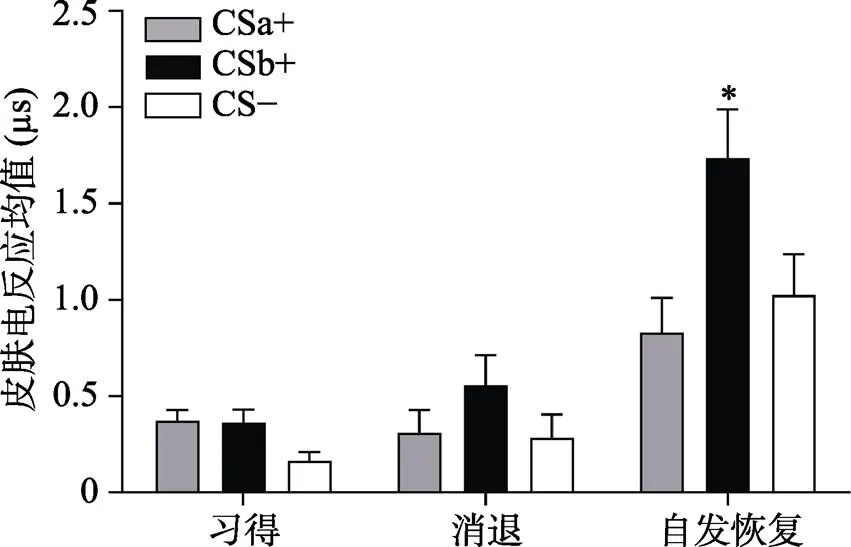
图5 各阶段不同刺激类型的皮电反应均值
注:习得阶段(Acquisition)为习得后半段均值(后5个试次的均值); 消退(Extinction)为消退最后一个试次均值, 自发恢复(Recovery)为自发恢复第一个试次均值。
3.2 消退阶段
以刺激类型(CSa+, CSb+, CS−)和实验阶段(消退早期:消退阶段前4个试次; 消退晚期:消退阶段后4个试次)为被试内因素做重复测量方差分析, 结果显示:刺激类型的主效应显著,(2, 56) = 6.50,< 0.01, η2 p= 0.19; 实验阶段主效应显著,(1, 28) = 25.56,< 0.001, η2 p= 0.48; 刺激类型与实验阶段的交互作用显著,(2, 56) = 4.16,< 0.05, η2 p= 0.13。
为了检测消退训练的效果, 我们分别计算了消退前三个和最后三个试次中呈现不同刺激类型(CSa+, CSb+, CS−)时的皮电均值, 并对它们进行了刺激类型(CSa+, CS−; CSb+, CS−)的配对样本t检验, 结果发现被试在消退的前三个试次对CSa+与CSb+的皮电反应显著高于CS− [CSa+,(28) = 2.94,< 0.01, Cohen’s= −0.05; CSb+,(28) = 3.48,< 0.01, Cohen’s= 0.78], 而到了最后三个试次对CSa+, CSb+的反应与CS−无显著差异[CSa+,(28) = −0.69,= 0.50, Cohen’s= −0.13; CSb+,(28) = 1.63,= 0.12, Cohen’s= 0.31]。
对消退阶段最后一个试次的皮电均值进行刺激类型(CSa+, CS−; CSb+, CS−)的配对样本t检验, 结果发现被试在消退的最后一个试次对CSa+, CSb+的反应与CS−无显著差异[CSa+,(28) = 0.17,= 0.87, Cohen’s= 0.03; CSb+,(28) = 0.99,= 0.33, Cohen’s= 0.19]。这表示在消退的末尾阶段, CSa+、CSb+的皮电值与CS−没有显著差异, 表明被试完成了消退训练。并且配对t检验显示被试在消退的最后一个试次对CSa+与CSb+没有显著差异,(28) = −0.89,= 0.38, Cohen’s= 0.17, 这意味着被试对CSa+与CSb+的恐惧消退程度一致(如图4、图5所示)。
3.3 自发恢复测试阶段
以刺激类型(CSa+, CSb+, CS−)和实验阶段(自发恢复早期:自发恢复阶段前4个试次; 自发恢复晚期:自发恢复阶段后4个试次)为被试内因素做重复测量方差分析, 结果显示:刺激类型的主效应显著,(2, 56) = 3.17,< 0.05, η2 p= 0.10; 实验阶段的主效应显著,(1, 28) = 26.43,< 0.001, η2 p= 0.49; 刺激类型和实验阶段的交互作用显著,(2, 56) = 4.69,< 0.05, η2 p= 0.14。
采用Bonferroni法进行事后检验发现, 在自发恢复早期阶段, CSb+的皮电值显著大于CSa+ (< 0.05), 并且显著大于CS− (< 0.01), 而CSa+与CS−的皮电值不存在显著差异(= 1.00), 而到了自发恢复晚期, CSa+与CS−, CSb+与CS−, CSa+与CSb+的差异均不显著(s = 1.00)。这表明, 在自发恢复的早期阶段, 被试对没有经过提取后消退的CSb+出现了明显的自发恢复反应, 却没有对经过提取消退训练的CSa+表现出恐惧的自发恢复。而随着实验进行到后半段, 由于一直没有电击US的出现, 被试一开始对CSb+出现的恐惧自发恢复逐渐被消退, 对CSa+, CSb+, CS−的反应逐渐趋于一致(见图4)。
为了进一步探究不同刺激类型从消退阶段到自发恢复阶段的变化情况, 我们对CSa+与CS−的差值, CSb+与CS−的差值进行了两因素重复测量方差分析, 以与CS−差值的刺激类型(CSa+, CSb+)和实验阶段(消退最后一个试次; 自发恢复第一个试次)为因素, 结果显示:刺激类型的主效应显著,(1, 28) = 10.15,< 0.01, η2 p= 0.27; 实验阶段的主效应不显著,(1, 28) = 0.52,= 0.48; 刺激类型和实验阶段的交互作用显著,(1, 28) = 5.63,< 0.05, η2 p= 0.17。
通过配对样本t检验对CSa+/CSb+与CS−在自发恢复测试阶段第一个试次的皮电差值和在消退阶段最后一个试次的皮电差值进行比较, 结果显示:即CSb+与CS−在自发恢复测试阶段第一个试次的皮电差值显著高于在消退阶段最后一个试次的皮电差值:(28) = −2.07,< 0.05, Cohen’s= 0.15, 而CSa+与CS−没有差异:(28) = 0.78,= 0.44, Cohen’s= −0.39 (如图6所示), 说明提取了的CSa+没有出现自发恢复, 而没有提取的CSb+出现了显著的自发恢复。
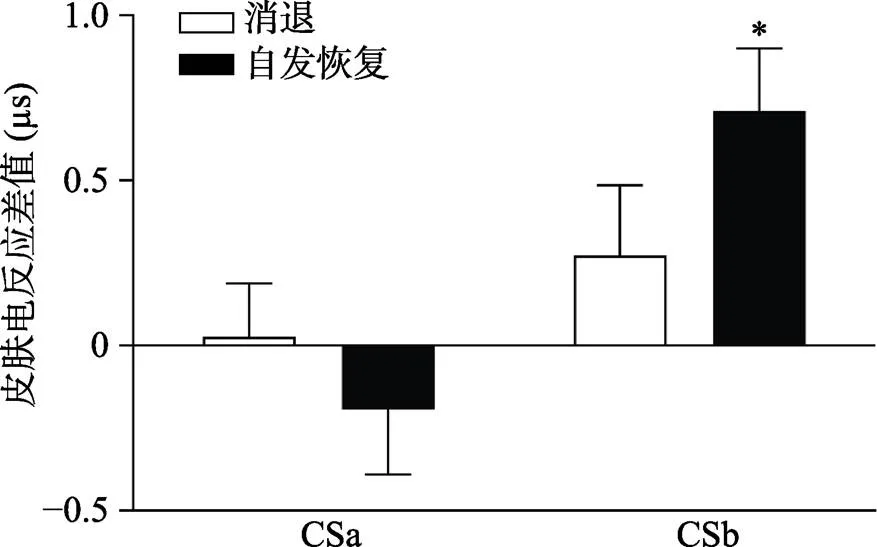
图6 CSa+/CSb+与CS−在自发恢复测试阶段第一个试次和消退阶段最后一个试次的皮电差值
注:*< 0.05 CSb+与CS−在自发恢复测试阶段第一个试次的皮电差值与在消退阶段最后一个试次的皮电差值存在显著差异。
4 讨论
本研究探究了提取消退训练是否能够干预人类远期恐惧记忆再巩固, 以及是否存在线索选择性特点。被试在第1天习得恐惧, 第15天进行恐惧记忆的提取及消退训练, 第16天进行自发恢复测试。实验结果表明, 提取消退训练成功干预了远期恐惧记忆再巩固, 阻止了远期恐惧的自发恢复, 而且同样存在线索选择性特点。
远期恐惧记忆的再巩固更新机制出现线索选择性特点, 可能是由于提取单一线索这一操作, 只能选择性地再激活大脑皮层中对于特定线索的远期恐惧记忆, 让特定记忆进入不稳定状态, 导致了只有特定线索的记忆得以被干预和破坏。这一结果也意味着不同线索的恐惧记忆可能是以不同路径编码储存在特定大脑皮层, 印证了人类记忆编码储存方式的复杂度。
本研究的实验结果与部分使用药物干预远期恐惧记忆再巩固的动物实验结果一致(Debiec, Ledoux, & Nader, 2002; Nader et al., 2000), 也与Steinfurth等人(2014)的人类实验结果一致, 他们尝试使用提取消退范式对7天的恐惧记忆再巩固进行干预, 并成功阻止了人类远期恐惧的返回。我们的结论验证了记忆的不稳定性:无论是刚形成的新记忆还是远期记忆, 一旦有新的安全信息进入再巩固时间窗, 记忆就非常容易被改变。
值得注意的是, 本研究与部分使用提取消退范式干预远期恐惧记忆的动物实验结果不一致。例如, Clem和Huganir (2010)使用提取消退的手段干预小鼠的远期记忆(7天), 结果发现无法阻止小鼠的远期记忆返回, 这可能由于恐惧记忆的强度不同, 小鼠在实验室习得的恐惧记忆相对更强。出于伦理考虑, 我们无法在实验室创造过强的人类恐惧记忆, 这就决定了实验室中造成的恐惧记忆可能更加容易被更改。其次, 虽然记忆巩固周期的分子机制在不同物种间也非常相似, 但他们的记忆时间长度却可能因为寿命的长短不同而不一致, 如:人类寿命约为70岁左右, 而小鼠寿命约为2年左右, 那么对于小鼠而言, 14天的远期恐惧记忆可能相当于它们490天的恐惧记忆(Dutta & Sengupta, 2016; Quinn, 2005)。
本研究首次在人类被试上使用提取消退范式干预14天的远期记忆再巩固, 并验证了远期恐惧记忆再巩固更新机制存在线索选择性特点。对于人类而言, 即使是14天的远期记忆, 也可以通过提取激活进行干预改变。本研究有助于我们进一步了解人类恐惧记忆的特点, 从而有助于我们更好地将基础研究中的结论推广到临床应用中去, 例如根据新形成的创伤记忆与形成很久的创伤记忆的特点及两者差异, 有针对性地对其进行干预。通过本研究我们也可以了解到人类与动物物种的差异, 如对于人类来说, 可以通过短时间对记忆线索的暴露迅速提取特定恐惧记忆, 哪怕是远期恐惧记忆也存在同样规律。本研究还为使用提取消退干预创伤记忆提供了指导, 具有一定的临床应用价值, 因为大多数实验室创造的条件性恐惧记忆多是在一天后进行干预, 而真实生活中的创伤记忆往往不可能在刚形成时就能得到干预。
然而, 本研究同样存在几个限制:第一, 在最后的实验结果中, 由于习得和消退恐惧是本实验得以进行的先决条件, 我们排除了无法习得或消退恐惧的被试, 因此无法测量无法习得和消退恐惧的被试的自发恢复(Kindt, Soeter, & Vervliet, 2009; Sotres-Bayon, Diaz-Mataix, Bush, & Ledoux, 2009; Yang, Chao, & Lu, 2006); 第二, 我们使用能体现自主神经反应的恐惧指标(皮肤电)来测试人类的条件化恐惧, 然而皮肤电经常随着室温和天气而变化, 被试学习恐惧的第一天和提取消退的第15天的气温非常不同, 这也解释了为什么我们实验中第一天习得的数据范围相对于第15天要低的多; 第三, 我们只使用了皮肤电作为测量恐惧的指标, 并没有使用任何认知外显指标(如US预期, 表示被试对于每个试次出现电击的概率估计, 可以代表被试对于条件化恐惧学习的外显学习程度, 同样也是恐惧学习的一个有力指标)。然而, 研究表明使用认知指标会导致被试习得更强, 让被试更能外显地学习到CS-US之间的知识联结, 以致于记忆无法消退(Warren et al., 2014), 同时容易与皮肤电指标相互影响。基于这些原因, 我们更倾向于使用一种非侵入性、能反应自主神经活动的指标来测量恐惧程度, 但这也在某种程度上减少了数据的获得。
本研究证实, 远期恐惧记忆再巩固更新机制存在线索选择性特点, 以及14天的远期恐惧记忆也是可以通过在提取后的再巩固时间窗内进行消退训练而成功削弱的, 再次确认了提取消退作为一种记忆再巩固的行为干预手段的有效性。
Alberini, C. M. (2005). Mechanisms of memory stabilization: Are consolidation and reconsolidation similar or distinct processes?.(1), 51–56.
Anagnostaras, S. G., Maren, S., & Fanselow, M. S. (1999). Temporally graded retrograde amnesia of contextual fear after hippocampal damage in rats: Within-subjects examination.(3), 1106–1114.
Barlow, D. H., Allen, L. B., & Choate, M. L. (2016). Toward a unified treatment for emotional disorders.(2), 205–230.
Bontempi, B., Laurent-Demir, C., Destrade, C., & Jaffard, R. (1999). Time-dependent reorganization of brain circuitry underlying long-term memory storage.(6745), 671–675.
Bouton, M. E. (2002). Context, ambiguity, and unlearning: Sources of relapse after behavioral extinction.(10), 976–986.
Clem, R. L., & Huganir, R. L. (2010). Calcium-permeable ampa receptor dynamics mediate fear memory erasure.(6007), 1108–1112.
Debiec, J., Ledoux, J. E., & Nader, K. (2002). Cellular and systems reconsolidation in the hippocampus.(3), 527–538.
Dudai, Y. (2004). The neurobiology of consolidations, or, how stable is the engram?(1), 51–86.
Doyère, V., Debiec, J., Monfils, M-H., Schafe, G. E., & Ledoux, J. E. (2007). Synapse-specific reconsolidation of distinct fear memories in the lateral amygdala.(4), 414–416.
Dutta, S., & Sengupta, P. (2016). Men and mice: relating their ages., 244–248.
Eichenbaum, H., Otto, T., & Cohen, N. J. (1994). Two functional components of the hippocampal memory system.(3), 449–581.
Frankland, P. W., O'Brien, C., Ohno, M., Kirkwood, A., & Silva, A. J. (2001). α-camkii-dependent plasticity in the cortex is required for permanent memory.(6835), 309–313.
Kim, J. J., & Fanselow, M. S. (1992). Modality-specific retrograde amnesia of fear.(5057), 675–677.
Kindt, M., Soeter, M., & Vervliet, B. (2009). Beyond extinction: Erasing human fear responses and preventing the return of fear.(3), 256–258.
Ledoux, J. E. (1999). Emotion circuits in the brain.(23), 155–184.
Mcclelland, J. L., Mcnaughton, B. L., & O'Reilly, R. C. (1995). Why there are complementary learning systems in the hippocampus and neocortex: Insights from the successes and failures of connectionist models of learning and memory.,(3), 419–457.
Mcgaugh, J. L. (2000). Memory--A century of consolidation.,(5451), 248–251.
Milekic, M. H., & Alberini, C. M. (2002). Temporally graded requirement for protein synthesis following memory reactivation.(3), 521–525.
Mineka, S., & Zinbarg, R. (2006). A contemporary learning theory perspective on the etiology of anxiety disorders: It's not what you thought it was.(1), 10–26.
Monfils, M. H., Cowansage, K. K., Klann, E., & Ledoux, J. E. (2009). Extinction-reconsolidation boundaries: Key to persistent attenuation of fear memories.(5929), 951–955.
Nader, K. (2003). Memory traces unbound.(2)65–72.
Nader, K., Schafe, G. E., & Le, D. J. (2000). Fear memories require protein synthesis in the amygdala for reconsolidation after retrieval.(6797), 722– 726.
Quevedo, J., Vianna, M. R. M., Roesler, R., De-Paris, F., Izquierdo, I., & Rose, S. P. R. (1999). Two time windows of anisomycin-induced amnesia for inhibitory avoidance training in rats: Protection from amnesia by pretraining but not pre-exposure to the task apparatus.(6), 600–607.
Quinn, R. (2005). Comparing rat's to human's age: How old is my rat in people years?(6), 775–777.
Rie, I., Hotaka, F., Frankland, P. W., & Satoshi, K. (2016). Hippocampal neurogenesis enhancers promote forgetting of remote fear memory after hippocampal reactivation by retrieval.:e17464.
Schiller, D., Monfils, M-H., Raio, C. M., Johnson, D. C., Ledoux, J. E., & Phelps, E. A. (2010). Preventing the return of fear in humans using reconsolidation update mechanisms.(7277), 49–53.
Sotres-Bayon, F., Diaz-Mataix, L., Bush, D. E. A., & Ledoux, J. E. (2009). Dissociable roles for the ventromedial prefrontal cortex and amygdala in fear extinction: Nr2b contribution.(2), 474–482.
Squire, L. R., & Alvarez, P. (1995). Retrograde amnesia and memory consolidation: A neurobiological perspective.(2), 169–177.
Steinfurth, E. C. K., Kanen, J. W., Raio, C. M., Clem, R. L., Huganir, R. L., & Phelps, E. A. (2014). Young and old pavlovian fear memories can be modified with extinction training during reconsolidation in humans.(7), 338–341.
Suzuki, A., Josselyn, S. A., Frankland, P. W., Masushige, S., Silva, A. J., & Kida, S. (2004). Memory reconsolidation and extinction have distinct temporal and biochemical signatures.(20), 4787–4795.
Warren, V. T., Anderson, K. M., Kwon, C., Bosshardt, L., Jovanovic, T., & Bradley, B., Norrholm, S. D. (2014). Human fear extinction and return of fear using reconsolidation update mechanisms: The contribution of on-line expectancy ratings.(3), 165–173.
Yang, Y. L., Chao, P. K., & Lu, K. T. (2006). Systemic and intra-amygdala administration of glucocorticoid agonist and antagonist modulate extinction of conditioned fear.(5), 912–924.
Cue specificity of reconsolidation update mechanism in remote fear memories
HU Jingchu; ZHANG Weixin; CHEN Xiaoting; WANG Wenqing; WANG Zijie; ZHUANG Chuqun; FENG Biao; ZHENG Xifu
(School of Psychology, South China Normal University, Guangzhou, 510631, China) (School of Life Sciences, South China Normal University, Guangzhou, 510631, China) (Sun Yat-Sen Memorial Secondary School, Zhongshan, 528400, China)
Recent studies of fear memories conducted in both humans and animals have suggested that new fear memories (1-day old) can be attenuated using a reconsolidation update mechanism, which is selective to the reactivated cue. In real life, patients with post-traumatic stress disorder (PTSD) usually receive treatment much after the traumatic memories form, and a traumatic event can be associated with multiple cues. However, the cue specificity of reconsolidation update mechanism in remote fear memories (> 7 days) remains largely unknown.
To assess the cue specificity of remote fear memories (14 days) reconsolidation, we explored whether retrieval-extinction during the reconsolidation time window of remote fear memories is selective to the reactivated cue. We used a within-subject design, and skin-conductance response (SCR) served as the measurement. All subjects underwent fear conditioning by three coloured squares on day 1. Two squares (CSa+ and CSb+) were paired with the shock on 38% of the trials. The third square (CS−) was never paired with the shock. Fourteen days later, subjects received a single presentation of CSa+ (reactivated CS+) but not CSb+ (non-reactivated CS+). Ten minutes after the reminder trial, extinction training was conducted (within the reconsolidation window). Twenty-four hours later, all subjects returned to the experiment room and received spontaneous recovery test of the remote fear memories.
Results showed that there is no recovery for the reminded CS+, but significant recovery for non-reminded CS+ during spontaneous recovery testing. The recovery index (which was calculated as the first trial on day 16 minus the last trial on day 15 by differential SCR) of non-reminded CS+ was found to be significantly higher than that of the reminded CS+ (< 0.05). Thus, retrieval-extinction during reconsolidation window only attenuates the fear memory of the reactivated cue.
Our findings demonstrated that the reconsolidation update mechanism is effective for attenuating remote fear memories, and that this mechanism is selective to the reactivated cue of remote memories. We provide evidence to support the ongoing efforts in the development of novel strategies to combat remote pathogenic memories, which we think could lead to a more effective application of the reconsolidation update mechanism.
remote memory reconsolidation; cue specificity; conditioned fear; retrieval-extinction
10.3724/SP.J.1041.2019.00316
2017-12-05
* 国家自然科学基金(31771218), 广东省自然科学基金博士科研启动基金资助(2018A030310661), 中国博士后科学基金第64批面上项目资助(2018M640791)。
胡静初和张蔚欣同为第一作者
郑希付, E-mail: zhengxf@scnu.edu.cn
B845

