石莼多糖部分降解工艺优化
许雅楠,吕 峰,李燕妹
(福建农林大学食品科学学院,福建 福州 350002)
随着对多糖构-效关系研究的不断深入,发现对天然多糖进行分子修饰及结构改造有助于改善其生物活性[1]。针对多糖分子的修饰主要采用包括基团修饰(硫酸化、甲基化)、部分降解修饰等方法。天然多糖的分子量大小与其生物活性密切相关。通常,一定程度地降低多糖分子量可提高其生物活性及利用率[2-3],并可满足医药[4]、食品[5]等领域的应用要求;但当多糖分子量过低时,其活性聚合结构无法形成[6],生物活性反而下降[7-8]。因此本研究选择50%为目标降解率,既保证天然多糖分子量有效降低,又避免无价值小分子糖的大量生成。
本研究采用稀硫酸降解法,对石莼多糖进行部分降解,以50%为目标降解率,分别探讨了硫酸溶液浓度、降解温度、多糖浓度与降解时间对石莼多糖降解率的影响,并采用三因素三水平响应面分析法对石莼多糖部分降解工艺进行优化,以期为天然石莼多糖综合开发与深加工利用提供理论参考。
1 材料与方法
1.1 石莼多糖制备材料与试剂
称取一定质量石莼干粉,加入30倍质量蒸馏水,调节溶液pH值为4.8;按400 U/g石莼干粉添加经活化的纤维素酶,于45℃下恒温提取90 min,灭酶、离心,收集上清液,真空浓缩;加入4倍体积的95%乙醇,冷藏过夜,离心、收集乙醇沉淀物,加水复溶,真空浓缩,冷冻干燥,得石莼多糖粗品(多糖含量为35.62%)。
1.2 仪器与设备
UV-1800PC型紫外分光光度计:上海美谱达仪器有限公司;RE52-99型旋转蒸发仪:上海亚荣生化仪器厂;SHB-III型真空泵:郑州长城科工贸有限公司;DL-5-B离心机:上海安亭科学仪器厂;JB-90-2磁力搅拌器:上海天平仪器厂。
1.3 试验内容与方法
1.3.1 石莼多糖部分降解工艺流程
称取石莼多糖,加入预热的稀硫酸溶液,恒温酸解,冰浴冷却,4 000 rpm离心5 min,取上清液,调pH至中性,定容,测定其总糖、还原糖含量,样液于500 Da透析袋中流水透析48.0 h, 真空浓缩(0.95 MPa,45℃)使其体积约为原体积的5%,最后冷冻干燥,收集降解样品。
1.3.2 评价指标
张竞男[9]论证了以“还原糖的相对含量”作为多糖降解程度考察指标的可行性,故本试验采用还原糖相对含量(记为降解率)为衡量指标,计算方法如公式(1)。
(1)
式中,A:待测样液的总糖含量;A0:待测样液的还原糖初始含量;A1:待测样液降解后的还原糖含量。
还原糖含量采用DNS(3,5-二硝基水杨酸)法测定;总糖含量采用硫酸-苯酚法测定。
1.3.3 单因素试验设计
以硫酸溶液浓度(0.05、0.10、0.30、0.50、0.70 mol/L)、降解温度(60、70、80、90、100℃)、多糖浓度(1、5、10、15、20 mg/mL)、降解时间(0.5、1.0、1.5、2.0、2.5 h)4个因素进行单因素试验,研究各因素对石莼多糖降解效果的影响。
1.3.4 响应面试验设计
在单因素试验基础上,以硫酸溶液浓度(X1)、降解温度(X2)、多糖浓度(X3)为自变量,石莼多糖降解率(Y1)为响应值,采用三因素三水平响应面分析法,对石莼多糖样品的部分降解关键工艺条件进行优化,试验因素与水平表如表1。

表1 Design Expert试验因素与水平表
1.3.5 统计分析
试验数据采用DPS v7.05进行方差分析,各数据间多重比较采用Duncan新复极差法,Microsoft Excel 2007软件绘图。显著性界值以P>0.05为不显著,P<0.05为显著,P<0.01为极显著。采用Design Expert v 8.0对优化试验数据进行响应面分析,并对各因素回归拟合。
2 结果与分析
2.1 硫酸溶液浓度对石莼多糖降解率的影响
在酸性条件下,H+与多糖分子上O原子的结合,使多糖的分子链变得极不稳定,导致糖苷键断裂,从而达到降解多糖的效果[10]。如图1所示,在本研究所设的硫酸溶液浓度范围内,石莼多糖样品的降解率均随硫酸溶液浓度的增大而极显著(P<0.01)提高。当硫酸溶液浓度为0.3~0.5 mol/L时,石莼多糖的降解率范围为(44.61±0.17)%~(57.87±0.78)%。故本研究选择0.3~0.5 mol/L为石莼多糖部分降解的适宜硫酸溶液浓度范围。
2.2 降解温度对石莼多糖降解率的影响
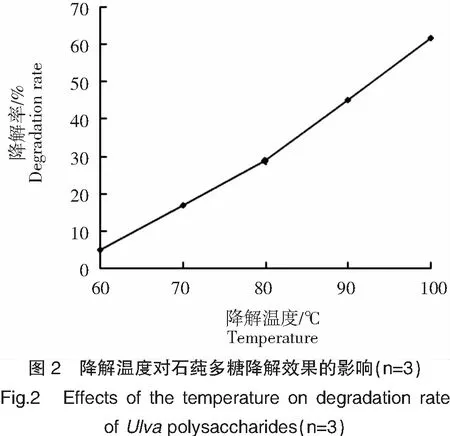
温度的升高加快了反应体系中分子的运动,反应活化能降低,反应更易发生[11]。如图2所示,在本研究所设的降解温度范围内,石莼多糖的降解率随降解温度的升高而极显著(P<0.01)提高。当降解温度为90~100℃时,石莼多糖的降解率范围为(45.33±0.30)%~(61.97±0.06)%。故本研究选择90~100℃为石莼多糖样品部分降解的适宜降解温度范围。

2.3 多糖浓度对石莼多糖降解率的影响
如图3所示,在本研究的多糖浓度范围内,石莼多糖降解率随多糖浓度的增大而呈先上升后下降趋势。多糖浓度在5 mg/mL范围内,石莼多糖的降解率随多糖浓度的增大而极显著(P<0.01)提高;当多糖浓度为5 mg/mL时,其降解率达到最大值,为(48.02±0.76)%;而多糖浓度超过5 mg/mL后,其降解率显著(P<0.05)下降。这是因为当酸溶液浓度一定且多糖浓度比较低时,多糖分子不足,其O原子未能与H+充分反应,此时降解率与多糖浓度呈正相关关系;但当多糖浓度超过一定水平后,体系黏度提高、分子流动性下降,反而阻碍多糖分子中O原子与H+反应,故其降解率反而下降。故本研究选择5 mg/mL为石莼多糖部分降解的适宜溶液多糖浓度。

2.4 降解时间对石莼多糖降解率的影响
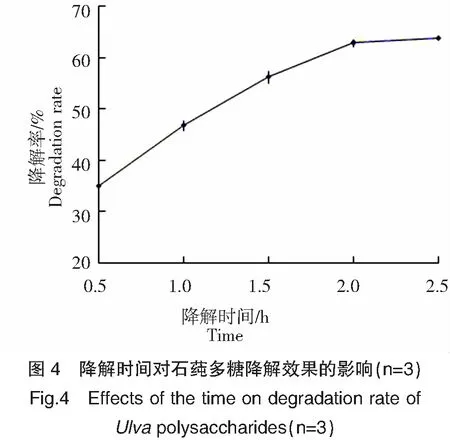
如图4所示,在降解时间2.0 h内,石莼多糖的降解率随降解时间的延长而极显著(P<0.01)提高;在超过2.0 h后,其降解率上升趋势减缓,但仍显著(P<0.05)提高。这是因为降解反应初期,降解时间的延长使反应充分,多糖降解率也随之增大,但由于酸溶液会优先降解表面结构上容易水解的糖苷糖,如支链糖苷键、α-糖苷键、呋喃糖的糖苷键等[12],而被包埋在多糖分子内部的糖苷糖[13]不易水解,从而导致在降解一定时间后,多糖的降解率增加幅度变小。降解时间在1.0~1.5 h范围内,石莼多糖的降解率范围为(46.85±0.98)%~(56.35±1.20)%,故本研究选择1.0~1.5 h为石莼多糖部分降解的适宜降解时间。
2.5 石莼多糖部分降解关键工艺优化
2.5.1 方程回归及方差分析
采用Design Expert.v 8.0数据处理系统对表2的数据进行处理分析,分别建立石莼多糖降解率(Y1)与硫酸溶液浓度(X1)、降解温度(X2)、多糖浓度(X3)的数学回归方程,删除方程中P>0.05的不显著系数项,得到简化的数学回归方程式(2):
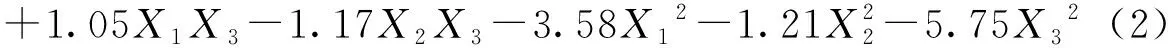
式中自变量取各代码值,因变量取计算值,由回归方程(2)可分别计算出石莼多糖降解率(Y1)值。表3回归方程的方差分析数据显示,方程回归极显著(P<0.01),失拟项不显著(P>0.05),相关系数R2大于0.990 0,表明回归方程有意义且拟合度良好。数据还显示,X1X2(硫酸溶液浓度与降解温度)、X1X3(硫酸溶液浓度与多糖浓度)、X2X3(降解温度与多糖浓度)的交互作用均极显著(P<0.01)影响石莼多糖降解率(Y1)。
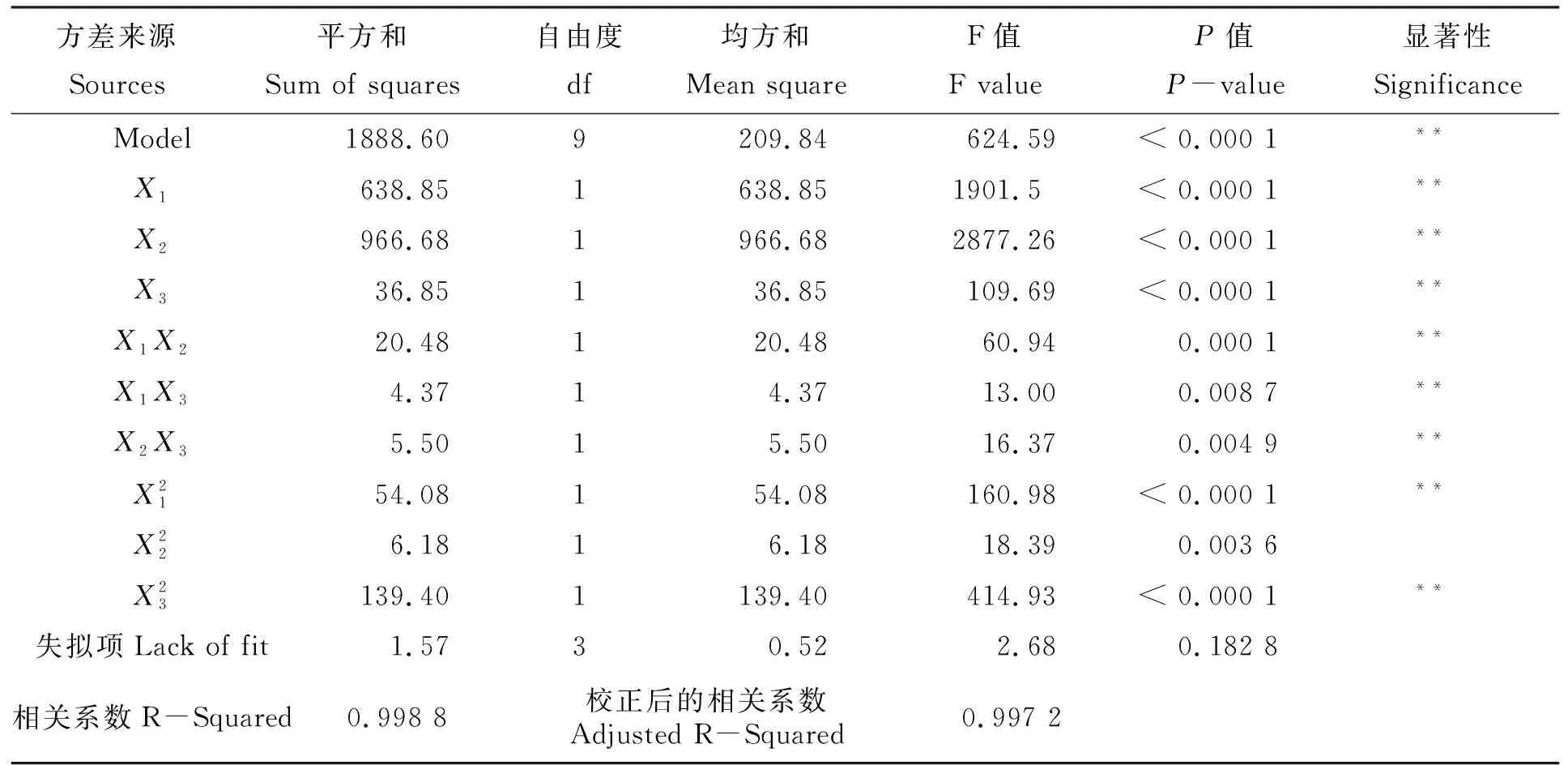
表3 方差分析表
注:*、**分别表示在α为0.05、0.01水平显著。
Notes:*was significant difference,**was extremely significant difference.
2.5.2 因素间的交互效应分析
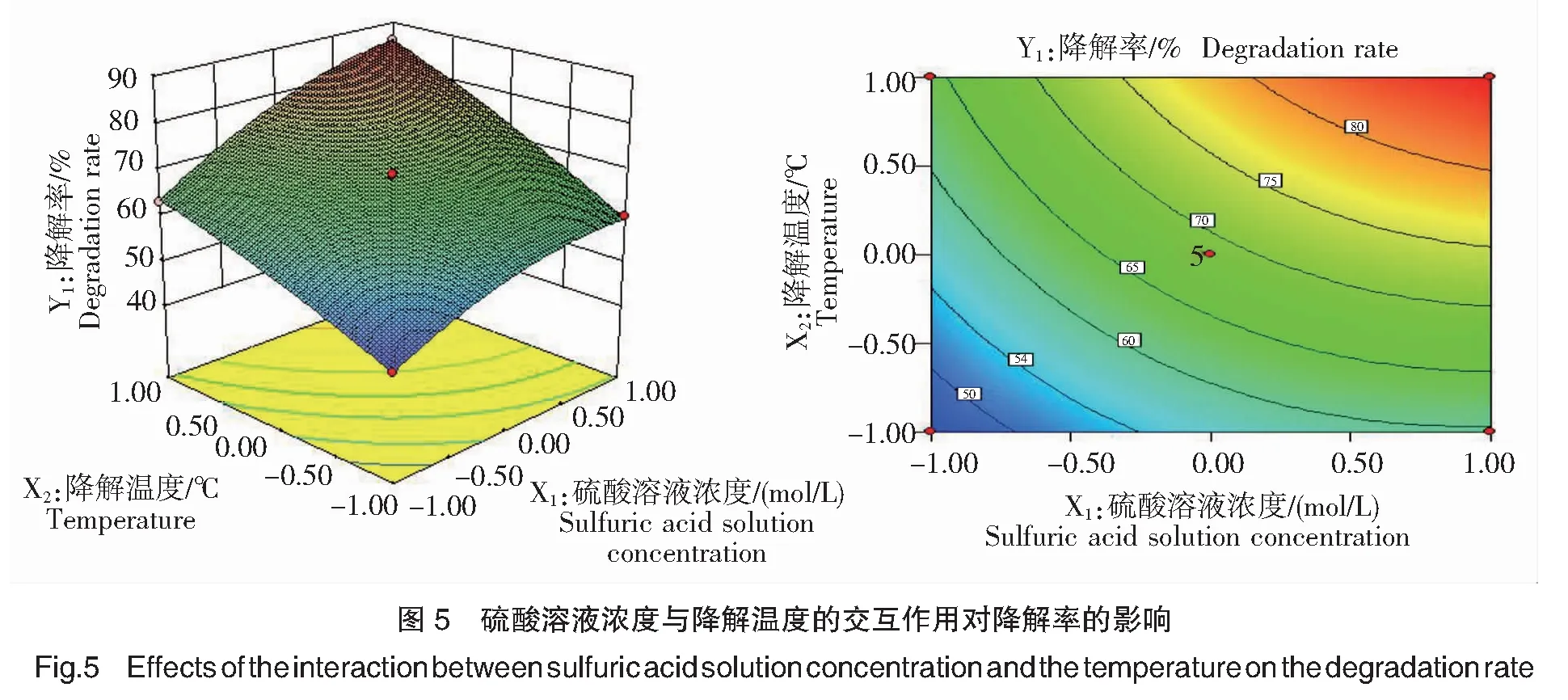
根据回归方程(2),分别得到硫酸溶液浓度(X1)、降解温度(X2)、多糖浓度(X3)对石莼多糖降解率(Y1)影响的响应面图和等高线图,如图5~7所示。
由图5可知,当降解液的多糖浓度(X3)固定于0水平(5 mg/mL)时,在本试验范围内,X1X2(硫酸溶液浓度与降解温度)的交互作用与石莼多糖降解率(Y1)呈显著(P<0.05)正相关关系;当硫酸溶液浓度(X1)与降解温度(X2)均为1.0水平(0.50 mol/L、100℃)时,石莼多糖降解率(Y1)达到最大值。
由单因素试验2.1、2.2结果分析可知,硫酸溶液浓度的提高可促进H+与多糖分子上O原子结合,从而促进多糖的降解,与此同时,温度的升高增大了酸解液体系中的分子动能,H+与多糖分子碰撞机率增大,因此当硫酸溶液浓度与降解温度均提高时,二者的协同作用使石莼多糖降解率显著提高。
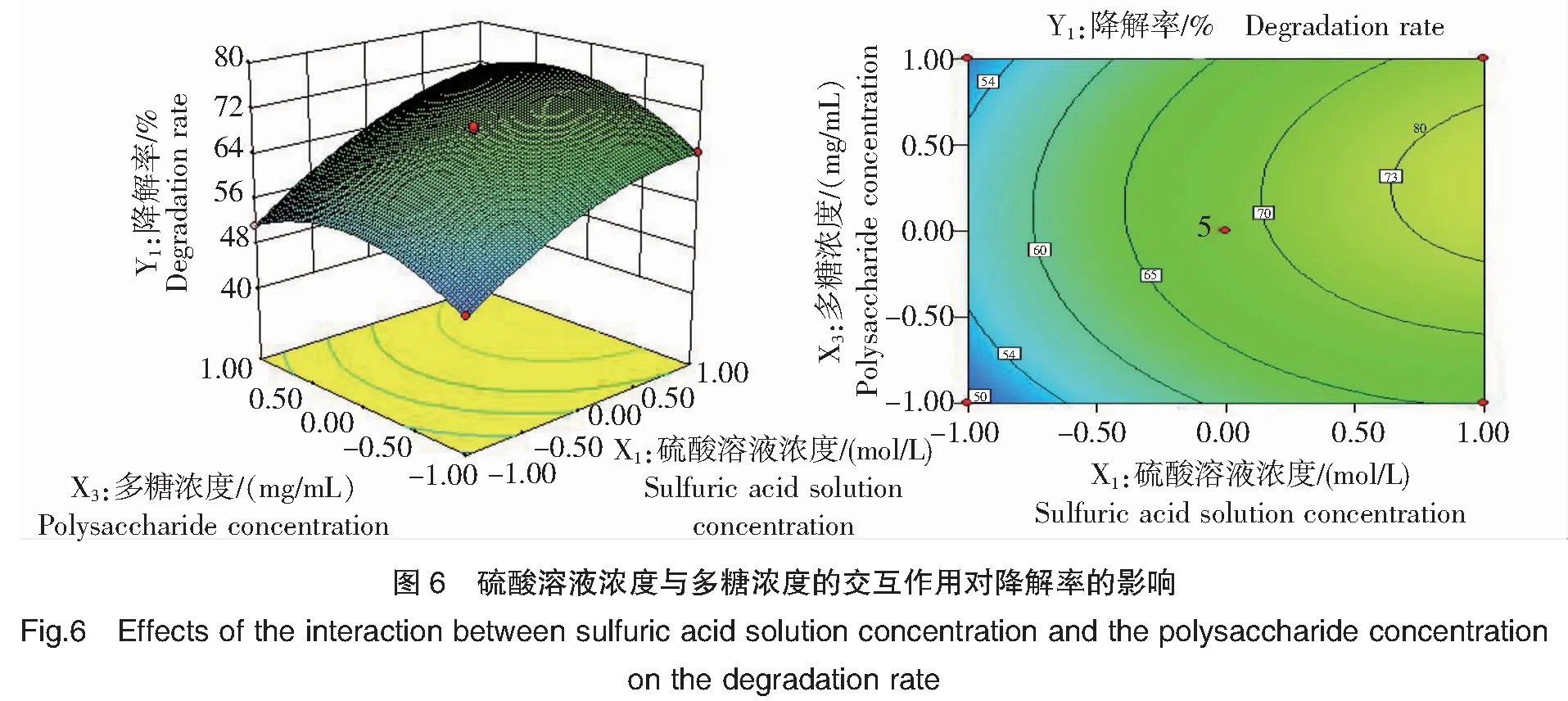
由图6可知,当降解温度(X2)固定于0水平(90℃)时,硫酸溶液浓度(X1)在1.0水平(0.50 mol/L)、多糖浓度(X3)在0水平(5 mg/mL)范围内,二者的交互作用与石莼多糖粗品的降解率(Y1)呈显著(P<0.05)正相关关系;当硫酸溶液浓度(X1)在1.0水平(0.50 mol/L)、多糖浓度(X3)在0水平(5 mg/mL)时,石莼多糖粗品降解率(Y1)达到最大值;而当硫酸溶液浓度(X1)大于1.0水平(0.50 mol/L)、多糖浓度(X3)大于0水平(5 mg/mL)后,二者的交互作用与石莼多糖粗品降解率(Y1)呈显著(P<0.05)负相关关系。
由单因素试验2.1、2.3结果分析可知,硫酸溶液浓度与多糖浓度的适当提高均可促进H+与多糖分子上O原子结合,从而促进多糖的降解,二者协同作用使石莼多糖粗品降解率显著提高;而当多糖浓度过高时,酸解液体系黏度增大、分子流动性下降,H+与多糖分子上O原子结合受阻,故二者的交互作用与石莼多糖粗品降解率呈负相关关系。
由图7可知,当硫酸溶液浓度(X1)固定于0水平(0.40 mol/L)时,降解温度(X2)在1.0水平(100℃)、多糖浓度(X3)在0水平(5 mg/mL)范围内,二者的交互作用与石莼多糖粗品的降解率(Y1)呈极显著(P<0.01)正相关关系;当降解温度(X2)与多糖浓度(X3)分别为1.0、0水平(100℃、5 mg/mL)时,石莼多糖粗品降解率(Y1)达到最大值;而当降解温度(X2)大于1.0水平(100℃)、多糖浓度(X3)大于0水平(5 mg/mL)后,X2X3交互作用与石莼多糖粗品降解率(Y1)呈极显著(P<0.01)负相关关系。
由单因素2.2、2.3的结果分析可知,降解温度的升高增大了酸解液体系中的分子动能,H+与多糖分子碰撞机率增大,促进降解,与此同时,多糖浓度的适当提高亦可促进H+与多糖分子接触,因此在一定范围内,降解温度与多糖浓度均提高时,二者协同作用使石莼多糖粗品降解率显著提高;而当多糖浓度过高时,酸解液体系的黏度显著增大,体系中分子流动性下降,H+与多糖分子结合受阻,该现象产生的结果超过温度提高导致的分子动能增加,因此当降解温度与多糖浓度均过高时,二者的交互作用与石莼多糖粗品降解率呈负相关关系。
2.5.3 工艺参数优化及验证试验
采用Design Expert.v 8.0软件求解回归方程(2),计算求得石莼多糖降解率(Y1)符合(50±1)%的优化工艺条件组合共42组,表4中分别体现了其部分工艺条件组合及其对应石莼多糖降解率的预测值。综合考虑透析周期、生产成本、节能与环保问题,并基于实际操作的便利性进行校正,确定石莼多糖部分降解的最优工艺条件组合为硫酸溶液浓度0.30 mol/L、降解温度95℃、多糖浓度7 mg/mL。为验证试验结果的客观性,根据修正条件进行扩大性验证试验,降解时间均为1.0 h,试验平行重复3次,测得石莼多糖的降解率平均值为50.94%,与其对应理论预测值50.45%无显著性差异(P>0.05)。
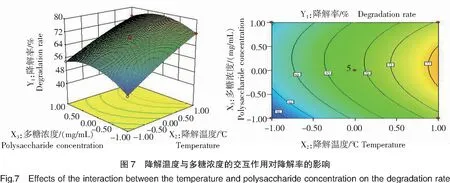
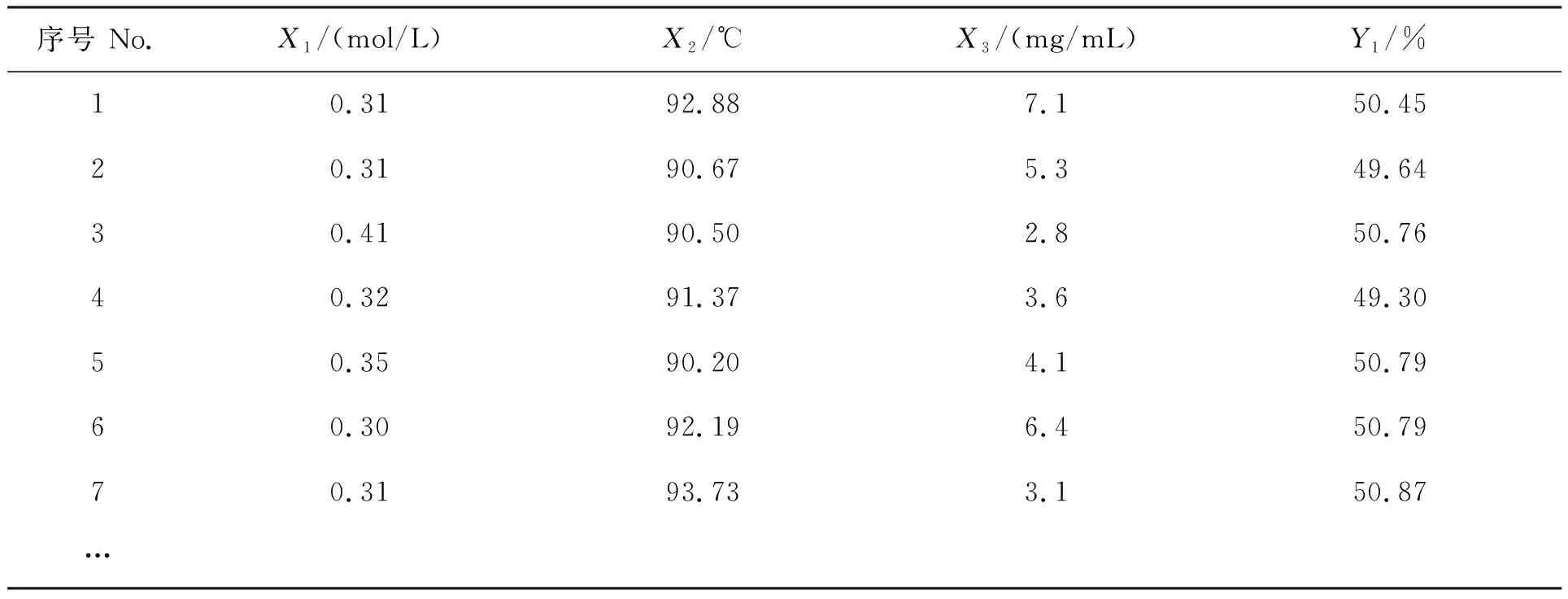
表4 最优工艺条件组合及降解率预测值
3 小结
本研究采用稀硫酸降解法,对石莼多糖进行部分降解,以50%为目标降解率,分别探讨了主要工艺因素对石莼多糖降解率的影响,并采用三因素三水平响应分析法对石莼多糖部分降解关键工艺参数进行优化。试验结果表明:校正后,石莼多糖部分降解的最优工艺条件组合为硫酸溶液浓度0.30 mol/L、降解温度95℃、多糖浓度7 mg/mL,在结合降解时间1.0 h的条件下,石莼多糖的平均降解率为50.94%。
综上所述,采用稀硫酸溶液对石莼多糖进行部分降解,结果稳定、周期短、工艺简单、易实现工业化,具有可行性。

