肉鸡谷胱甘肽S-转移酶A3基因的克隆及蛋白的表达和纯化
卢晓晓,杨世雄,李娜娜,张宁,李欣,宁官保,张鼎,赵宇军,闫芳,高荣琨,田文霞*
(1.山西农业大学 动物科技学院,山西 太谷 030801;2.温县农林局,河南 温县 454850)
谷胱甘肽硫转移酶(Glutathione S-Transferase,GSTs)是肝脏解毒的第二期家族酶,主要参与多种致癌物、环境毒素和氧化应激产物的解毒,GSTA3是GSTs超家族中α家族的一员, GSTA3具有3种转录物,说明GSTA3基因功能的多态性可能通过改变蛋白的表达水平或蛋白功能来影响类固醇的生成。GSTA3是人体内非常有效的双键异构酶,在类固醇生成的组织中选择性地表达,并参与类固醇生物的合成过程[1~3]。在体外试验中证明了GSTA3具有抗氧化功能[4]。关于解毒方面,有研究显示成年小鼠体内的GSTA3亚基在黄曲霉毒素B1(AFB1)代谢的过程中非常活跃[5,6]。
本试验拟采用原核表达技术对肉鸡GSTA3基因进行克隆,并连接至pET-28a,转入E.coliBL21(DE3)中后进行蛋白表达。用镍柱亲和层析法纯化GSTA3融合蛋白,并进行SDS-PAGE、Western Blot以及活性的鉴定。以期得到GSTA3融合蛋白,为后续的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验动物、菌株和质粒
10日龄健康艾维茵肉鸡3只,购于山西省文水县大象农牧集团有限公司。E.coliDH5α,E.coliBL21(DE3),pET-28a原核载体由实验室保存。ZeroBack Fast Ligation Kit购于天根生化科技有限公司。
1.1.2 主要试剂
prime script TM RT Reagent Kit、PrimeSTAR HS DNA Polymerase购于大连宝生物工程公司; 2*PCR MIX购于中科瑞泰生物科技有限公司;SYBR Green Ⅰ、AMPicillin购于北京索莱宝科技有限公司;硫酸卡那霉素、IPTG、TEMED、预染中低分子量蛋白Marker、羊抗小鼠IgG-FITC、显影粉、定影粉、咪唑购于北京索莱宝生物科技有限公司;XhoⅠ、EcoRⅠ购于美国NEB公司;T4 DNA Ligase购于北京全式金生物技术有限公司;SDS、考马斯亮蓝R-250、甘氨酸购于北京博奥拓达科技有限公司;蛋白干粉、NC膜、超敏ECL化学发光即用型底物购于武汉博士德生物工程有限公司;Anti-6×His tag® antibody购于Abcam公司;谷胱甘肽-S转移酶活性测定试剂盒购于南京建成生物工程研究所。
1.2 方法
1.2.1 GSTA3基因的克隆
取3只10日龄肉雏鸡断颈处死,取胫骨生长板,做好标记,立刻置于液氮中,次日放入-80 ℃冰箱保存。采用Trizol法提取肉鸡胫骨软骨生长板总RNA。采用prime script TM RT Reagent Kit反转录后获得cDNA。
依据NCBI中核酸数据库公布的鸡GSTA3 mRNA序列,序列号NM_001001777.1,运用Oligo 6软件设计引物,包括EcoRⅠ和XhoⅠ酶切位点,目的片段大小690 bp,由上海捷瑞生物工程有限公司合成。
以cDNA为模板进行PCR扩增,PCR具体程序为94 ℃预变性3 min, 98 ℃变性10 s,66 ℃退火5 s,72 ℃延伸l min,共30个循环,72 ℃总延伸5 min,4 ℃保存。配制2.0%的琼脂糖凝胶,电泳检测目的片段。
1.2.2 GSTA3表达质粒的构建和鉴定
将扩增产物与pZeroBack/blunk克隆质粒连接,转入感受态大肠杆菌DH5α,获得重组质粒pZeroBack/Blunk-GSTA3测序鉴定。
将测序正确的质粒pZeroBack/Blunk-GSTA3和表达质粒pET-28a用EcoRⅠ、XhoⅠ进行双酶切,双酶切片段经2.0%琼脂糖凝胶电泳,在紫外灯下割胶回收目的产物及pET-28a,用T4 DNA Ligase将双酶切纯化后的GSTA3基因与线性pET-28a质粒连接,并转化入感受态E.coliBL21(DE3),涂到含KAN的LB板上,筛选单克隆菌落,将提取质粒测序鉴定。鉴定正确的重组质粒命名为pET-28a-GSTA3,用于诱导表达。
1.2.3 GSTA3重组蛋白的诱导表达及条件优化
将含pET-28a-GSTA3重组质粒的E.coliBL21(DE3)接种至含KAN的液体LB培养基,37 ℃过夜培养。取菌液,以1∶100的比例转接于液体LB培养基中,待其长到OD600=0.5~0.7,设置IPTG浓度0.2、0.4、0.6、0.8、1.0 mM,37 ℃,220 r·min-1震荡诱导12 h,取样2 mL;设置温度为25、30、37 ℃,IPTG终浓度为1.0 mM,在220 r·min-1震荡12 h,取样2 mL;设置IPTG终浓度为1.0 mM,温度为30 ℃,220 r·min-1震荡6,12,21 h时各取样2 mL;超声处理上述样品,离心收集上清, SDS-PAGE蛋白电泳检测表达量。
1.2.4 GSTA3重组蛋白的纯化
按优化后条件进行大量诱导表达,取诱导的菌液,超声处理样品(冰水中),4 ℃离心吸取上清,4 ℃保存以待纯化。纯化步骤具体操作按照Ni SepharoseTM6 Fast Flow说明书进行。采用10、20、30、40、50 mmol·L-1梯度浓度咪唑洗脱杂蛋白,采用500 mmol·L-1将目的蛋白洗脱下来,再经低温透析得到纯蛋白。
1.2.5 GSTA3重组蛋白纯化产物的免疫印迹验证
SDS-PAGE电泳后切取含目的蛋白GSTA3的凝胶,然后进行转膜,采用丽春红染色检验是否转膜成功。将转膜后的印迹膜放入5%脱脂奶粉中,37 ℃,80 r·min-1震荡2 h,后4 ℃封闭过夜。弃掉封闭液,加入TBST震荡清洗印迹膜,重复2次。将印迹膜转移至1∶1 000比例稀释好的Anti-6×His-Tag标签抗体(稀释液:TBST)中,37 ℃震荡反应4 h。回收Anti-6×His-Tag标签抗体,4 ℃保存。向孵育盒中加入TBST,震荡清洗印迹膜,如此重复3次。将印迹膜转移至1∶5 000比例稀释好的羊抗小鼠IgG-FITC抗体(稀释液:TBST)中,37 ℃震荡反应1 h。弃掉二抗,向孵育盒中加入TBST震荡清洗印迹膜,重复3次。配置发光工作液,取适当大小的保鲜膜,取出印迹膜,置于保鲜膜中央,加入工作液完全覆盖印迹膜,盖上保鲜膜置于暗盒,盖上暗盒曝光,之后进行显影定影,观察结果。
1.2.6 GSTA3重组蛋白纯化产物活性检测
使用谷胱甘肽-S转移酶测定试剂盒检测蛋白活性。
2 结果
2.1 GSTA3基因的扩增结果
在600~1 000 bp之间出现特异性单一条带,与预期的690 bp分子大小相一致(图1)。
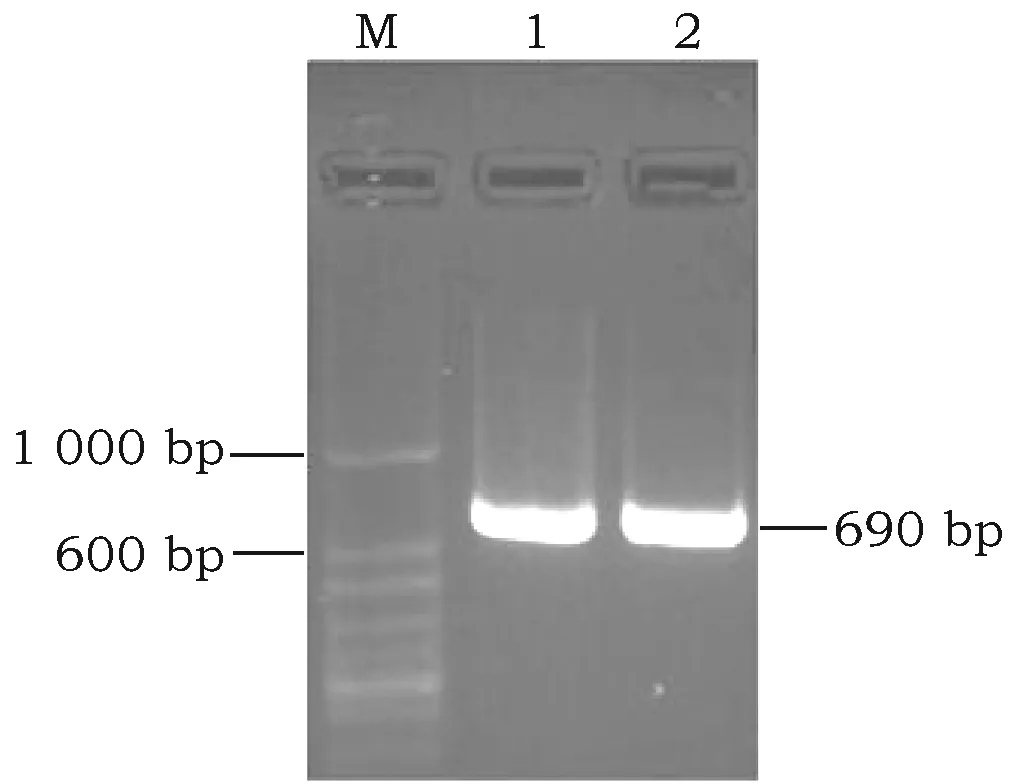
图1 RT-PCR产物琼脂糖凝胶电泳Fig.1 RT-PCR product detected by agarose gel electrophoresis注:M: 50 bp plus DNA Ladder; 1,2: RT-PCR产物。Note:M: 50 bp plus DNA Ladder; 1,2: Products of RT-PCR.
2.2 pZeroBack/Blunk-GSTA3克隆质粒的序列测定
菌液PCR为阳性的菌液提取质粒后测序,经北京华大科技有限公司测序结果显示,序列同源性99%,氨基酸未发生突变,表明克隆成功。
2.3 表达质粒pET-28a和pZeroBack/Blunk-GSTA3双酶切结果
表达质粒pET-28a和重组克隆质粒pZeroBack/Blunk-GSTA3经EcoRⅠ和XhoⅠ双酶切,2%琼脂糖凝胶电泳结果显示有3条特异性条带,其中一条位于600~1 000 bp之间,与预期690 bp分子大小相一致,其余2条分别为未被切开环状质粒和被切开线性质粒(图2);表达质粒pET-28a的双酶切结果(图3)。

图2 pZeroBack/Blunk-GSTA3酶切鉴定Fig.2 ldentification of pZeroBack/Blunk-GSTA3 digestion 注:M: 50 bp plus DNA Ladder; 1: pZeroBack/Blunk-GSTA3质粒酶切。Note:M: 50 bp plus DNA Ladder;1: Digestion of pZeroBack/Blunk-GSTA3 plasmid.

图3 pET-28a酶切鉴定Fig.3 ldentification of pET-28a digestion注:M: 50 bp plus DNA Ladder; 1,2,3,4: pET-28a质粒酶切。Note:M: 50 bp plus DNA Ladder; 1,2,3,4: Digestion of pET-28a plasmid
2.4 阳性重组表达质粒pET-28a-GSTA3 E. coli BL21(DE3)的筛选结果
表达质粒pET-28a和pZeroBack/Blunk-GSTA3经EcoRⅠ和XhoⅠ双酶切纯化后的产物过夜连接后转化E.coliBL21(DE3),挑取单菌落菌液进行PCR鉴定。选取PCR阳性的菌液提取质粒测序。测序结果表明序列正确,说明重组质粒pET-28a-GSTA3E.coliBL21(DE3)构建成功。
2.5 GSTA3融合蛋白的诱导表达
2.5.1 GSTA3融合蛋白的诱导表达的结果
将带有空质粒pET-28aE.coliBL21(DE3)和重组质粒pET-28a-GSTA3E.coliBL21(DE3)同时在37 ℃,220 r·min-1,0.8 mM IPTG诱导下培养12 h,进行SDS-PAGE电泳,结果显示含重组质粒pET-28a-GSTA3的E.coliBL21(DE3)的未诱导组和诱导组在相对分子量29.6 kDa处均出现一条特异蛋白带,与预期的分子量大小相等,同时在上样量体积相同的情况下,重组诱导组较重组未诱导组表达量多(图4)。

图4 GSTA3融合蛋白SDS-PAGE凝胶电泳图Fig.4 The picture of GSTA3 fusion protein detected by SDS-PAGE gel electrophoresis 注:M: 蛋白Marker; 1、2: pET-28a未诱导组和诱导组; 3、4: pET-28a-GSTA3未诱导组和诱导组。Note:M: protein Marker; 1, 2: pET-28a group without IPTG and with IPTG; 3, 4: pET-28a-GSTA3 without IPTG and with IPTG.
2.5.2 GSTA3融合蛋白表达的可溶性判断
取2 mL诱导菌液,经超声击碎处理离心,获得的含可溶性蛋白的裂解上清和含不溶性蛋白的沉淀进行SDS-PAGE电泳,分析GSTA3融合蛋白在裂解上清和沉淀中的分布情况,结果显示GSTA3融合蛋白在裂解上清和沉淀中均有分布,在相同上样体积的情况下,GSTA3融合蛋白在上清中的表达也较多(图5)。
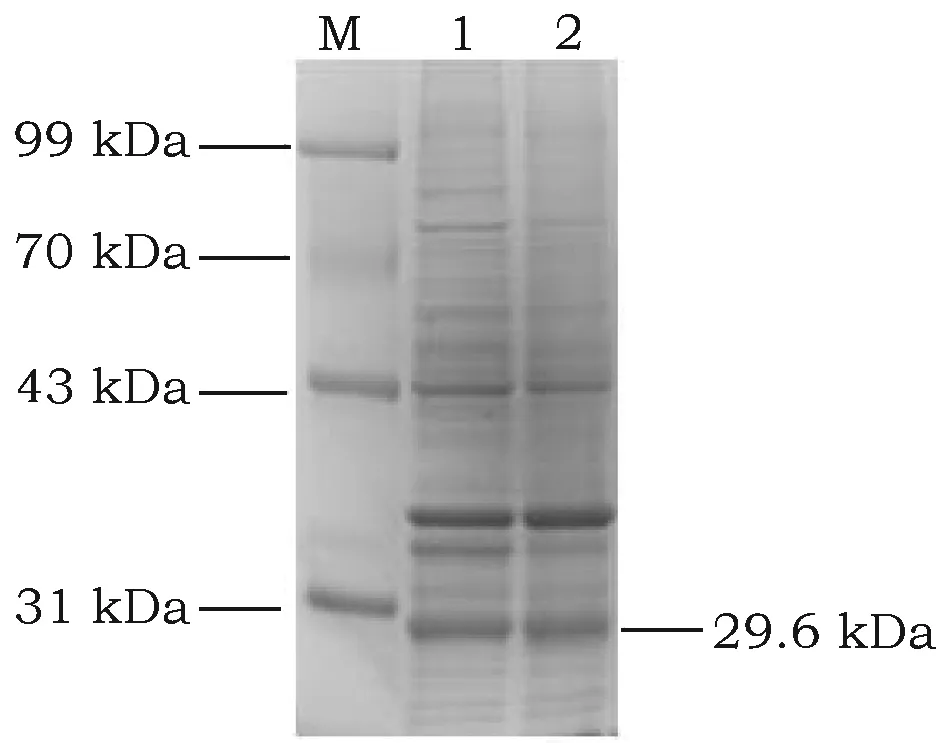
图5 GSTA3融合蛋白在E. coli BL21中的定位分析的SDS-PAGE凝胶电泳图Fig.5 Analysed the position of GSTA3 protein in BL21 detected by SDS-PAGE gel electrophoresis注:M: 蛋白Marker; 1: 菌液裂解上清; 2: 菌液裂解沉淀。Note:M: protein Marker; 1: Microbial supernatant; 2: Microbial precipitation.
2.5.3 不同浓度的IPTG对GSTA3融合蛋白表达的影响
在不同浓度的IPTG诱导情况下,SDS-PAGE电泳结果显示随着IPTG浓度的增加,含重组表达质粒pET-28a-GSTA3的E.coliBL21(DE3)宿主菌表达效果越好,IPTG终浓度为1.0 mM时表达最多(图6)。
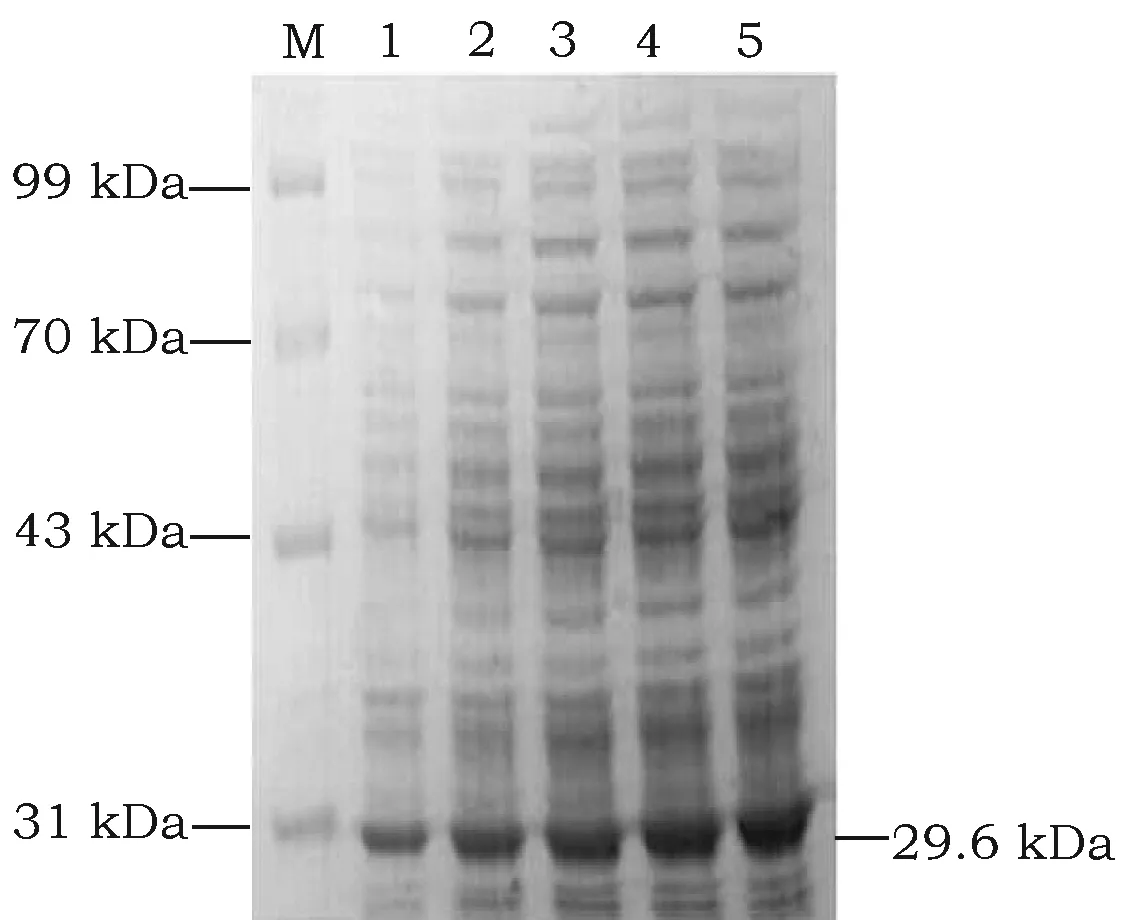
图6 不同浓度IPTG诱导的GSTA3融合蛋白SDS-PAGE凝胶电泳图Fig.6 The picture of GSTA3 fusion proteins induced by different concentration IPTG注:M: 蛋白Marker; 1~5: 0.2 mM、0.4 mM、0.6 mM、0.8 mM、1.0 mM IPTG诱导组。Note:M: protein Marker; 1~5: The groups with 0.2 mM, 0.4 mM, 0.6 mM, 0.8 mM, 1.0 mM IPTG.
2.5.4 不同温度的诱导对GSTA3融合蛋白表达的影响
在不同温度的诱导下,含重组表达质粒pET-28a-GSTA3的E.coliBL21(DE3)的蛋白表达的SDS-PAGE电泳结果显示在25 ℃时,GSTA3融合蛋白在上清中几乎不表达,在30 ℃和37 ℃时,GSTA3融合蛋白在上清中表达量较高(图7)。

图7 不同温度诱导的GSTA3融合蛋白SDS-PAGE凝胶电泳图Fig.7 The GSTA3 fusion proteins induced by different temperature注:M: 蛋白Marker; 1: 25 ℃诱导组; 2: 30 ℃诱导组; 3: 37 ℃诱导组。Note:M: protein Marker; 1: the group at 25 ℃; 2: The group at 30 ℃; 3: The group at 37 ℃.
2.5.5 不同时间的诱导对GSTA3融合蛋白表达的影响
含重组表达质粒pET-28a-GSTA3的E.coliBL21(DE3)不同时间的蛋白诱导表达的SDS-PAGE电泳结果显示在诱导后6 h,GSTA3融合蛋白在上清中几乎不表达,在21 h时,GSTA3融合蛋白在上清中表达量相对较高(图8)。
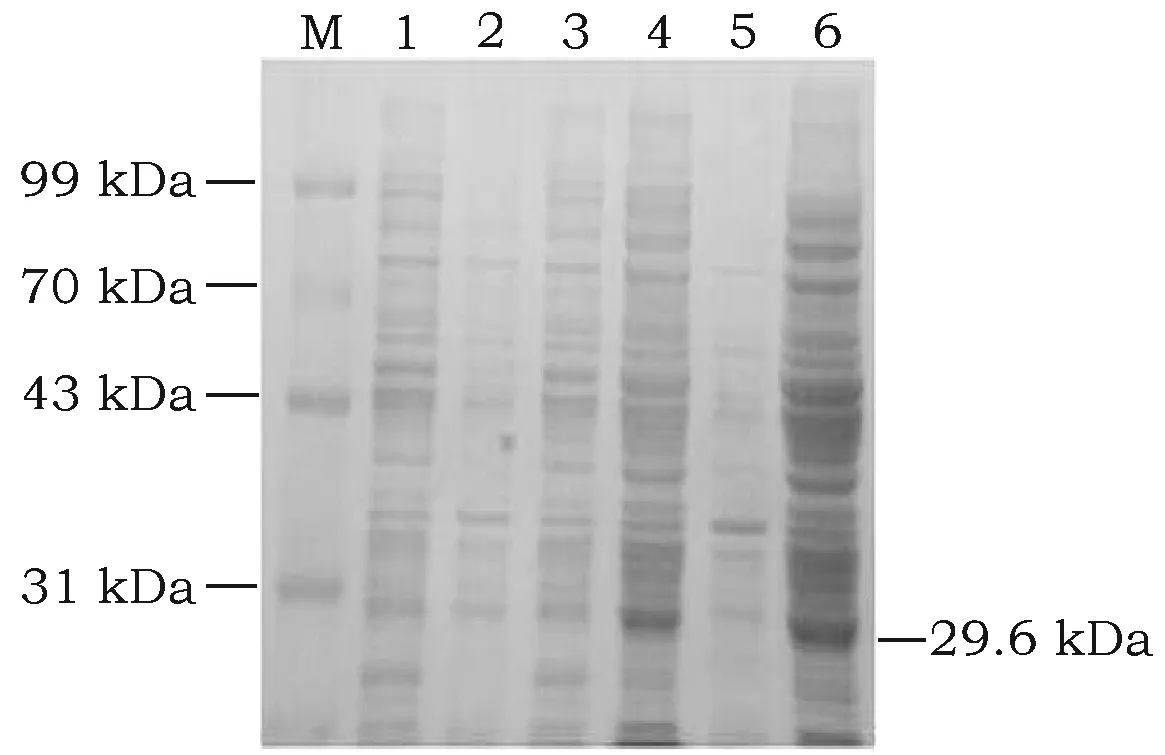
图8 不同时间段诱导的GSTA3融合蛋白SDS-PAGE凝胶电泳图Fig.8 The picture of GSTA3 fusion proteins induced by different time注:M: 蛋白Marker; 1、2: 未诱导和诱导6 h组; 3、4: 未诱导和诱导12 h组; 5、6: 未诱导和诱导21 h组。Note:M: protein Marker; 1, 2: expressing 6 h group without IPTG and with IPTG; 3, 4: expressing 12 h group without IPTG and with IPTG; 5, 6: expressing 21 h group without IPTG and with IPTG.
2.5.6 免疫印迹鉴定GSTA3融合蛋白
含表达质粒pET-28a的E.coliBL21(DE3)和含重组表达质粒pET-28a-GSTA3的E.coliBL21(DE3)诱导后取裂解上清和沉淀经SDS-PAGE电泳、转膜后,与1∶1000的His-Tag标签抗体进行Western Blot分析,结果显示含重组表达质粒pET-28a-GSTA3的E.coliBL21(DE3)诱导组和未诱导组均出现单一特异性条带(图9)。
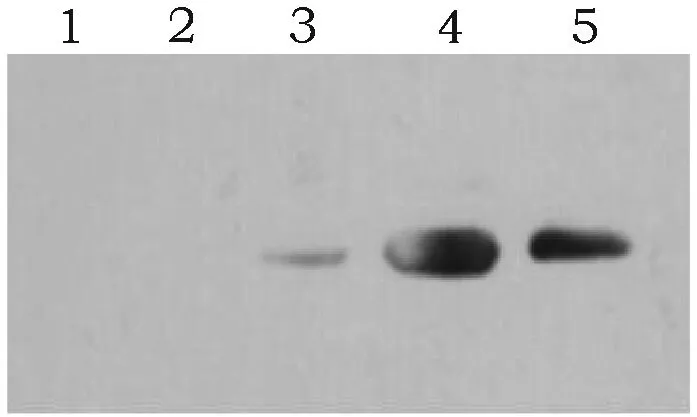
图9 GSTA3融合蛋白Western Blot鉴定结果Fig.9 The identification result of GSTA3 fusion protein by Western Blot注:1、2: pET-28a未诱导组和诱导组; 3~5: pET-28a-GSTA3未诱导组、诱导组上清部分和沉淀部分。Note:1, 2: pET-28a group without IPTG and with IPTG; 3~5: pET-28a-GSTA3 group without IPTG, Supernatant and precipitation of pET-28a-GSTA3group with IPTG.
2.6 GSTA3融合蛋白的纯化
将GSTA3融合蛋白的裂解上清通过亲和层析法进行纯化,分别收集洗杂液,洗脱液,每管取20 μL进行SDS-PAGE电泳,最后结果显示咪唑终浓度为30 mM的洗杂液洗脱效果最好,咪唑终浓度为500 mM的Soluble Elution Buffer洗脱目的蛋白效果较好。
2.7 免疫印迹鉴定GSTA3融合蛋白纯化产物
GSTA3融合蛋白纯化产物经SDS-PAGE电泳、转膜后,与1∶1 000稀释的Anti-6×His-Tag标签抗体进行Western Blot分析,结果显示单一特异性蛋白带。
2.8 谷胱甘肽S-转移酶活性测定结果
根据试剂盒公式计算,重组表达的蛋白GSTA3具有生物活性。
3 讨论
谷胱甘肽S-转移酶(glutathione S-transferase;GSTs)是一类具有多种生物功能的酶。GSTs是机体解毒过程中的一个关键酶,调节二期细胞解毒。GSTs催化一系列外来化合物如医药、结合重金属、杀虫剂、除草剂、持久性有机污染物(POPs)和聚芳碳氢化合物(多环芳烃)。除了外源性底物,GSTs可催化结合多样化的内源化合物包括脂质过氧化的产物和氧化应激的下游产物即4-羟基壬烯酸(4HNE)和丙烯醛,DNA降解[7]。
有研究发现PC12细胞在亚致死浓度的LPS处理后GSTA3基因呈上调表达,其表达量是未处理PC12细胞表达量的60倍,同时GSTA3也可以提高其它GSTs活性[4]。GSTs抑制剂和GSTA3小干扰RNA可有效衰减机体的适应性保护反应;转录因子Nrf2是由LPS转录激活;此外,外周注射亚致死浓度的LPS也增加了小鼠大脑GSTs活性;综上表明,LPS在亚致死浓度通过激活转录因子Nrf2信号通路诱导GSTA3上调,从而刺激细胞适应性反应并提高PC12细胞的耐受性[4]。GSTA3还具有类固醇异构酶的活性,参与类固醇激素的合成例如雌激素,雄激素等。类固醇激素在骨的生长发育和重建方面起着非常重要的作用,过多的糖皮质激素可能会引发骨质疏松,而雄激素和雌激素对骨的生长具有保护的作用[8]。
本试验采用体外原核表达系统来表达肉鸡GSTA3。大肠杆菌是目前运用最为广泛、研究最深入、技术最成熟的表达系统,因为大肠杆菌生长速度快,表达效率高,遗传背景清晰,成本低,周期较短,可兼容多种抗体[9~12]。pET系列是当前运用最多的能够高效表达融合性表达的质粒。其质粒上含有His-tag标签,它的分子量较小,一般对目的蛋白的蛋白结构、理化性质及溶解性的影响较小,且纯化过程简便易行,能极大地缩短试验的时间。
影响外源蛋白表达效率的因素很多,例如表达质粒、宿主、培养基的pH、加入诱导剂的时机、合适的温度、时间的选择以及适当的诱导剂浓度等。本试验根据王智慧的研究[13]将工程菌培养至对数生长期OD600为0.5~0.7,然后添加诱导剂,降低了试验的盲目性,缩短了条件优化的时间。诱导大肠杆菌外源蛋白可溶性表达的因素有很多,除了宿主菌、表达质粒的选择外,在试验过程中还需不断地改变诱导的温度、时间以及诱导剂浓度等[14~16]。本试验通过超声破碎菌液后发现,GSTA3融合蛋白在上清中有表达,但是沉淀中也有,说明GSTA3融合蛋白有可溶性的存在,但同时还有部分包涵体。因此本试验试图通过优化培养条件以增加目的蛋白的上清表达量,从试验结果来看,当IPTG的终浓度是1.0 mmol·L-1时,目的蛋白GSTA3上清表达量最多;从诱导温度上来看,30 ℃和37 ℃目的蛋白上清表达量相当。本试验选择30 ℃进行诱导表达,因为降低温度可以降低菌体内酶系的活性,使得表达速率减慢[17]。从诱导时间结果上来看,21 h时可溶性GSTA3融合蛋白表达量较12 h多。有文献报道,当大肠杆菌再加入诱导剂后,菌体自身的大部分精力都集中在外源蛋白的表达上,这会导致大肠杆菌的衰亡期提前,如果长时间诱导,可能会出现溶菌的现象[18]。因此本试验选取的最佳诱导时间为12 h。综上所述,获得可溶性GSTA3融合蛋白的最佳条件为大肠杆菌生长至对数生长期即OD600=0.5~0.7,IPTG终浓度为1.0 mmol·L-1,30 ℃培养12 h。
从试验结果可以看出,未加IPTG的含重组表达质粒pET-28a-GSTA3的E.coliBL21(DE3)组中也有少量GSTA3的表达。有研究表明,LB培养基成分中的酵母粉可促使大肠杆菌的渗漏表达[19,20]。本试验采用的LB培养基中的一种成分是OXIOD酵母粉,推测本试验采用的产品里含有乳糖,这可能是大肠杆菌直接渗漏性表达的结果。
由于pET-28a表达质粒上自身带有6×His-tag标签,所以经超声破碎后的上清(可溶性蛋白)通过镍柱亲和层析法进行分离纯化[21]。最后的结果可以看出终浓度为30 mM咪唑的洗杂液洗杂蛋白效果较好,终浓度为500 mM咪唑的洗脱液洗脱目的蛋白的效果很好,所以在以后的蛋白分离纯化过程中选取终浓度为30 mM的咪唑洗杂蛋白,终浓度为500 mM咪唑洗的洗脱液洗脱目的蛋白以便取得纯度较高的目的蛋白,另外通过谷胱甘肽S-转移酶活性检测试剂盒检测确定了其具有生物学活性,这些试验条件的确定为后续进行的动物试验提供保障。
4 结论
本试验成功构建重组克隆质粒pZeroBack/Blunk-GSTA3和重组表达质粒pET-28a-GSTA3,当IPTG终浓度为1.0 mmol·L-1、30 ℃下诱导12 h时获得高效表达的可溶性GSTA3融合蛋白,并得以纯化,其大小为29.6 kDa,为后续研究奠定了一定的基础。

