两株禽绿脓杆菌的分离鉴定与致病性研究
翟晶晶,王珊,尹姣姣,韩丽娟,牛露露,牛宏泽,程倩倩,尹梦颖,车雨桐,张鼎,宁官保*,田文霞*
(1.山西农业大学 动物科技学院,山西 太谷 030801;2.闻喜县畜牧兽医发展中心,山西 闻喜 043800)
绿脓杆菌(Bacilluspyocyaners)1882年首次由Gersard从伤口脓液中分离得到,也被称铜绿假单胞菌(Pseudomonasaeruginosa)[1]。最近几十年,随着病情的加剧,由细菌引起的疾病主要体现为人口的急性暴发和死亡率升高,在医院内的感染也逐渐增多,尤其在呼吸科及重症监护病房(ICU)是首要病原菌[2],感染主要引起人的肺囊性纤维化,而对烧伤、泌尿道、伤口和血液感染的免疫功能低下患者更易被感染。绿脓杆菌是加拿大ICU患者的第三大易感病原菌[3]。经调查,多种动物均可感染绿脓杆菌, 临床上表现为雏鸡败血症、鹌鹑化脓性肝炎、水貂出血性肺炎[4]、獐子麝囊化脓[5]、长臂猿化脓性角膜炎等,绿脓杆菌是这些病的原发性或并发性病原[6]。1926年Kaupp和Dearstyne从禽类分离到绿脓杆菌,1982年傅先强分离出绿脓杆菌[7],当时就被列入传染病。绿脓杆菌对于鸡来说是条件性致病性菌,通常能在鸡的肠道、呼吸道和卵中分离到,各个年龄段都易感染,致死率在1%~90%甚至更多[8]。雏鸡暴发绿脓杆菌病应激是其中主要原因,免疫低下时更易感染,尤其现在集约化养殖规模的扩大,发病率更高[9]。为此,有必要在山西地区对禽绿脓杆菌的病原和流行情况做调查。
本试验对临汾、平遥等地患病死亡的病鸡,无菌采集病变脏器进行绿脓杆菌分离培养,形态鉴定,生化试验,16S rDNA序列分析,致病性动物试验,药敏试验,为研究其致病机理及临床禽绿脓杆菌病的治疗和控制提供理论基础。
1 材料与方法
1.1 病料来源
山西省临汾、平遥等地送检的28只病、死鸡。病鸡表现为精神沉郁和拉黄绿色粪便,死鸡剖检可见心尖、心外膜出血点,有的可见心脏被覆有淡黄色的纤维素性渗出物;肝脏局部颜色偏淡发黄;肾脏水肿,表面有弥漫的小出血点。
1.2 试验材料
细菌生化微量鉴定管和药敏纸片(杭州滨和微生物试剂有限公司);分离用培养基(北京索莱宝科技有限公司);Premix TaqTM、TaKaRa RNAiso plus(Trizol)(大连宝生物工程公司);6×DNA loading buffer(北京索莱宝生物科技有限公司);DNA ladder(中科瑞泰生物科技有限公司);Agarose-G10(Biowest公司);细菌基因组DNA提取试剂盒(天根生物科技有限公司);细菌16SrDNA通用引物(上海捷瑞生物工程有限公司);50×TAE Buffer购自北京博奥拓达科技有限公司;异丙醇、异戊醇、乙醚、氯仿、乙醇、氯化钠、无菌去离子水等均为国产分析纯试剂。
1.3 试验动物
36只10日龄海兰褐公雏鸡和饲料,均购于山西省康牧养殖合作社。
1.4 细菌分离培养
无菌采取病、死鸡的心、肝、脾、肺、肠、肾等病料平板划线,37 ℃培养18 h,挑选单个典型的菌落继续纯培养。
1.5 生化和药敏试验
参照陈晨[10]的研究选择17项生化指标对分离株进行测定。参照NCCLS方法手册(2007年版)规定的标准进行药敏试验。
1.6 16S rDNA引物及PCR扩增
根据LAU等[11]合成16S rDNA基因特异性通用引物(表1)。使用天根细菌基因组DNA提取试剂盒,经过蛋白酶k的裂解、结合、洗涤和洗脱等步骤提取绿脓杆菌的DNA作为模板。PCR反应体系为:Premix TaqTM12.5 μL,PCR Forward Prime 1 μL,PCR Reverse Prime 1 μL,菌株DNA模板2 μL,最后补充去离子水至35 μL。设定反应条件进行PCR扩增。
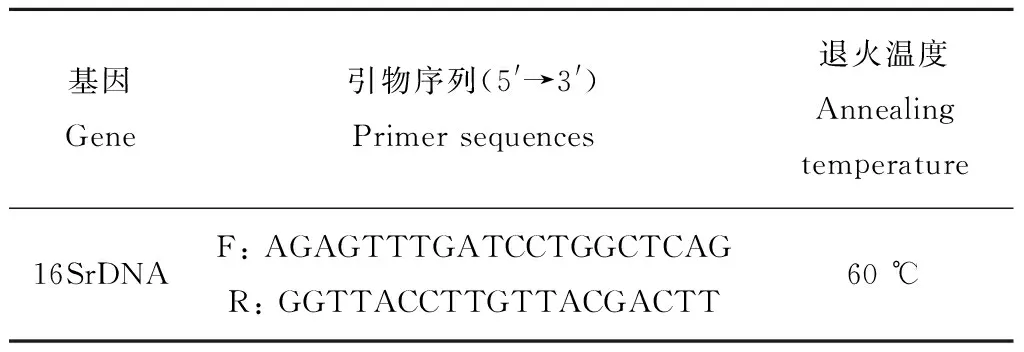
表1 PCR扩增引物序列Table l Primer sequences used in the PCR analysis
注:F为上游引物;R为下游引物。
Note:F: Forward primers, R: Reverse primers.
1.7 16S rDNA的基因序列分析
将分离菌株测序结果通过NCBI选择Blast进行比对,利用DNAStar软件Clustal方法将其与GenBank中登录的参考菌株进行同源性和系统发育分析。
1.8 致病性试验
本研究选取2株绿脓杆菌分离株分别命名为G1和G2,通过在琼脂培养基和麦康凯培养基上平板划线,获得纯培养物。将在山西省康牧养殖合作社购买的36只10日龄海兰褐公雏鸡随机分为3大组,每组12只鸡,第1和第2组为试验组,第3组为对照组,并将对照组鸡隔离饲养。每组又随机分3个小组,每小组4只鸡。试验第1组和第2组的鸡依次对应接种0.5 mL的绿脓杆菌菌悬液,将两株菌原液调整含菌量为5×l08CFU· mL-1。第1组和第2组的3个小组依次对应接种0.5 mL的一株分离菌原液、10-1稀释菌悬液、10-2稀释菌悬液;对照组鸡分别接种0.5 mL肉汤,接种途径为腿部肌肉注射。每天上午8点、11点,下午2点、5点进行饲喂、观察鸡的饮食情况、精神状况、记录鸡死亡数、发病情况,并对死亡鸡进行剖检,对10 d后仍存活的鸡只进行全部剖检,观察病变并做细菌分离培养,分别采集心、肝、脾、肺、肠、肾、腹腔和腿部肌肉进行细菌的分布检测。无菌取试验死亡组和对照组雏鸡的心、肝、脾、肺、肾、肠,并用4%多聚甲醛固定,梯度脱水,试验组织进行常规石蜡包埋,切片,HE染色。
2 结果与分析
2.1 细菌分离培养及染色镜检结果
本试验共分离到11株细菌,其中2株菌落形态相似、生长均一致,分别命名为G1、G2。2株分离菌在营养琼脂平板上均形成湿润、光滑、圆形、扁平的菌落(图1 A),培养基表面有淡淡的蓝色光泽,菌落有特殊气味,血琼脂平板上呈β溶血(图1B);肉汤均匀混浊,上层呈黄绿色,有细丝状悬浮物,有菌膜覆盖;42 ℃也可正常生长。2株均为革兰阴性,镜下观察到细长且长短不一的短杆菌,两端钝圆,单个或成对排列(图1C)。

图1 分离菌培养特性及形态观察Fig.1 Culture characteristics of the bacteria isolates and their morphological observation 注:A:分离菌在营养琼脂培养基上菌落形态;B:分离菌在血琼脂培养基上菌落形态; C:分离菌镜检结果。Note:A:Characteristics of colony morphologyon nutrient agar medium; B:Characteristics of colony morphologyon blood agar medium;C:Microscopic structure of the isolates after Gram staining.
2.2 生化鉴定结果
生化试验结果显示(表2),G1和G2分解葡萄糖;尿素阳性,硝酸盐还原试验阴性;明胶液化试验阳性;有运动性。

表2 分离菌株的生化试验结果Table 2 The biochemical test results of the isolates
注:+ 表示阳性,-表示阴性。
Note: + Shows positive, - Shows negative.
2.3 药敏试验结果
药敏试验结果显示绿脓杆菌均对环丙沙星、恩诺沙星、诺氟沙星、甲磺胺诺氟沙星、哌拉西林、替卡西林以及亚安培南这些药物敏感;对头孢拉定、头孢噻肟钠、阿奇霉素这些药物中度敏感;对链霉素和阿莫西林、庆大霉素、利福平这些药物耐药(表3)。
2.4 16S rDNA序列测定及分析结果
2株分离菌用通用引物扩增出的片段均与预期(1 500 bp)一致(图2)。
结果发现G1和G2株分离菌与铜绿假单胞细菌关系最近,序列相似性与PseudomonasaeruginosaKJ191560达到100%,可以将其归为铜绿假单胞菌(图3)。根据序列比较结果绘制了遗传系统发育树(图4)。遗传发育树结果显示,本试验分离的2株细菌,G1与PseudomonasaeruginosaKT59007属于同一分支,与PseudomonasaeruginosaKJ191 560株亲源最高,G2与PseudomonasaeruginosaHM067869.1属于同一分支。
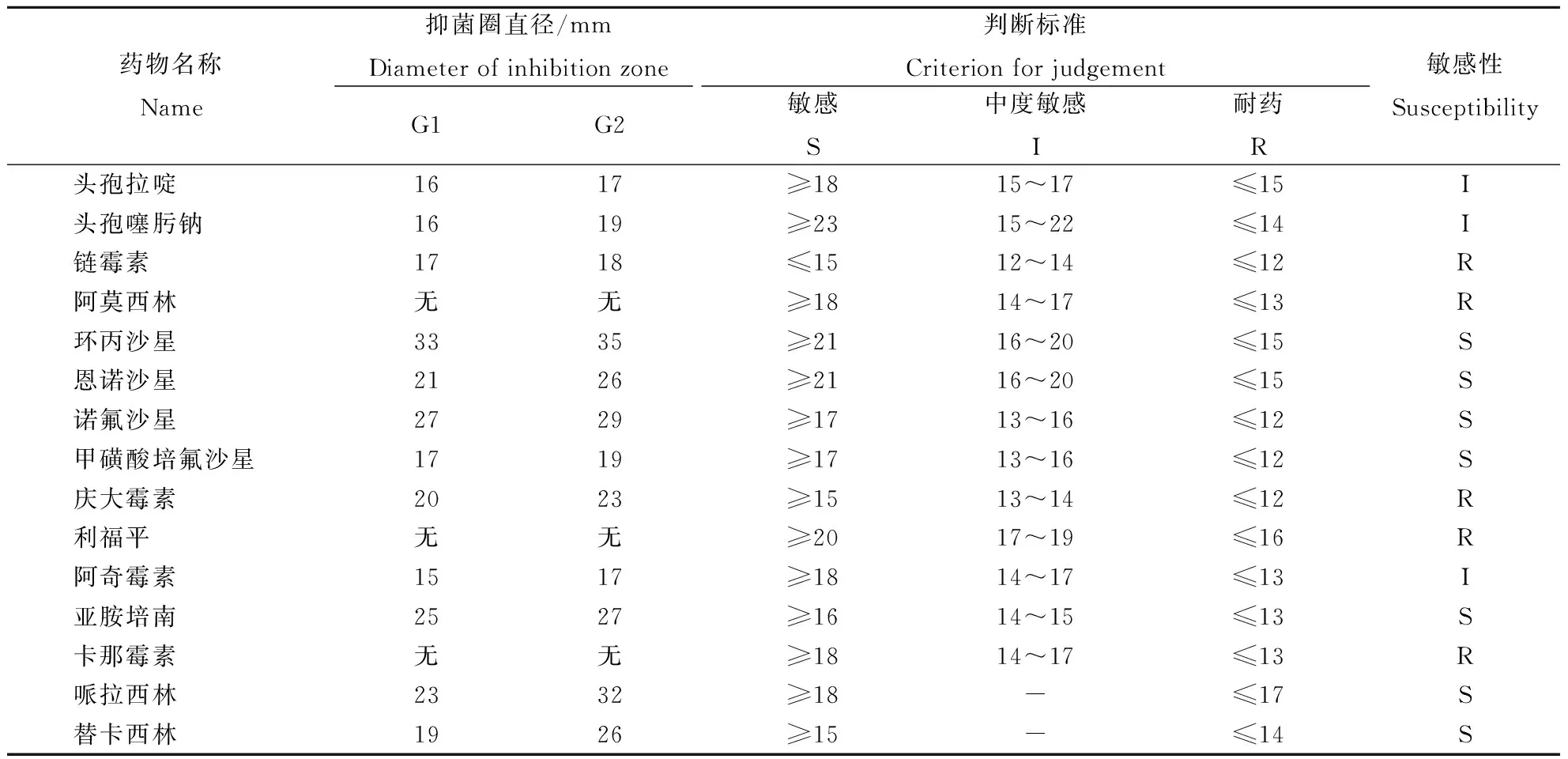
表3 2株分离菌株的药敏实验结果Table 3 Antibiotic Susceptibility test of 2 bacteria isolates
注:S为敏感;I为中度敏感;R为耐药。
Note: S Susceptibility; I Intermediate Susceptibility; R Resistance.
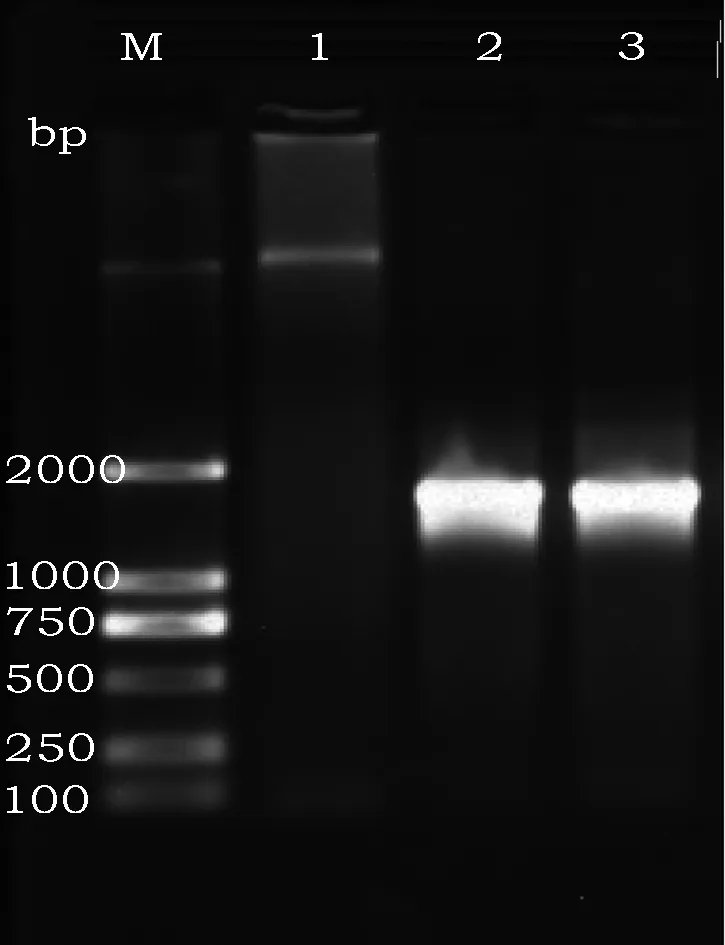
图2 2株绿脓杆菌16S rDNA基因PCR扩增结果Fig.2 Amplification results of 2 strains of 16S rDNA gene of Pseudomonas aeruginosa注:M:D2000 DNA ladder 1:阴性对照;2:G1;3:G2。Note:M: D 2 000 DNA Marker 1: Negative control; 2: G1; 3:G2.
2.5 致病性试验结果
G1株第1小组鸡在接种后的12~24 h内死亡100%,第2小组鸡在36 h发生死亡,死亡率为75%,第3小组鸡在接种后第3天开始出现死亡,症状不太明显,死亡率为50%。对照组连续观察10 d无明显临床症状。G2株第1小组鸡在接种后的12~24 h内死亡100%,第2小组鸡在36 h发生死亡,死亡率25%,第3小组鸡未出现死亡,对照组连续观察10 d无明显临床症状。说明G1株绿脓杆菌在5×108CFU·mL-1时对雏鸡的致病力最高,G2株对雏鸡的致病力弱于G1。在心、肝和肺中分离到了绿脓杆菌,其中肺部分离出的绿脓杆菌含量最多。用雏鸡致病性试验显示绿脓杆菌对雏鸡的致病力相对较强。
2.6 死亡雏鸡的剖检变化
剖检死亡病鸡发现有的雏鸡心脏出现心包膜混浊,严重的心冠脂肪胶冻样水肿;腺胃外壁淤血(图5A,箭头指示处),内壁有出血点,粘膜变厚;肝脏表面光滑,部分淤血肝下侧明显色淡、发黄,脂肪变性(图5B,箭头指示处);肺单侧或双侧肿大,部分肺脏出血发炎;肠道内壁有不同程度的出血点;肾脏表面有淤血,部分肾脏单侧或双侧肿大,严重的肾脏出血坏死,输尿管有灰白色尿酸盐沉淀(图5C,箭头指示处);切开表皮可见到有淡黄色胶冻样渗出物;关节发炎肿大。

图5 死亡雏鸡的剖检变化Fig.5 The necropsy change of dead chick’s organs注:A 腺胃 B 心脏、肝脏 C 肾脏。Note:A Glandular stomach B Heart and liver C Kidney.
2.7 死亡雏鸡的组织病理学变化
死亡雏鸡的心肌局部出血,出血灶区域肌纤维之间被红细胞撑开(图6 A,箭头指示处),横纹消失,心肌坏死;肾出血,红细胞较多(图6B,箭头指示处),有的肾细胞出现水肿,严重的肾小管坏死;肝脏胞腔内出现明显的空泡,脂肪变性(图6C,箭头指示处),细胞核和细胞浆不清楚,少量细胞核颜色变浅出现浓缩,表现为坏死;其它组织器官未见明显病变。
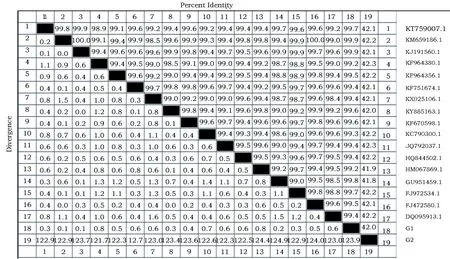
图3 序列比对结果Fig.3 The result of sequence alignment

图4 根据PA绘制的遗传发育树Fig.4 Phylogenetic tree based on PA sequences

图5 死亡雏鸡的剖检变化Fig.5 The necropsy change of dead chick’s organs注:A 腺胃 B 心脏、肝脏 C 肾脏。Note:A Glandular stomach B Heart and liver C Kidney.
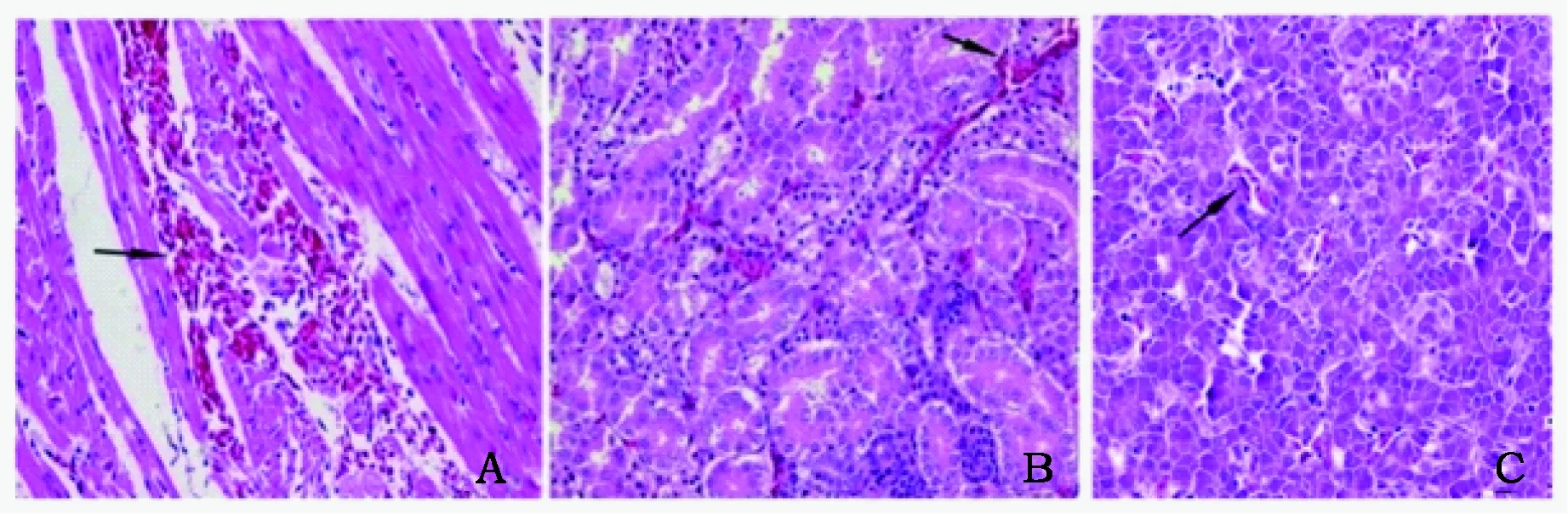
图6 人工感染绿脓杆菌死亡雏鸡主要器官的组织病理学观察(400×),HE染色Fig.6 Observation of histopathological changes in tissues of dead chicks infected with Pseudomonas aeruginosa (400×), hematoxylin and eosin stain注:A心脏B肾脏C肝脏。Note:A Heart B Kidney C Liver.
3 讨论
绿脓杆菌分布广泛,据报道已有多种动物被感染,且症状不一[12, 13],其中集约化养殖感染率较高,常见症状为败血症、肺炎、关节炎,严重引起死亡,导致养殖场损失惨重。感染绿脓杆菌表现出不一样的症状,与其相关的毒力因子有关,受不同的毒力因子调节,造成绿脓杆菌的复杂性[14]。外毒素、胞外酶、菌毛、弹性蛋白酶等都是重要的毒力因子[15]。养鸡场易感染绿脓杆菌,主要是雏鸡感染,孵化室感染,主要是由于1日龄时注射马立克疫苗或在7日龄时注射油苗致创伤而感染,引起死亡。本次临汾、平遥鸡场270日龄和161日龄的海兰褐感染绿脓杆菌,引起精神不振,呼吸困难,产蛋量下降,发病的日龄范围扩大,需引起养殖场高度重视。本次病鸡组织中所分离的2株绿脓杆菌,细菌分离培养及染色镜检结果与张香斋等[16]对绿脓杆菌形态特征的描述一致,生化试验结果与周学章等[17]对绿脓杆菌的生化特性描述一致,遗传发育树结果显示分离株G2与PseudomonasaeruginosaHM067869.1属于同一分支[18],药敏试验结果高度敏感的药物有链霉素、庆大霉素、盐酸环丙沙星、盐酸恩诺沙星、乳酸诺氟沙星、甲磺胺诺氟沙星、哌拉西林、替卡西林及亚安培南等,目前碳青霉烯类药物多用于人医临床治疗绿脓杆菌感染[19]。2株绿脓杆菌对头孢拉啶、头孢噻肟钠等头孢菌素类药物有耐药性,绿脓杆菌耐药是由其天然耐药引起,还是由临床频繁用药引起,还有待于进一步考证[20],因此,为严禁滥用抗生素,临床上治疗雏鸡绿脓杆菌病之前,需进行药敏试验筛选出敏感药物[21],以减少因耐药造成的经济损失。
4 结论
本研究从山西临汾、平遥两规模化养殖场病鸡中,成功分离鉴定出2株致病性较强的绿脓杆菌,对环丙沙星、恩诺沙星、亚胺培南、哌拉西林和替卡西林等抗生素敏感,为继续深入研究家禽绿脓杆菌病的致病性及制定防控措施提供理论支持。

