替格瑞洛对不稳定型心绞痛择期PCI患者血清炎性因子及MMP-9、sICAM-1、tPAI-1的影响
邓瑞,马珍珍,卢小伟
不稳定型心绞痛(UAP)是急性冠脉综合征的重要类型,严重者可导致心肌梗死或猝死。冠状动脉(冠脉)内易损斑块破裂导致急性血栓形成是UAP发生的病理因素。择期经皮冠脉介入治疗(PCI)可快速开通梗阻冠脉,恢复心肌血供,缓解患者症状,目前已成为临床治疗UAP的主要方法。择期PCI治疗UAP尽管疗效显著,但并未解除病因,常易导致支架内狭窄、血栓再形成等不良事件。资料显示,抗血小板治疗能有效避免不良事件的发生,促进患者转归[1]。我院于2015年1月~2017年12月将替格瑞洛应用于UAP择期PCI患者,在评价其效果的同时探究其对血清炎性因子及基质金属蛋白酶-9(MMP-9)、可溶性细胞间粘附分子-1(sICAM-1)、1型组织纤溶酶原激活物抑制剂(tPAI-1)的影响,现报告如下。
1 资料与方法
1.1 研究对象与分组选取2015年1月~2017年12月就诊于湖北医药学院附属国药东风总医院心血管内科的UAP患者114例,其中男性63例,女性51例,年龄46~74(55.75±5.73)岁。所有入院后即行冠脉造影术(CAG)检查并确诊为冠脉严重狭窄。纳入标准:符合《不稳定性心绞痛和非ST段抬高心肌梗死诊断与治疗指南》[2]UAP诊断标准患者;30 d内未使用抗血小板药物患者;知情同意患者。排除标准:既往PCI史患者;不符合择期PCI指征患者;自身免疫性疾病者;凝血功能障碍患者;血小板减少患者;其他心脏疾病患者;脑血管疾病患者;本研究药物不耐受或禁忌症患者;肝肾等脏器功能不全患者;依从性差患者;恶性肿瘤患者。依据随机数字表法将114例患者分为替格瑞洛组(57例)与对照组(57例)。
1.2 方法
1.2.1 治疗方案两组均根据患者情况给予β受体阻滞剂、他汀类、ACEI及低分子肝素等常规治疗。对照组给予氯吡格雷治疗。氯吡格雷:患者入院后给予负荷剂量300 mg,然后以75 mg/d,1/d维持至PCI前,PCI后给予维持剂量75 mg,口服,1/d,治疗3个月。替格瑞洛组给予替格瑞洛治疗。替格瑞洛:于PCI前给予负荷剂量180 mg,PCI后给予维持剂量90 mg,口服,2/d,治疗3个月。
1.2.2 血液样本的采集及标志物的检测于PCI前后采集患者空腹静脉血30 ml,以离心机离心(3000 r/min)10 min,取血清保存于冰箱(-80℃)内待检。血清炎性因子:以免疫比浊法检测超敏C-反应蛋白(hs-CRP);以ELISA法检测白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)。血清心肌损伤指标:以ELISA法检测MMP-9、sICAM-1、tPAI-1。各项检测均严格依据试剂盒规范进行操作,试剂盒均购自于上海领潮生物科技有限公司。
1.2.3 观察指标及随访观察两组PCI中冠脉血流及急性血栓形成情况;PCI前后心绞痛得分:依据西雅图心绞痛量表(SAQ)评价心绞痛得分[7],内容包括疾病认知、心绞痛发作频率、躯体活动受限、心绞痛稳定、治疗满意度等,得分越高提示患者情况越好。通过门诊或电话的方式随访患者PCI后1年时间内不良心血管事件(MACE)的发生情况。
1.3 统计学方法所有数据均采用SPSS 19.0统计学软件分析。计量资料采用均数±标准差(±s)表示,组内比较行配对t检验,组间比较行独立样本t检验;计数资料采用例数(构成比)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较两组患者性别构成比例、年龄、体质指数(BMI)、病程、不同心绞痛程度构成比例比较,差异均无统计学意义(P均>0.05)(表1)。

表1 两组患者一般临床资料的比较
2.2 两组PCI中冠脉血流及急性血栓形成情况替格瑞洛组术中慢血流或无复流发生率(0.00%)低于对照组(7.02%)(P<0.05);两组术中急性血栓形成率无差异(P>0.05)(表2)。

表2 两组PCI术中冠脉血流及急性血栓形成情况(n,%)
2.3 两组SAQ评分比较PCI前,两组SAQ不同维度评分无差异(P均>0.05);与PCI前比较,PCI后两组SAQ不同维度评分均增加(P均<0.05);PCI后,替格瑞洛组SAQ不同维度评分及总分均高于对照组(P均<0.05)(表3)。
2.4 两组血清炎性因子比较PCI前,两组hs-CRP、IL-6、TNF-α无差异(P均>0.05);与PCI前比较,PCI后两组hs-CRP、IL-6、TNF-α均降低(P均<0.05);PCI后,替格瑞洛组hs-CRP、IL-6、TNF-α均低于对照组(P均<0.05)(表4)。
表3 两组SAQ评分比较(±s,分)

表3 两组SAQ评分比较(±s,分)
注:与本组PCI前比较,aP<0.05;与对照组PCI后比较,bP<0.05
项目 替格瑞洛组(n=57) 对照组(n=57)PCI前 PCI后 PCI前 PCI后疾病认知 8.16±0.84 13.43±1.40ab 8.20±0.86 10.86±1.15a心绞痛发作频率7.41±0.76 12.24±1.31ab 7.47±0.77 10.19±1.22a躯体活动受限 31.32±3.32 42.91±4.45ab 31.49±3.33 37.36±3.82a心绞痛稳定 3.25±0.34 6.63±0.67ab 3.29±0.36 5.08±0.54a治疗满意度 13.79±1.46 20.83±2.28ab 13.84±1.48 16.77±1.75a总分 63.93±6.72 96.04±10.11ab 64.29±6.80 80.26±8.48a
表4 两组血清炎性因子比较(±s)

表4 两组血清炎性因子比较(±s)
注:hs-CRP:超敏C-反应蛋白;IL-6:白介素-6;TNF-α:肿瘤坏死因子-α;与PCI前比较,aP<0.05;与对照组PCI后比较,bP<0.05
项目 替格瑞洛组(n=57) 对照组(n=57)PCI前 PCI后 PCI前 PCI后hs-CRP(mg/L) 9.91±1.06 3.49±0.36ab 9.86±1.01 5.77±0.59a IL-6(ng/L) 34.29±3.51 21.74±2.29ab 33.96±3.48 26.16±2.73a TNF-α(pg/ml) 14.93±1.60 6.85±0.71ab 14.87±1.56 10.15±1.22a
2.5 两组血清心肌损伤指标比较PCI前,两组血清MMP-9、sICAM-1、tPAI-1无差异(P均>0.05);与PCI前比较,PCI后两组血清MMP-9、sICAM-1、tPAI-1均降低(P均<0.05);PCI后,替格瑞洛组MMP-9、sICAM-1、tPAI-1均低于对照组(P均<0.05)(表5)。
2.6 两组PCI后1年MACE发生情况PCI后1年内,替格瑞洛组MACE发生率(1.75%)低于对照组(12.28%)(P<0.05)(表6)。
表5 两组心肌损伤指标比较(±s)

表5 两组心肌损伤指标比较(±s)
注:MMP-9:基质金属蛋白酶-9;sICAM-1:可溶性细胞间粘附分子-1;tPAI-1:1型组织纤溶酶原激活物抑制剂;与PCI前比较,aP<0.05;与对照组PCI后比较,bP<0.05
项目 替格瑞洛组(n=57) 对照组(n=57)PCI前 PCI后 PCI前 PCI后MMP-9(μg/L)145.96±16.88 85.57±9.03ab 144.54±16.84 101.67±11.36a sICAM-1(ng/ml)276.94±28.46 181.73±19.31ab 271.96±28.40 225.11±23.43a tPAI-1(ng/ml)69.05±7.14 55.83±5.62ab 68.82±7.08 61.13±6.21a
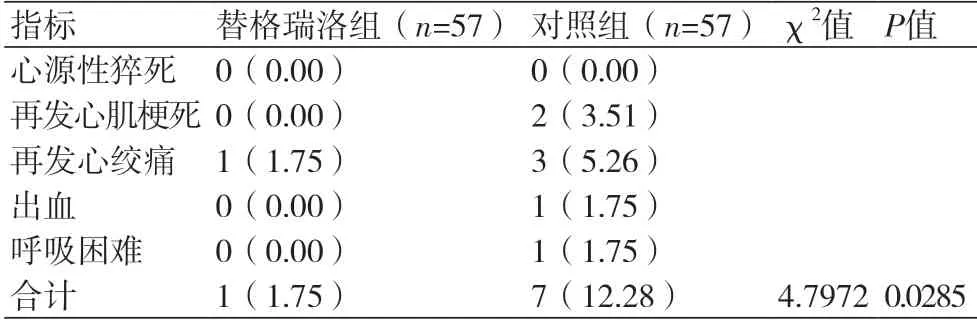
表6 两组PCI后1年MACE发生情况(n,%)
3 讨论
择期PCI后MACE是导致患者术后风险的重要因素。氯吡格雷、阿司匹林双联抗血小板方案是择期PCI后预防MACE的基石药物[3]。该方案尽管可有效预防择期PCI后MACE,但因氯吡格雷作用发挥慢,且患者存在基因形态、代谢等方面的差异,故部分患者常易出现对氯吡格雷不敏感,即使行该方案治疗,仍可发生MACE[4]。
替格瑞洛为CPTP类药物,可与ADP结合点P2Y12受体可逆性结合,抑制其激活,以降低血小板活性,抑制其聚集。且P2Y12受体脱离替格瑞洛构想及信号传递功能不变,停药后仍可正常发挥其受体功能。在体内,替格瑞洛可代谢为AR-C124910XX,该产物仍具有与P2Y12受体可逆性结合,抵抗血小板的作用[5]。而氯吡格雷代谢产物与P2Y12受体则是不可逆性结合,即使停止用氯吡格雷,P2Y12受体功能也无法恢复[6]。除血小板P2Y12受体外,替格瑞洛还可作用于血管平滑肌细胞P2Y12受体,抑制血管平滑肌收缩,避免血管痉挛,改善局部血流[7]。替格瑞洛可提高血浆腺苷水平,提高心肌灌注,缓解炎性反应[8,9]。
炎性反应是导致UAP发生的重要因素。炎性反应可诱导生成氧自由基,导致氧化应激损伤,致使发生脂质过氧化反应,引发并推进UAP的发展[10]。hs-CRP可结合脂质蛋白导致血管内膜损伤,还可结合单核细胞、粒细胞的CRP受体,诱导其聚集、浸润,导致血管损伤[11]。IL-6可促进肝脏生成CRP,诱导巨噬细胞蛋白化,加快冠脉粥样硬化进程,促进血栓形成[12]。TNF-α为促炎性因子,可介导炎性因子聚集、黏附,导致炎性反应,促进细胞凋亡[13]。
MMP-9为基质金属蛋白酶,可促进细胞外基质及斑块降解,损伤纤维帽,引发斑块破裂。MMP-9可引发血小板聚集,导致血管狭窄,导致血栓形成[14]。sICAM-1分布于内皮细胞表面,可介导促进炎性因子与血小板间的黏附,导致血管内皮损伤,促进血管收缩,致使冠脉狭窄,加重UAP病情。sICAM-1能够与纤维素原相互作用,促进动脉粥样硬化进展[15]。tPAI-1为纤溶标志物,可抑制纤溶系统功能,促进纤维蛋白沉积,致使机体进入高凝状态,导致动脉粥样硬化发生与血栓形成[16]。
在本研究中, 替格瑞洛组术中慢血流或无复流发生率(0.00%)低于对照组(7.02%)(P<0.05)。PCI后两组SAQ不同维度评分均增加,替格瑞洛组SAQ不同维度评分及总分均高于对照组(P均<0.05),PCI后1年内,替格瑞洛组MACE发生率低于对照组,说明替格瑞洛可抑制血小板活性,改善局部血流,避免发生MACE。在本研究中,PCI后两组hs-CRP、IL-6、TNF-α均降低(P均<0.05),且替格瑞洛组hs-CRP、IL-6、TNF-α均低于对照组(P均<0.05),表明与氯吡格雷相比较,替格瑞洛抑制炎性反应作用更强,可有效缓解UAP择期PCI患者机体炎性反应,与刘晓刚等[17]研究结果一致。在本研究中,PCI后两组血清MMP-9、sICAM-1、tPAI-1均降低(P均<0.05),且替格瑞洛组MMP-9、sICAM-1、tPAI-1均低于对照组(P均<0.05),说明替格瑞洛可抑制M M P-9、sIC AM-1、tPAI-1,抑制血小板聚集,保护血管内皮,改善纤溶系统功能。
总之,替格瑞洛可改善UAP择期PCI患者冠脉血流,缓解其心绞痛,清除炎性因子,抑制MMP-9、sICAM-1、tPAI-1生成,且MACE发生率低,安全性高,值得临床应用。

