应用轨道法植入左室心内膜电极行心脏再同步化治疗∗
杨杰 程自平 陈刚 赵韧 刘敏 冯俊 杜丽 史学功 王邦宁
虽然心脏再同步化治疗(CRT)或者心脏再同步化治疗并心律转复除颤器(CRT-D)已经成功应用于临床,成为改善心力衰竭(简称心衰)患者症状和降低死亡率的一项有效治疗措施。但是,目前通行的CRT/CRT-D左室电极植入技术为经冠状静脉侧后分支进行左室心外膜起搏,使得冠状静脉解剖异常成为左室电极植入技术的瓶颈。研究表明,约5%~10%心衰患者不能通过冠状窦植入左室心外膜电极,近30%CRT植入患者术后CRT无应答[1]。鉴于此,国内外有学者提出左心室心内膜起搏学说并尝试多种技术方法,但尚未形成安全、有效、成熟的技术路线[2]。本中心创新应用轨道法穿刺房间隔植入左室心内膜电极6例,并对其术后心脏超声、心电图、心功能指标进行分析,现报道如下。
1 资料与方法
1.1 术前资料 选取2017年3月1日至2017年12月31日在本院行CRT/CRT-D左室心内膜电极植入术的心衰患者6例(男5例、女1例,CRT-D 1例),年龄62~75岁。冠心病患者1例,糖尿病患者1例,3例患者具有长期吸烟史,均否认家族性疾病史,B型脑利钠肽(BNP)均>300 pg/m L,血肌酐<120μmol/L。入选原因:2例系CRT术后左室电极磨损难以拔出,2例系冠状窦开口变异,另2例系无合适靶血管、靶血管起搏阈值不良,遂行左室心内膜电极植入术。术前心电图检查:QRS波时限均≥150 ms,均为完全性左束支传导阻滞,心脏超声示:左室射血分数(LVEF)均<0.30。NYHA心功能分级Ⅲ~Ⅳ级,二尖瓣返流均达中度以上,均符合2014年中国心衰诊断和治疗指南CRT/CRT-D植入I类A级指征[3]。
1.2 手术过程 患者平卧、消毒、铺巾、局麻,穿刺左(或右)锁骨下静脉1次,置入2根J型钢丝,再沿锁骨下皮肤横切约6 cm,向下逐层浸润麻醉,分离至胸大肌筋膜,向下做成囊袋;穿刺右股动脉及股静脉,经股静脉送入8F Swartz鞘及房间隔穿刺针,在右前斜(RAO)45°下穿刺房间隔成功(图1a)并送入泥鳅导丝(260 cm),经左房跨二尖瓣进入左室,后跨过主动脉瓣进入降主动脉(图1b);自右侧股动脉送入右心导管及抓捕器,于降主动脉成功抓出泥鳅导丝头端并拉出体外,建立股静脉-房间隔-主动脉轨道(图1c、d、e)。沿泥鳅导丝动脉侧送入猪尾导管,与静脉侧Swartz鞘成功对吻,猪尾导管头端进入Swartz鞘后,撤出泥鳅导丝,再沿猪尾导管另送一根泥鳅导丝(260 cm)至下腔静脉后,撤出静脉侧导管(图2a、b)。沿锁骨下静脉送入8F静脉鞘、右心导管及抓捕器,在下腔静脉成功抓住泥鳅导丝头端并拉出体外,建立锁骨下静脉-房间隔-左室轨道(图2c)。沿轨道送入左室长鞘达左室后,撤出右股动脉侧导管及导丝。沿左室长鞘送入普通螺旋电极(Medtronic 5076)并成功固定于左室侧壁(图2d、e),测左室电极阈值:<1.0 V,感知:>10 m V,阻抗:<1 000Ω。沿锁骨下静脉分别植入右房电极(Medtronic 4574)、右室电极(Medtronic 4074)于右心耳及右室心尖部(图2f),测试心房阈值:<1.0 V,感知:>3 m V,阻抗:<1 000Ω;右室阈值>1.0 V,感知:>10 m V,阻抗:<1 000Ω,无膈肌起搏。深呼吸和咳嗽时电极头端固定稳固,去除撕开鞘,皮下固定电极,拔除电极内导丝。将电极末端与Medtronic C2TR01起搏器连接口连接,扳手固定,塞入囊袋,起搏器感知功能良好,呈VAT方式起搏,遂将皮下组织和皮肤逐层缝合,酒精纱布覆盖、包扎,盐袋压迫。术中患者无特殊不适主诉,术中优化起搏参数,双室起搏LVtip-LVring,LV-RV领先60 ms,房室延迟(AVD)150/100 ms。术后安返病房。
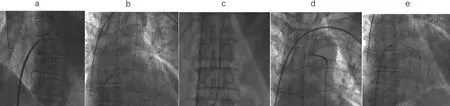
图1 穿刺房间隔成功并建立股静脉-房间隔-主动脉轨道
1.3 术后随访 所有患者均于术后1周随访,复查心电图及心脏彩超,比较术前术后心功能及患者心慌、胸闷、胸痛、头晕、乏力、气促等症状有无好转,以评估临床疗效。
1.4 统计分析 采用SPSS16.0统计软件,计量资料采用±s表示,组间比较采用t检验,计数资料组间比较采用χ2检验,以P<0.05为差异有显著性。
2 结果
2.1 术后临床症状及心功能变化 术后1周随访:5例患者心慌,胸闷等临床症状明显改善,临床疗效显著,切口拆线后带药出院;1例轻度改善,仍诉有心慌、胸闷、乏力、气促等不适,考虑系患者既往冠心病史多年,且高龄(69岁),心功能差(术前NYHAⅣ级,LVEF 0.29,重度二尖瓣返流)所致,经积极对症支持处理后延迟出院。术后心功能评估:NYHA分级均为Ⅱ级,较前改善1~2级,二尖瓣返流较前减轻。
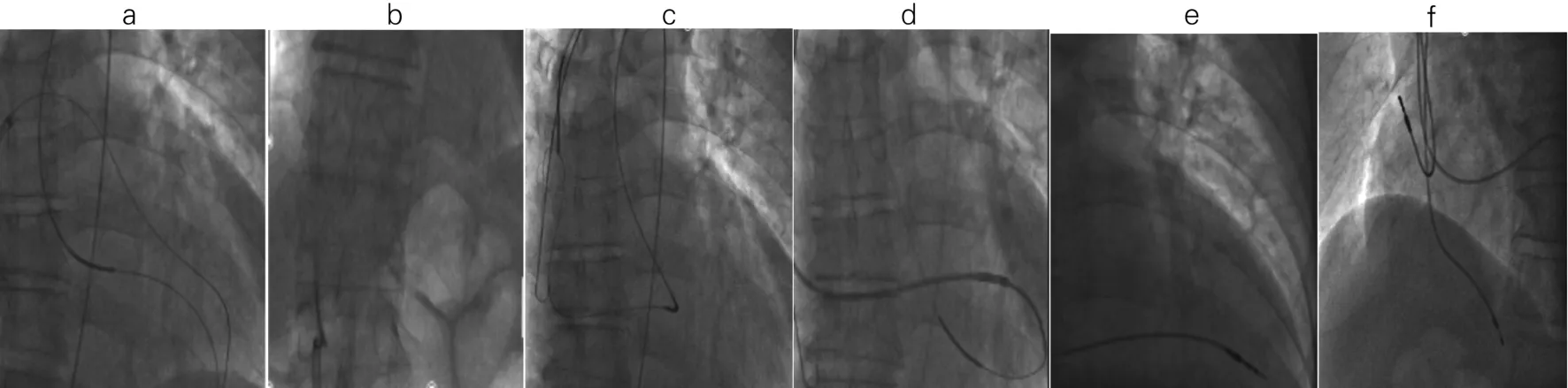
图2 建立锁骨下静脉-房间隔-左室轨道并依次植入LV、RA、RV电极
2.2 心电图、心脏彩超变化 术后1周QRS波时限较术前明显缩窄[(140.83±10.52)ms vs(166.83±13.60)ms,P<0.05],见图3、4。LVEF较前明显增大(0.37±0.05 vs 0.27±0.04,P<0.05)。

图3 左室起搏前典型心电图

图4 左室起搏后典型心电图
2.3 并发症 术后5例患者无明显不适,心电监护示起搏心律+窦性心律,血压较前无明显变化,未发生脑出血、脑栓塞等并发症;1例患者术后出现胸闷不适,心电监护示R波偏低,行床边心脏超声示:心包少量积液,考虑系左室电极穿孔所致,经积极对症支持处理后胸闷、心慌等症状无明显好转,遂于术后2天行左室电极重置术,手术顺利,术后心衰症状较前改善。
3 讨论
2012年EHRA/HRS建议:对于左室心外膜电极植入失败者,建议行左室心内膜电极起搏。相对心外膜起搏而言,左室心内膜电极起搏具有以下优点:更多的左室起搏位点,较低的起搏阈值,较低的膈肌起搏刺激,更符合生理性起搏且不易诱发心律失常,同步化效率更高,较高的左室电极植入成功率等[2],但由于手术难度大,且可能导致一定的并发症,目前国内该手术病例较少,且缺乏大规模长期临床研究[4-5]。
随着CRT技术的不断发展,左室心内膜起搏术式不断更新,包括:直视下心肌内缝合,经心尖部途径,经室间隔穿刺途径,经房间隔穿刺途经和无导线左室心内膜起搏。目前,应用最多的是经房间隔穿刺途径,最早采用右侧股静脉和颈内静脉混合入路植入左室心内膜[6];其后,不同术者对此术式进行改良,但以改良的上下腔静脉混合入路最为常用;但在这些术式中,无疑手术的最大难点就在于如何寻找穿刺后的房间隔孔。鉴此,采用射频消融大头电极、圈套器、可控弯鞘乃至心脏三维标测系统(如Carto系统)等辅助下将长鞘送入左室,再沿长鞘将电极固定在左室心内膜,但很明显会造成比较大的房间隔缺损[7-8]。
笔者采取混合入路途径,通过穿刺房间隔,两次建立轨道从而植入左心室心内膜电极。本术式最大特点在于打破以往从右侧寻找穿刺的房间隔穿刺孔方法,通过先后建立股静脉-房间隔-主动脉轨道和主动脉-房间隔-锁骨下静脉轨道,充分利用房间隔穿刺孔且最大限度的减少房间隔穿刺损伤。目前,术者已完成6例类似手术,手术成功率100%,仅有1例发生并发症。
目前,经房间隔穿刺左室心内膜起搏CRT多数系经冠状静脉植入左室电极失败,且不愿开胸植入左室心外膜电极或CRT术后无反应患者的补救方案,但可能导致房间隔损伤,二尖瓣功能损伤、感染性心内膜炎以及需要终生抗凝等问题[9]。为避免以上问题,本术式在房间隔穿刺后采用导管对吻方式,以导管的支撑力减少对房间隔的损伤;由于导管非常纤细,加上患者心衰本身多存在严重的二尖瓣返流,因此左室内膜电极对瓣膜的损伤可想是非常小的;由于患者术后常规规律服用抗生素预防感染,因而感染性心内膜炎发生率并不会高;至于终生抗凝问题,只要规律服药,定期检测出凝血指标以指导治疗即可。
总结目前经验:①对于术中突发心衰,经积极药物治疗后仍不能继续耐受手术患者,可植入主动脉内球囊反搏(IABP)以增加心脏耐受力,本6例患者有2例植入IABP,给予1∶1辅助,疗效显著,具有重要辅助价值;②因器械进入左室动脉系统前需要肝素化抗凝,为避免穿刺出血不止,应先穿刺股静脉及锁骨下静脉后,再穿刺股动脉,股动脉穿刺成功后给予4 000 U肝素,后每隔1 h追加1 000 U肝素;③若导丝跨过左室后变直随心脏收缩明显或出现室性心律失常提示导丝可能从左室乳头肌中穿过,应及时退出乳头肌;④因导丝具有切割效应,为避免对房间隔穿刺孔损伤,应使动、静脉侧导管同时进入到Swartz鞘内,使导丝在导管内穿过房间隔;另外导管必须进行对吻,但如有加长的两头均为柔软的泥鳅导丝,即可省去导管对吻的步骤;⑤应使用直径细的左室电极(如Medtronic 3830主动电极,外径4.0F)以减少对房间隔穿刺孔的损伤及二尖瓣功能的影响;⑥因植入左室心内膜电极,术后应长期华法林抗凝治疗,并注意监测国际正常化比值(INR)在3.5~4.5之间。

