细胞因子与新生儿坏死性小肠结肠炎的相关性
,
(浙江省慈溪市人民医院新生儿科,浙江 慈溪 315300)
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是早产儿常见病,主要临床症状有腹胀、肠梗塞、便血等[1]。NEC病因尚不明确,目前认为异常细菌感染、肠道内缺血/氧、不当食用配方奶以及早产是NEC的高危因素。也有研究表明cdx1、cdx2、Lgr5、PTEN等基因的异常表达会增加NEC风险[2-6]。早产儿肠道发育不成熟,微血管物理性的张力失衡等原因也会导致肠道菌群脱离其原生环境,引起肠道内菌群种类与数量失衡,而胃肠道致病菌感染引起的炎症介质释放导致肠道损伤是导致NEC发生发展的重要因素,NEC的发生与炎症介质肿瘤坏死因子(tumor necrosis factor, TNF)、血小板活化因子(platelet activating factor, PAF)、白细胞介素-4(interleukin 4, IL-4)、白细胞介素-6(interleukin 6, IL-6)密切相关[7-8]。NEC一般从小肠粘膜开始发病,然后累及肠壁全层甚至导致穿孔,如不及时控制,有引发败血症和其他严重威胁生命的疾病[9],因此,及早诊断、准确判断NEC病情并采取正确治疗有重要意义。为进一步评估NEC与炎症因子的相关性,本文对124例NEC患儿血清中IL-6、TNF-α、IL-4浓度进行了测试,发现疾病活动程度不同的患儿血清中IL-6、TNF-α、IL-4浓度具有显著差异,具体研究报道如下。
1资料与方法
1.1一般资料
选取2015年7月至2018年5月浙江省慈溪市人民医院收治的NEC患儿124例为研究对象,其中男性患儿64例,女性患儿60例,平均胎龄为(34.7±0.5)周,顺产71例,剖宫产53例,体重(1 697.82±52.37)g 。
根据NEC的BELL划分标准,观察组包括Ⅰ期68例(均为ⅠB期),Ⅱ期40例(ⅡA期29例,ⅡB期11例),Ⅲ期16例(均为ⅢA期)。为了直观的比较细胞因子水平与NEC的关系,另外选取同时期本院出生的100例足月、健康新生儿为对照组,两组年龄、性别、母亲年龄组间比较差异均无统计学意义(均P>0.05),而NEC组胎龄、体重、顺产比例均低于对照组(均P<0.05),见表1。


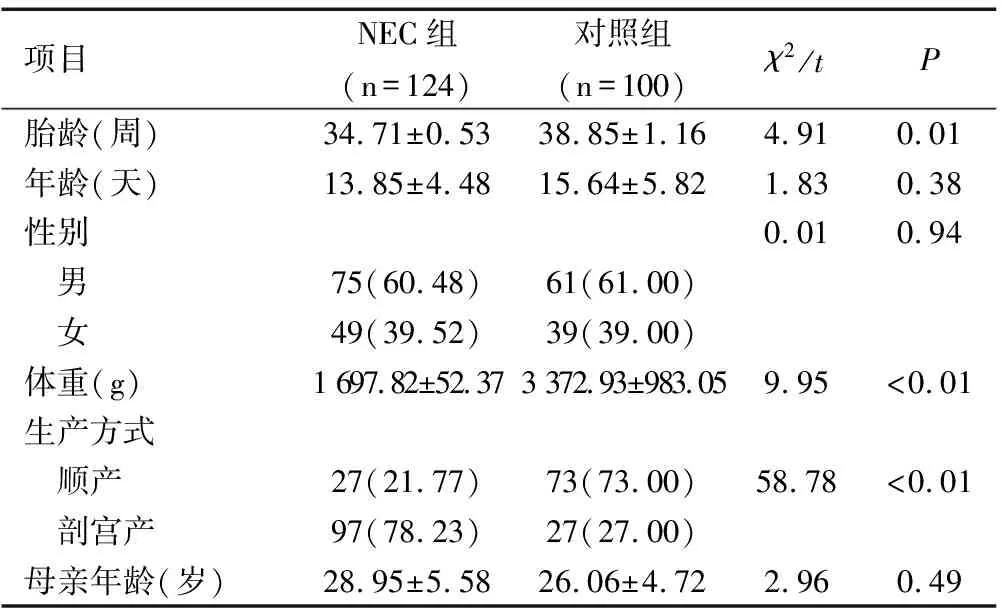
项目NEC组(n=124)对照组(n=100)χ2/tP胎龄(周)34.71±0.5338.85±1.164.910.01年龄(天)13.85±4.4815.64±5.821.830.38性别0.010.94 男75(60.48)61(61.00) 女49(39.52)39(39.00)体重(g)1 697.82±52.373 372.93±983.059.95<0.01生产方式 顺产27(21.77)73(73.00)58.78<0.01 剖宫产97(78.23)27(27.00)母亲年龄(岁)28.95±5.5826.06±4.722.960.49
1.2方法
1.2.1 NEC患儿分期
参照Bell等人设计的NEC临床分期标准,具体情况见表2。
1.2.2 IL-6、TNF-α、IL-4浓度的测试
两组新生儿均取头皮静脉血1mL,常规EDTA抗凝,3 000r/min离心10min,4℃冰箱保存至检测。本研究中IL-4、IL-6和TNF-α检测采用酶联免疫吸附(ELISA),试剂盒均购自Sigma,操作步骤严格按照说明书进行,样品的提取及保存也严格按照说明书要求进行。
表2 Bell关于NEC的临床分期标准及其对应的症状
Table 2 Bell’s clinical staging criteria for NEC and their corresponding symptoms
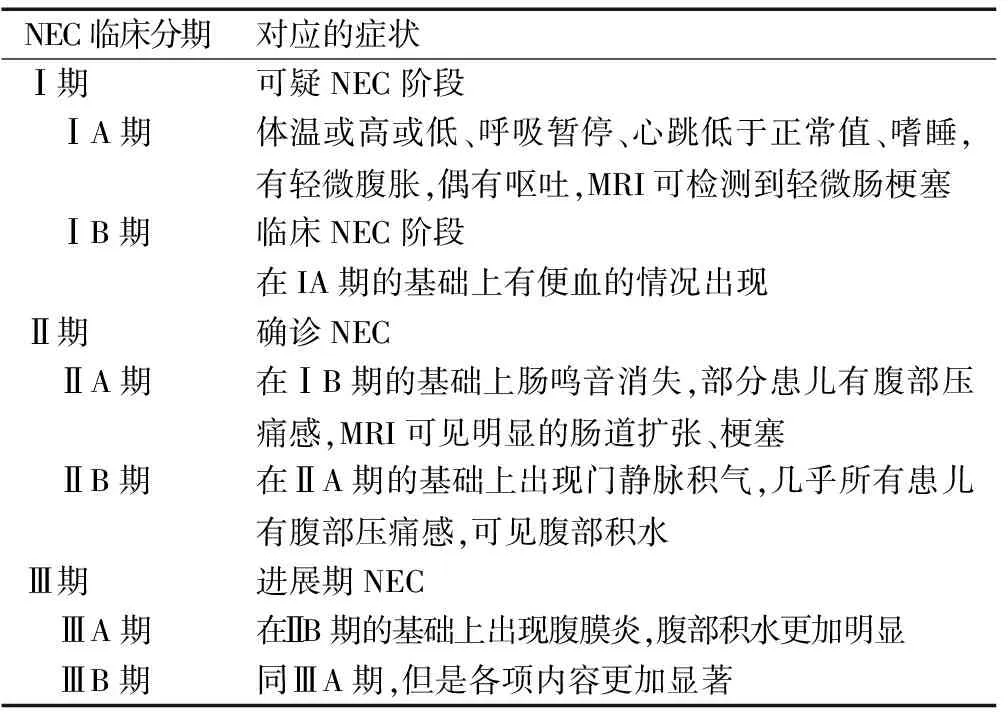
NEC临床分期对应的症状Ⅰ期可疑NEC阶段 ⅠA期体温或高或低、呼吸暂停、心跳低于正常值、嗜睡,有轻微腹胀,偶有呕吐,MRI可检测到轻微肠梗塞 ⅠB期临床NEC阶段在IA期的基础上有便血的情况出现Ⅱ期确诊NEC ⅡA期在ⅠB期的基础上肠鸣音消失,部分患儿有腹部压痛感,MRI可见明显的肠道扩张、梗塞 ⅡB期在ⅡA期的基础上出现门静脉积气,几乎所有患儿有腹部压痛感,可见腹部积水Ⅲ期进展期NEC ⅢA期在ⅡB期的基础上出现腹膜炎,腹部积水更加明显 ⅢB期同ⅢA期,但是各项内容更加显著
1.2.3粪便DNA的提取
两组新生儿均取新鲜粪便,排便需用统一、无菌容器进行收集,然后使用无菌药勺取粪便中间样本1g,置于1.5mL的无菌的一次性无菌粪便采集管中,要求每一例患儿取样4管,以防止实验失败需要重复。将本置于干冰盒内冷链运送至微基生物科技(上海)有限公司,进行粪便DNA提取与分析。 以16S rRNA 的 V3~V4 区域作为目标DNA序列,进行 PCR扩增。以 通 用 引 物 338F ( 5′-ACTCC ̄TACGGGAGGCAGCA-3′) 和 506R ( 5′-GGAC ̄TACHVGGGTWTCTAAT-3′) 对 16s rDNA 的 V3~V4 进行扩增。 PCR反应条件为 95℃预变性 3min,95℃ 变性30 s,55℃退火30 s,72℃延伸45s,25个循环;72℃延伸20min。扩增结束后,PCR扩增产物使用 2% 琼脂糖进行凝胶电泳[10]。检查扩增效果,合格样品送Illumina-MiSeq平台进行高通量测序,菌落丰富度以Shannon指数和Simpson 指数表示。
1.3统计学方法
本研究中的所有数据全部采用统计学软件SPSS 19.0进行分析,计量资料均采用均数±标准差表示,其计数资料采用比例(%)表示,计量资料组间差异采用t检验,组内差异采用方差分析,计数资料采用χ2检验;采用Pearson相关分析比较Shannon和Simpson菌群丰富度指数与细胞因子浓度的相关性,以P<0.05为差异具有统计学意义。
2结果
2.1两组新生儿IL-6、TNF-α、IL-4浓度比较
NEC组的IL-6、TNF-α和IL-4浓度均高于对照组,组间比较差异均有统计学意义(均P<0.05),见表3。

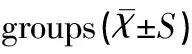
Table 3 Comparison of serum IL-6, TNF-α and IL-4 concentrations between two
2.2 NEC患儿细胞因子浓度与NEC临床分期的关系
NEC组各期IL-6、TNF-α、IL-4浓度逐渐升高,组内比较差异均有统计学意义(均P<0.05),其中Ⅱ期高于Ⅰ期(t值分别为5.96、7.81、6.00,均P<0.05),Ⅲ期高于Ⅱ期(t值分别为6.95、5.01、5.01,均P<0.05),见表4。

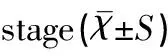
Table 4 The relationship between cytokine concentrations and NEC clinical
2.3 NEC患儿促炎细胞因子TNF-α和IL-6浓度与肠道菌群丰富度相关性
TNF-a和IL-6浓度与Shannon指数呈负相关性(P<0.05),与Simpson 指数呈正相关(P<0.05),见表5。
表5 NEC患儿促炎细胞因子TNF-α和IL-6浓度与肠道菌群丰富度相关性
Table 5 Relationship between proinflammatory cytokines TNF-α and IL-6 concentration and richness of intestinal flora

研究内容Shannon指数Simpson 指数PTNF-α浓度r=-0.56r=0.47均<0.05IL-6 浓度r=-0.35r=0.81均<0.05
3讨论
3.1 NEC的研究现状及其与抗炎或促炎细胞因子的关系
NEC是一种获得性疾病,其高发部位为回场末端,典型特征是肠道粘膜甚至肠深层的坏死。NEC的发病原因多样,其中细菌感染是导致NEC发生的最主要原因之一。人体肠道中大约存在500~1 000多种细菌,这些细菌数量巨大,会通过代谢或繁殖对身体状况造成重大影响。最为常见的肠道细菌是革兰氏阴性杆菌,它们可产生内毒素脂多糖对肠道起到直接作用,引发肠道炎症反应,使免疫因子如白细胞介素以及细胞坏死因子的异常表达,损伤肠道内壁。与此同时,内毒素多糖脂可以增加患儿体内信号肽分子的活性,增高肠道细胞的黏附性,从而抑制肠道上皮细胞修复的过程[11]。
引起新生儿NEC的另外一个原因是肠壁缺氧、缺血和再灌注损伤等,新生儿在出生时若出现缺氧、窒息等会导致肠系膜的血流量减少,并且有可能导致小肠缺血部位坏死,严重损伤肠黏膜屏障。肠系膜是人体最主要的三大免疫器官之一,上面有丰富的淋巴结,对肠道菌群的稳定、平衡起到重要作用,所以肠系膜的损伤至少从两个方面导致了NEC发生[12]。此外早产和喂养不当也是引发NEC的重要原因[13-14]。有研究证明TNF-α、PAF、促炎和抗炎细胞因子等多种细胞因子与信号通路参与到NEC的发生[15]。对于NEC的治疗,目前临床上主要有保守治疗和手术治疗两种方式,但是对于Ⅲ期NEC患儿,其治愈效果较差,因此,NEC的预防和及早诊断具有重要意义。在本研究中,我们比较了NEC患儿与正常新生儿IL-6、TNF-α、IL-4的浓度差异,发现NEC组各因子浓度高于健康新生儿,而且随着NEC严重程度的增加,IL-6、TNF-α、IL-4的浓度也有上升趋势,说明这些细胞因子对于反映NEC病情也有一定的参考价值,可以作为辅助指标。
3.2分子微生物技术研究肠道微生物概况
通过微生物的分离培养及生化性状和特定表型的鉴定,可以有效的评价微生物的抗生素敏感性和致病性。但是一般情况下环境中的微生物含量较少,对绝大多数微生物的群落功能及系统发育关系无法进行深度研究。随着分子生物学技术的引入,我们可以对环境中的优势菌群进行辨识,但是检测分辨率、精度仍不尽如人意,且费时费力。随着第二代高通量测序技术的普及,让我们全面认识肠道微生物群落结构、组成变化及其与宿主的相互作用关系成为了可能[16]。凭借高通量测序,我们可以准确测定NEC患儿粪便中的异常菌群,从而选取合适的抗生素进行治疗。Shannon指数(即香农威纳指数)是估算样本中微生物多样性的重要指标,其值越大,说明菌群多样性就越高。Simpson 指数则描述从一个群落种连续两次抽样所得到的个体属于同一种属的概率,故该值越大,物种(菌群)多样性越低。在本研究中测量了124例NEC患儿的Shannon指数法和Simpson 指数,发现TNF-a和IL-6浓度越高,Shannon指数越小,二者之间具有密切的负相关性,与此相对应,TNF-a和IL-6浓度越高,Simpson 指数越大。说明NEC会导致患儿肠道中菌群丰度的下降,且这种原因与促炎和抗炎细胞因子IL-6、TNF-α、IL-4的浓度有密切联系。
综上所述,抗炎或促炎细胞因子浓度与NEC的临床分期及肠道菌群丰富度密切相关,可作为NEC病情诊断的辅助指标。
[专业责任编辑:史晓薇]

